名校
解题方法
1 . I.铁、铝是生活中常见金属,用途广泛。完成下列填空:
(1)在碱性溶液中,Al(OH)3的电离方程式为:___________ 。
(2)铝和氧化铁高温下反应得到的熔融物通常为铁铝合金,设计实验证明其含金属铝_____ 。
II.高铁酸钾 是一种集氧化、杀菌、吸附、凝聚等新型多功能高效水处理剂。
是一种集氧化、杀菌、吸附、凝聚等新型多功能高效水处理剂。 在水中发生发如下反应生成具有很强氧化、杀菌能力的新生态氧原子(用
在水中发生发如下反应生成具有很强氧化、杀菌能力的新生态氧原子(用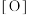 表示):___________
表示):___________ ___________
___________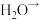 ___________
___________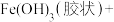 ___________
___________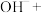 ___________
___________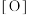
(3)配平上述反应_______ 。此过程中氧化剂是_________ 。(填化学物质)。
(4) 本身不具有吸附性,作为水处理剂为何具有吸附、凝聚等功能?
本身不具有吸附性,作为水处理剂为何具有吸附、凝聚等功能?_______ 。
III.溶液在工业上用于蚀刻铜箔制造电路板。从蚀刻后的废液中可以回收铜并使蚀刻液再生,流程如下(部分物质有省略):
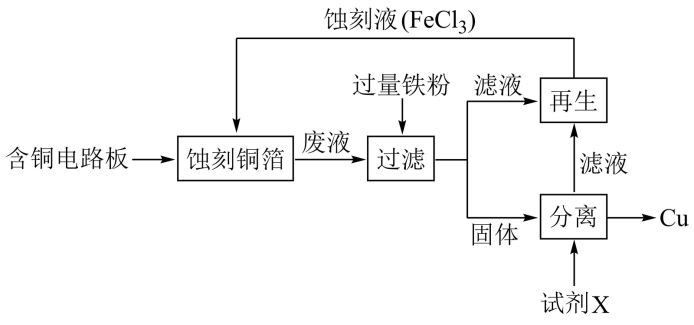
(5) 蚀刻铜箔反应的离子方程式为
蚀刻铜箔反应的离子方程式为___________ 。
(6)从固体中分离出铜,加入的试剂X可以是___________ 。
(7)使滤液再生为蚀刻液可采用的方法是___________ 。
(1)在碱性溶液中,Al(OH)3的电离方程式为:
(2)铝和氧化铁高温下反应得到的熔融物通常为铁铝合金,设计实验证明其含金属铝
II.高铁酸钾
 是一种集氧化、杀菌、吸附、凝聚等新型多功能高效水处理剂。
是一种集氧化、杀菌、吸附、凝聚等新型多功能高效水处理剂。 在水中发生发如下反应生成具有很强氧化、杀菌能力的新生态氧原子(用
在水中发生发如下反应生成具有很强氧化、杀菌能力的新生态氧原子(用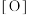 表示):___________
表示):___________ ___________
___________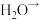 ___________
___________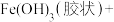 ___________
___________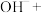 ___________
___________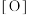
(3)配平上述反应
(4)
 本身不具有吸附性,作为水处理剂为何具有吸附、凝聚等功能?
本身不具有吸附性,作为水处理剂为何具有吸附、凝聚等功能?III.溶液在工业上用于蚀刻铜箔制造电路板。从蚀刻后的废液中可以回收铜并使蚀刻液再生,流程如下(部分物质有省略):

(5)
 蚀刻铜箔反应的离子方程式为
蚀刻铜箔反应的离子方程式为(6)从固体中分离出铜,加入的试剂X可以是
(7)使滤液再生为蚀刻液可采用的方法是
您最近一年使用:0次
2021-10-08更新
|
185次组卷
|
2卷引用:上海市杨浦高级中学2020-2021学年高二上学期第一次月考化学试题
2012·上海虹口·二模
2 . 阅读下列材料,并完成相应填空
钯(Pd)是一种不活泼金属,性质与铂相似。在科研和工业生产中,含钯催化剂不仅用途广泛,且用量大,因此从废催化剂中回收钯具有巨大的经济效益。已知废催化剂的主要成分是钯和活性炭,还含有少量铁、锌。工业上采用如下流程从废催化剂中提取钯。
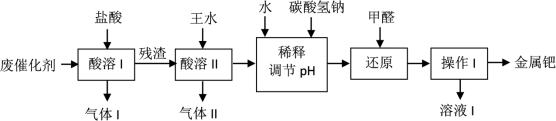
(1)气体I的化学式为__________ ,酸溶I的目的是___________ 。
(2)王水指是浓硝酸和浓盐酸组成的混合物,其体积比为__________ 。残渣与王水发生的反应有:
a. Pd + HCl + HNO3 →……
b.___________ (写出化学方程式并配平)。
(3)若用足量的烧碱吸收气体II,请写出吸收后溶液中含有的溶质的化学式:NaOH、_______ 、________ 、________ 。
(4)写出用NaHCO3调节pH值时发生反应的离子方程式:_________ 。使用甲醛还原钯的化合物时,溶液须保持碱性,否则会造成甲醛的额外损耗,原因是______________ 。
(5)操作I的名称是_______________ ,溶液I可能含有的有机离子为_________ 。
(6)有人提出,在进行酸溶前最好先将废催化剂在700℃下进行灼烧,同时不断通入空气,其目的是____________ 。
钯(Pd)是一种不活泼金属,性质与铂相似。在科研和工业生产中,含钯催化剂不仅用途广泛,且用量大,因此从废催化剂中回收钯具有巨大的经济效益。已知废催化剂的主要成分是钯和活性炭,还含有少量铁、锌。工业上采用如下流程从废催化剂中提取钯。
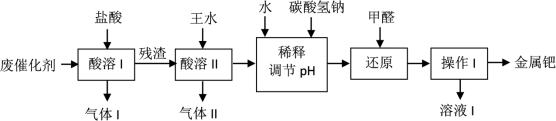
(1)气体I的化学式为
(2)王水指是浓硝酸和浓盐酸组成的混合物,其体积比为
a. Pd + HCl + HNO3 →……
b.
(3)若用足量的烧碱吸收气体II,请写出吸收后溶液中含有的溶质的化学式:NaOH、
(4)写出用NaHCO3调节pH值时发生反应的离子方程式:
(5)操作I的名称是
(6)有人提出,在进行酸溶前最好先将废催化剂在700℃下进行灼烧,同时不断通入空气,其目的是
您最近一年使用:0次
2013·上海闵行·一模
解题方法
3 . 氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是________ (选填编号)。
a.煤的形成 b.原电池工作
c.简单机械织布 d.我国古代烧制陶器
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。“四种基本反应类型与氧化还原反应的关系”可用下图表示。

试写出有水参加的符合反应类型Ⅳ的一个化学方程式:________
工业上利用NaIO3和NaHSO3反应来制取单质I2。
(3)配平下列化学方程式并标明电子转移的方向和数目:
____ NaIO3 + ____ NaHSO3 —____ I2+ ____ Na2SO4 + ____ H2SO4+ ____ H2O,
电子转移的方向和数目__________________
(4)已知:还原性HSO3->I-,若加入的NaHSO3过量,还可能与上述生成物中的________ 反应,离子方程式为__________________ 。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是
a.煤的形成 b.原电池工作
c.简单机械织布 d.我国古代烧制陶器
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。“四种基本反应类型与氧化还原反应的关系”可用下图表示。

试写出有水参加的符合反应类型Ⅳ的一个化学方程式:
工业上利用NaIO3和NaHSO3反应来制取单质I2。
(3)配平下列化学方程式并标明电子转移的方向和数目:
电子转移的方向和数目
(4)已知:还原性HSO3->I-,若加入的NaHSO3过量,还可能与上述生成物中的
您最近一年使用:0次
2014·上海杨浦·三模
解题方法
4 . 氢溴酸是无色、易挥发的液体,在化工领域用途广泛。实验室模拟一种工业制备氢溴酸的主要流程如图:

完成下列填空:
(1)写出反应①的离子方程式___ 。该反应需要在冰水浴中进行,可能的原因是___ 。
(2)操作I用到的玻璃仪器有蒸馏烧瓶、___ 、接液管和锥形瓶。
(3)反应②中Na2SO3的目的是___ 。
(4)反应③中的Ba(OH)2溶液能否用BaCl2或者Ba(NO3)2溶液代替?说明理由___ 。
(5)工业氢溴酸往往呈淡黄色。
①工业氢溴酸呈黄色可能是因为像工业盐酸一样含Fe3+,如何证明含Fe3+?___ 。
②工业氢溴酸呈黄色还可能是因为含___ ,如何证明?___ 。

完成下列填空:
(1)写出反应①的离子方程式
(2)操作I用到的玻璃仪器有蒸馏烧瓶、
(3)反应②中Na2SO3的目的是
(4)反应③中的Ba(OH)2溶液能否用BaCl2或者Ba(NO3)2溶液代替?说明理由
(5)工业氢溴酸往往呈淡黄色。
①工业氢溴酸呈黄色可能是因为像工业盐酸一样含Fe3+,如何证明含Fe3+?
②工业氢溴酸呈黄色还可能是因为含
您最近一年使用:0次
名校
解题方法
5 . 硫铁矿(主要含FeS2)是一种重要的化学矿物原料,主要用于生产硫酸,在橡胶、造纸、纺织、食品、火柴等工业中均有重要用途。在空气中煅烧硫铁矿时的化学反应如下:FeS2+O2 Fe2O3+SO2(未配平)。
Fe2O3+SO2(未配平)。
(1)该反应中,被氧化的元素为______ 。
(2)高温煅烧15.0g含杂质的硫铁矿,充分反应后得到8.0gFe2O3固体(杂质不参加反应),该硫铁矿中FeS2的纯度为______ ,煅烧过程中,放出85.4kJ热量,写出此反应的热化学方程式_______ 。
(3)将Fe2O3溶于稀H2SO4的离子方程式为______ ,向所得溶液中,通入一定量的SO2后,溶液中SO 浓度增大,则此反应的还原产物为
浓度增大,则此反应的还原产物为_____ 。
 Fe2O3+SO2(未配平)。
Fe2O3+SO2(未配平)。(1)该反应中,被氧化的元素为
(2)高温煅烧15.0g含杂质的硫铁矿,充分反应后得到8.0gFe2O3固体(杂质不参加反应),该硫铁矿中FeS2的纯度为
(3)将Fe2O3溶于稀H2SO4的离子方程式为
 浓度增大,则此反应的还原产物为
浓度增大,则此反应的还原产物为
您最近一年使用:0次
2012·上海·零模
解题方法
6 . 氮化硅(Si3N4)是一种新型陶瓷材料,它可用石英与焦炭在高温的氮气流中反应制得: ___ SiO2+ ___ C+___ N2
___ Si3N4+___ CO,根据题意完成下列各题:
(1)配平上述化学反应方程式。
(2)为了保证石英和焦炭尽可能的转化,氮气要适当过量。某次反应用了20mol氮气,反应生成了5mol一氧化碳,则反应中转移电子为_____ NA,此时混合气体的平均相对分子质量是_____ 。
(3)分析反应可推测碳、氮气的氧化性____ >_____ (填化学式)。
(4)氮化硅陶瓷的机械强度高,硬度接近于刚玉(Al2O3),热稳定性好,化学性质稳定。以下用途正确的是____ 。
A 可以在冶金工业上制成坩埚、铝电解槽衬里等热工设备上
B 在电子工业上制成耐高温的电的良导体
C 研发氮化硅的全陶发动机替代同类型金属发动机
D 氮化硅陶瓷的开发,将受到资源的限制,发展前途暗淡

(1)配平上述化学反应方程式。
(2)为了保证石英和焦炭尽可能的转化,氮气要适当过量。某次反应用了20mol氮气,反应生成了5mol一氧化碳,则反应中转移电子为
(3)分析反应可推测碳、氮气的氧化性
(4)氮化硅陶瓷的机械强度高,硬度接近于刚玉(Al2O3),热稳定性好,化学性质稳定。以下用途正确的是
A 可以在冶金工业上制成坩埚、铝电解槽衬里等热工设备上
B 在电子工业上制成耐高温的电的良导体
C 研发氮化硅的全陶发动机替代同类型金属发动机
D 氮化硅陶瓷的开发,将受到资源的限制,发展前途暗淡
您最近一年使用:0次
7 . 碳形成的化合物种类繁多,硅是构成地壳岩石的主要元素。碳在自然界有两种稳定的同位素,有关数据如下表:
请列出碳元素近似相对原子质量的计算式_____________________________________ 。
(1)Si原子的14个电子排布在_______ 个能级上;与硅元素同周期、其原子核外有2个未成对电子的元素的最外层电子排布式为_____________ 。
(2)SiO2用途广泛,以下叙述错误的是______________ 。
a.SiO2是二氧化硅的分子式 b.SiO2中1个Si原子结合4个O原子
c.SiO2是酸性氧化物 d.SiO2熔沸点较高,属于原子晶体
(3)通常状况下,SiF4呈气态。以下叙述正确的是___________ 。
a.Si原子难以形成Si4+ b.SiF4是有极性键的非极性分子
c.固态SiF4是原子晶体 d.相同压强时,SiF4的沸点高于SiCl4
(4)Fe3O4可以写成FeO•Fe2O3,也可写成盐的形式:Fe[Fe2O4]。Pb3O4中含+2价的Pb和+4价的Pb,请将Pb3O4写成两种氧化物的形式___________ ,写成盐的形式__________ 。
(5)Pb的+2价化合物稳定,+4价的Pb能氧化浓盐酸生成Cl2。写出Pb3O4与盐酸反应的化学方程式____________________________________________ 。
| 同位素 | 相对原子质量 | 丰度(原子分数) |
| 12C | 12(整数,相对原子质量的基准) | 0.9893 |
| 13C | 13.003354826 | 0.0107 |
请列出碳元素近似相对原子质量的计算式
(1)Si原子的14个电子排布在
(2)SiO2用途广泛,以下叙述错误的是
a.SiO2是二氧化硅的分子式 b.SiO2中1个Si原子结合4个O原子
c.SiO2是酸性氧化物 d.SiO2熔沸点较高,属于原子晶体
(3)通常状况下,SiF4呈气态。以下叙述正确的是
a.Si原子难以形成Si4+ b.SiF4是有极性键的非极性分子
c.固态SiF4是原子晶体 d.相同压强时,SiF4的沸点高于SiCl4
(4)Fe3O4可以写成FeO•Fe2O3,也可写成盐的形式:Fe[Fe2O4]。Pb3O4中含+2价的Pb和+4价的Pb,请将Pb3O4写成两种氧化物的形式
(5)Pb的+2价化合物稳定,+4价的Pb能氧化浓盐酸生成Cl2。写出Pb3O4与盐酸反应的化学方程式
您最近一年使用:0次
8 . 元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是___ 。
a.原子半径和离子半径均减小 b.金属性减弱,非金属性增强
c.单质的熔点降低 d.氧化物对应的水合物碱性减弱,酸性增强
(2)原子最外层电子数与次外层电子数相同的元素名称为___ ,氧化性最弱的简单阳离子是___ 。
(3)已知:
工业制镁时,电解MgCl2而不电解MgO的原因是___ ;制铝时,电解Al2O3而不电解AlCl3的原因是___ 。
(4)晶体硅(熔点1410℃)是良好的半导体材料.由粗硅制纯硅过程如下:
Si(粗) SiCl4
SiCl4 SiCl4(纯)
SiCl4(纯) Si(纯)
Si(纯)
写出SiCl4的电子式:___ ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式___ 。
(5)下列气体不能用浓硫酸干燥,可用P2O5干燥的是___ 。
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1.写出该反应的化学方程式:___ 。
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是
a.原子半径和离子半径均减小 b.金属性减弱,非金属性增强
c.单质的熔点降低 d.氧化物对应的水合物碱性减弱,酸性增强
(2)原子最外层电子数与次外层电子数相同的元素名称为
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是
(4)晶体硅(熔点1410℃)是良好的半导体材料.由粗硅制纯硅过程如下:
Si(粗)
 SiCl4
SiCl4 SiCl4(纯)
SiCl4(纯) Si(纯)
Si(纯)写出SiCl4的电子式:
(5)下列气体不能用浓硫酸干燥,可用P2O5干燥的是
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1.写出该反应的化学方程式:
您最近一年使用:0次
2019-11-06更新
|
151次组卷
|
3卷引用:上海市华东师大二附中2016-2017学年高二(上)月考化学试卷(12月份)
14-15高三上·上海宝山·阶段练习
名校
解题方法
9 . 高铁酸盐(K2FeO4)在能源、环保等方面有着广泛的用途.湿法、干法制备高铁酸盐的原理如下表所示.
(1)写出干法制备K2FeO4的化学方程式为,_____________________________________ ,该
反应中氧化剂与还原剂的物质的量之比为_______________________________ 。
(2)高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为_______________________________ ,它能净水的原因是_____________________________________ 。
(3)在实验室配制Fe(NO3)3溶液时,若用蒸馏水直接配制,所得溶液往往较浑浊,其原因是(用离子方程式表示)____________________________ ,因此,正确的配制操作是在溶液中加入少量的(填试剂名称)_____________ ,其目的是__________________________ 。
(4)Fe2O3是一种____________ 色的氧化物,写出它和盐酸反应的离子方程式___________ 。
(5)检验Fe3+的方法很多,写出其中的一种检验方法_______________________________ 。
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
反应中氧化剂与还原剂的物质的量之比为
(2)高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为
(3)在实验室配制Fe(NO3)3溶液时,若用蒸馏水直接配制,所得溶液往往较浑浊,其原因是(用离子方程式表示)
(4)Fe2O3是一种
(5)检验Fe3+的方法很多,写出其中的一种检验方法
您最近一年使用:0次
名校
解题方法
10 . 含氯化合物在日常生活中有多种用途,根据要求完成下列问题:
(1)漂粉精的成分是____________ ,工业上使用漂粉精时,会加入少量的稀盐酸,以加快其漂白速率,发生反应的方程式为___________ 。家庭中使用漂白粉时,不加酸也可漂白,反应的化学方程式为______ 。
(2)84消毒液的成分为NaClO,写出氯气与NaOH反应的化学方程式:___________ 。工业上制取的原理为:NaCl+H2O NaClO+H2↑,标出电子转移数目和方向
NaClO+H2↑,标出电子转移数目和方向_________ 。
(3)日常生活中84消毒液若与洁厕灵(较浓的盐酸)混用,发生反应:NaClO+2HCl→NaCl+Cl2+H2O,该反应的氧化剂为___________ ,被氧化的元素为______ 。若反应中电子转移为1.5 mol,生成的氯气为_______ mol。
(4)亚氯酸钠(NaClO2)与盐酸反应也可制取Cl2,尝试写出反应的化学方程式(不需配平):_______ 。
(5)向KOH溶液中通入11.2 L(标准状况)氯气恰好完全反应生成三种含氯盐:0.7 mol KCl、0.2 mol KClO和X。则X是___________ 。
a.0.1 mol KClO4 b.0.1 mol KClO3
c.0.2 mol KClO2 d.0.1 mol KClO2
(1)漂粉精的成分是
(2)84消毒液的成分为NaClO,写出氯气与NaOH反应的化学方程式:
 NaClO+H2↑,标出电子转移数目和方向
NaClO+H2↑,标出电子转移数目和方向(3)日常生活中84消毒液若与洁厕灵(较浓的盐酸)混用,发生反应:NaClO+2HCl→NaCl+Cl2+H2O,该反应的氧化剂为
(4)亚氯酸钠(NaClO2)与盐酸反应也可制取Cl2,尝试写出反应的化学方程式(不需配平):
(5)向KOH溶液中通入11.2 L(标准状况)氯气恰好完全反应生成三种含氯盐:0.7 mol KCl、0.2 mol KClO和X。则X是
a.0.1 mol KClO4 b.0.1 mol KClO3
c.0.2 mol KClO2 d.0.1 mol KClO2
您最近一年使用:0次



