名校
1 . 下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应的本质并不改变的是
| A.Na和O2 | B.NaOH和CO2 | C.Fe和Cl2 | D.木炭(C)和O2 |
您最近一年使用:0次
2 . 下列实验中,不能观察到明显变化的是
| A.把Cl2通入FeCl2溶液中 | B.把溴水滴加到淀粉KI溶液中 |
| C.把一段打磨过的镁放入有酚酞的沸水中 | D.把SO2通入BaCl2溶液中 |
您最近一年使用:0次
名校
3 . 有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属,且C的合金用量最大。三种金属单质A、B、C与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。
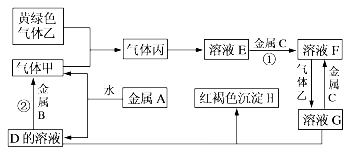
请根据以上信息回答下列问题:
(1)画出A的原子结构示意图:_______________________________________ ,
(2)写出下列物质的化学式: H:__________ 、乙:________________ ,
(3)C的一种氧化物是具有磁性的黑色晶体,该氧化物的化学式是_____________ 。
(4)写出反应①的离子方程式:反应①______________________________ ;
(5)写出反应②的化学方程式:反应②___________________________________ ;
(6)检验溶液E中阴离子的常用方法是____________________ 。

请根据以上信息回答下列问题:
(1)画出A的原子结构示意图:
(2)写出下列物质的化学式: H:
(3)C的一种氧化物是具有磁性的黑色晶体,该氧化物的化学式是
(4)写出反应①的离子方程式:反应①
(5)写出反应②的化学方程式:反应②
(6)检验溶液E中阴离子的常用方法是
您最近一年使用:0次
2018-12-13更新
|
266次组卷
|
2卷引用:吉林省白城市通榆县第一中学2020届高三上学期第二次月考化学试题
名校
4 . 将0.1mol Cl2通入100mL含等物质的量HBr与H2SO3的混合溶液中,有一半的HBr被氧化,则下列说法正确的是
| A.物质的还原性:HBr>H2SO3>HCl |
| B.HBr与H2SO3的物质的量浓度均为0.6mol·L-1 |
| C.通入0.1molCl2发生反应的离子方程式为:5Cl2+4H2SO3+2Br-+4H2O=4SO42-+Br2+10Cl-+16H+ |
| D.若再通入0.05mol Cl2,恰好能将HBr和H2SO3完全氧化 |
您最近一年使用:0次
2018-12-09更新
|
383次组卷
|
11卷引用:吉林省大安市第一中学2020届高三第二次月考化学试题
吉林省大安市第一中学2020届高三第二次月考化学试题吉林省通榆县第一中学2021届高三上学期第二次月考化学试题天津市实验中学2019届高三上学期第二阶段月考化学试题【全国百强校】天津市实验中学2018-2019学年高三上学期第二阶段月考化学试题安徽省太和第一中学2021届高三上学期第一次校本教材反馈测试化学试题天津市滨海新区大港油田一中2019届高三上学期期中考试化学试题【全国百强校】山东省青岛二中2019届高三上学期期中考试化学试题(已下线)第4单元 氧化还原反应(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷(已下线)【浙江新东方】双师130上海交通大学附属中学2021-2022学年高一下学期开学摸底考试化学试题山西省晋城市第一中学校2023-2024学年高三上学期11月期中考试化学试题
5 . 某研究性学习小组的同学利用MnO2、浓盐酸反应来制取干燥的氯气并验证其有无漂白性,所用装置如图所示(可重复使用,不含制气装置)。下列说法正确的是( )
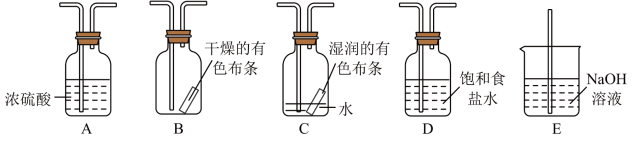

| A.按气流流动的先后顺序,装置连接顺序依次为DACBE |
| B.按气流流动的先后顺序,装置连接顺序依次为DABAE |
| C.装置E的主要用途是制备NaClO |
| D.若实验中使用到装置C且有色布条褪色,则说明湿润的氯气有漂白性 |
您最近一年使用:0次
2018-09-15更新
|
552次组卷
|
8卷引用:吉林省桦甸市第八高级中学2019届高三第一次阶段性考试(8月)化学试题
吉林省桦甸市第八高级中学2019届高三第一次阶段性考试(8月)化学试题四川省遂宁市射洪中学2021-2022学年高一上学期第三次(12月)月考(强基班)化学试题(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第2讲 氧及其化合物【教学案】2020届高三化学一轮复习 化学基础实验(选择题和大题训练)黑龙江省哈尔滨市第一中学2021届高三上学期期中考试化学试题(已下线)第12讲 富集在海水中的元素——卤素(精讲)-2022年一轮复习讲练测(已下线)第12讲 富集在海水中的元素——卤素(讲)-2023年高考化学一轮复习讲练测(全国通用)第3课时 氧化还原反应的应用
解题方法
6 . A、B、C、D四种元素都是短周期元素。A元素的离子具有黄色的焰色反应。B元素的离子结构和Ne具有相同的电子层排布;5.8gB的氢氧化物恰好能与100mL2mol/L盐酸完全反应;B原子核中质子数和中子数相等。H2在C单质中燃烧产生苍白色火焰。D元素原子的电子层结构里,最外层电子数是次外层电子数的3倍。根据上述条件,回答:
(1)元素C位于第_______ 周期________ 族,它的最高价氧化物的化学式为____________ 。
(2)B是________ 元素。
(3)写出B 和 D组成化合物的形成过程______________________________________ 。
(4)A与D形成稳定的化合物的化学式为______________ ,将该化合物加入含有酚酞的水作用实验现象是____________________________________________________________ 。
(5)C元素的单质有毒,可用A 的最高价氧化物对应的水化物的溶液吸收,其离子方程式为_________________________________________________________________________ 。
(1)元素C位于第
(2)B是
(3)写出B 和 D组成化合物的形成过程
(4)A与D形成稳定的化合物的化学式为
(5)C元素的单质有毒,可用A 的最高价氧化物对应的水化物的溶液吸收,其离子方程式为
您最近一年使用:0次
名校
7 . 用下列实验装置进行相应实验,设计正确且能达到实验目的的是( )
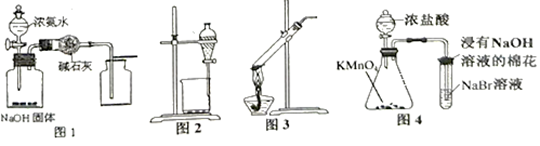

| A.用图1所示装置制取并收集少量纯净的氨气 |
| B.用图2 所示装置分离乙醇和乙酸乙酯的混合溶液 |
| C.用图3所示装置加热分解NaHCO3固体 |
| D.用图4 所示装置比较KMnO4、Cl2、Br2的氧化性强弱 |
您最近一年使用:0次
2018-03-04更新
|
469次组卷
|
6卷引用:吉林省白城市第一中学2020-2021学年高二下学期月考化学试题
名校
8 . 设NA为阿伏伽德罗常数的数值,下列说法中正确的是
| A.常温下,23gNO2和N2O4的混合气体中含有NA个氧原子 |
| B.1mol 氯气与足量的氢氧化钠溶液反应电子转移总数为2NA |
| C.1L0.5mol·L-1FeCl3 溶液完全转化可制得0.5NA 个Fe(OH)3 胶粒 |
| D.标况下11.2LH2O 与4.0gCH4所含氢原子个数均为NA |
您最近一年使用:0次
2018-02-07更新
|
978次组卷
|
2卷引用:吉林江城中学2021-2022学年高三上学期9月月考化学试题
名校
9 . 向100mLFeBr2溶液中通入标况下氯气3.36L,氯气全部被还原,测得溶液c(Br-)=c(Cl-),原溶液中FeBr2溶液的浓度(mol·L-1)
| A.1 | B.1.5 | C.2 | D.2.5 |
您最近一年使用:0次
2017-06-14更新
|
1038次组卷
|
6卷引用:吉林省长春市第十一高中2020-2021学年高一上学期第三学程考试化学试题
10 . 某化学小组研究盐酸被氧化的条件,进行如下实验。
(1)研究盐酸被MnO2氧化。
①Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是_________ 。
②Ⅱ中发生了分解反应,反应的化学方程式是_________ 。
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计试验Ⅳ进行探究(如图1):
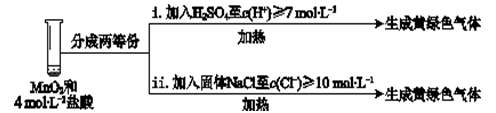
将实验Ⅲ、Ⅳ作对比,得出的结论是_______ ;将实验现象Ⅳ中的i、ii作对比,得出的结论是_______ 。
④用如图装置(a、b均为石墨电极)进行实验Ⅴ:
ⅰ、K闭合时,指针向左偏转
ⅱ、向右管中滴加浓H2SO4至c(H+)>7mol/L,指针偏转幅度变化不大
ⅲ、再向左管中滴加浓H2SO4至c(H+)>7mol/L,指针向左偏转幅度增大

将实验V中的ⅰ和ⅱ、ⅲ作对比,得出的结论是___________ 。
(2)研究盐酸能否被氧化性酸氧化。
①烧瓶中放入浓H2SO4,通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象。由此得出浓硫酸___________ (填“能”或“不能”)氧化盐酸。
②向试管中加入3mL浓盐酸,在加入1mL浓HNO3,试管内液体逐渐变为橙色,加热,产生棕黄色气体,经检验含有NO2。
通过实验Ⅰ、Ⅱ、Ⅲ证明混合气体中含有Cl2,Ⅲ的操作是_________ 。
(3)由上述实验得出:盐酸能否被氧化与氧化剂的种类、__________ 有关。
(1)研究盐酸被MnO2氧化。
| 实验 | 操作 | 现象 |
| Ⅰ | 常温下将MnO2和12mol/L浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
| Ⅱ | 将Ⅰ中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
| Ⅲ | 加热MnO2和4mol/L稀盐酸混合物 | 无明显现象 |
①Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是
②Ⅱ中发生了分解反应,反应的化学方程式是
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计试验Ⅳ进行探究(如图1):

将实验Ⅲ、Ⅳ作对比,得出的结论是
④用如图装置(a、b均为石墨电极)进行实验Ⅴ:
ⅰ、K闭合时,指针向左偏转
ⅱ、向右管中滴加浓H2SO4至c(H+)>7mol/L,指针偏转幅度变化不大
ⅲ、再向左管中滴加浓H2SO4至c(H+)>7mol/L,指针向左偏转幅度增大

将实验V中的ⅰ和ⅱ、ⅲ作对比,得出的结论是
(2)研究盐酸能否被氧化性酸氧化。
①烧瓶中放入浓H2SO4,通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象。由此得出浓硫酸
②向试管中加入3mL浓盐酸,在加入1mL浓HNO3,试管内液体逐渐变为橙色,加热,产生棕黄色气体,经检验含有NO2。
通过实验Ⅰ、Ⅱ、Ⅲ证明混合气体中含有Cl2,Ⅲ的操作是
| 实验 | 操作 | 现象 |
| Ⅰ | 将湿润的淀粉KI试纸伸入棕黄色气体中 | 试纸先变蓝,后褪色 |
| Ⅱ | 将湿润的淀粉KI试纸伸入纯净Cl2中 | 试纸先变蓝,后褪色 |
| Ⅲ | …… | 试纸先变蓝,不褪色 |
(3)由上述实验得出:盐酸能否被氧化与氧化剂的种类、
您最近一年使用:0次
2017-05-08更新
|
291次组卷
|
3卷引用:吉林省长春市十一高中2022届高三上学期第一学程考试化学试题



