1 . 按要求写出化学方程式或离子方程式
(1)碳酸氢钠溶液与氢氧化钠溶液反应的离子方程式_________ 。
(2)氢氧化钙溶液与过量碳酸氢钠溶液反应的离子方程式_______ 。
(3)钠与硫酸铜溶液反应的化学方程式____________ 。
(4)制漂白粉的原理的化学方程式____________ 。
(1)碳酸氢钠溶液与氢氧化钠溶液反应的离子方程式
(2)氢氧化钙溶液与过量碳酸氢钠溶液反应的离子方程式
(3)钠与硫酸铜溶液反应的化学方程式
(4)制漂白粉的原理的化学方程式
您最近一年使用:0次
名校
2 . 氯气极其相关产品在生产生活中应用广泛。
(1)氯气属于有毒气体,贮氯罐意外泄漏时,消防员会喷洒稀氢氧化钠溶液,其作用是__________ 。(用化学方程式表示)。
实验室常用NaOH溶液吸收多余的氯气,下列也可用于吸收氯气的是_________ (填字母)。
a.NaCl溶液 b.FeSO4溶液 c.KMnO4溶液
(2)家庭中常用消毒液(主要成分NaClO)、洁厕灵(主要成分盐酸)等清洁卫生。某品牌消毒液包装上的说明如下图。
①分析“对金属制品有腐蚀作用”的原因:_______________ 。
②需“密闭保存”的原因:______________ 。
③“与洁厕灵同时使用”会产生有毒的氯气,请写出反应的离子方程式_____________ 。
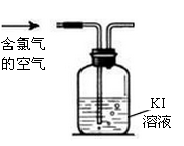
(3)已知空气中氯气含量超过0.1mg/m3就会引起中毒。某液氯生产车间在一次测定空气中氯气的含量时,测得消耗0.001ml/L Kl溶液100mL,为了判断空气中氯气的含量是否超标,还需要获得的数据是_______ 。
(1)氯气属于有毒气体,贮氯罐意外泄漏时,消防员会喷洒稀氢氧化钠溶液,其作用是
实验室常用NaOH溶液吸收多余的氯气,下列也可用于吸收氯气的是
a.NaCl溶液 b.FeSO4溶液 c.KMnO4溶液
(2)家庭中常用消毒液(主要成分NaClO)、洁厕灵(主要成分盐酸)等清洁卫生。某品牌消毒液包装上的说明如下图。

①分析“对金属制品有腐蚀作用”的原因:
②需“密闭保存”的原因:
③“与洁厕灵同时使用”会产生有毒的氯气,请写出反应的离子方程式
(3)已知空气中氯气含量超过0.1mg/m3就会引起中毒。某液氯生产车间在一次测定空气中氯气的含量时,测得消耗0.001ml/L Kl溶液100mL,为了判断空气中氯气的含量是否超标,还需要获得的数据是
您最近一年使用:0次
3 . 现有A、B、C三种气体,A是密度最小的气体,B在通常情况下呈黄绿色,纯净的A可以在B中安静地燃烧生成C。把气体B通入到适量石灰乳中可以得到白色浑浊物D。请据此回答下列问题:
(1)写出下列各反应的化学方程式
①实验室制备气体B:______
②将气体B通入到适量石灰乳中:__________
(2)把三种气体分别通入酸性硝酸银溶液中,出现白色沉淀的气体是________ (用字母表示)。
(3)将白色浑浊物D溶于水得到澄清溶液,
①向澄清溶液中滴加碳酸钠溶液观察到出现沉淀,发生反应的化学方程式为___________
②白色浑浊物D因具有漂白性又称为________ ,该物质在空气中容易变质的原因为(用化学方程式表示)_____________
(1)写出下列各反应的化学方程式
①实验室制备气体B:
②将气体B通入到适量石灰乳中:
(2)把三种气体分别通入酸性硝酸银溶液中,出现白色沉淀的气体是
(3)将白色浑浊物D溶于水得到澄清溶液,
①向澄清溶液中滴加碳酸钠溶液观察到出现沉淀,发生反应的化学方程式为
②白色浑浊物D因具有漂白性又称为
您最近一年使用:0次
解题方法
4 . Ⅰ.NaClO是“84”消毒液的有效成分。请回答下列问题:
(1)NaClO中Cl元素的化合价是________ 。
(2)浸泡衣物时加入“84”消毒液,在空气中放置一段时间后漂白效果更好,结合离子方程式解释原因:_______________ 。(已知酸性: )
)
(3)若将“84”消毒液与洁厕灵(主要成分是HCl)混合使用,会产生黄绿色的有毒气体,其反应的离子方程式是____________________ 。
Ⅱ. 是一种有毒气体,如果泄漏会造成严重的危害。
是一种有毒气体,如果泄漏会造成严重的危害。
(1)已知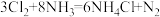 ,化工厂可用浓氨水来检验
,化工厂可用浓氨水来检验 是否泄漏。该反应中被氧化和未被氧化的
是否泄漏。该反应中被氧化和未被氧化的 分子的个数比为
分子的个数比为______________ 。
(2)喷射石灰乳等碱性物质可以减轻少量 泄漏造成的危害。
泄漏造成的危害。 和石灰乳反应的化学方程式是
和石灰乳反应的化学方程式是__________________ 。
(3)实验室常用烧碱溶液吸收 。若将
。若将 通入热的烧碱溶液中,可以得到NaCl、NaClO和
通入热的烧碱溶液中,可以得到NaCl、NaClO和 的混合液。当混合液中
的混合液。当混合液中 和
和 的个数比为15∶2时,混合液中
的个数比为15∶2时,混合液中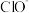 和
和 的个数比为
的个数比为_______________ 。
(1)NaClO中Cl元素的化合价是
(2)浸泡衣物时加入“84”消毒液,在空气中放置一段时间后漂白效果更好,结合离子方程式解释原因:
 )
)(3)若将“84”消毒液与洁厕灵(主要成分是HCl)混合使用,会产生黄绿色的有毒气体,其反应的离子方程式是
Ⅱ.
 是一种有毒气体,如果泄漏会造成严重的危害。
是一种有毒气体,如果泄漏会造成严重的危害。(1)已知
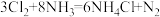 ,化工厂可用浓氨水来检验
,化工厂可用浓氨水来检验 是否泄漏。该反应中被氧化和未被氧化的
是否泄漏。该反应中被氧化和未被氧化的 分子的个数比为
分子的个数比为(2)喷射石灰乳等碱性物质可以减轻少量
 泄漏造成的危害。
泄漏造成的危害。 和石灰乳反应的化学方程式是
和石灰乳反应的化学方程式是(3)实验室常用烧碱溶液吸收
 。若将
。若将 通入热的烧碱溶液中,可以得到NaCl、NaClO和
通入热的烧碱溶液中,可以得到NaCl、NaClO和 的混合液。当混合液中
的混合液。当混合液中 和
和 的个数比为15∶2时,混合液中
的个数比为15∶2时,混合液中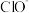 和
和 的个数比为
的个数比为
您最近一年使用:0次
2020-10-02更新
|
987次组卷
|
6卷引用:【浙江新东方】34
(已下线)【浙江新东方】34人教版(2019)高一必修第一册 第二章 海水中的重要元素 第二节 氯及其化合物 作业帮高一必修第一册(苏教2019)专题3 第一单元 氯气及氯的化合物4吉林省吉林市永吉县第四中学2022-2023学年高一上学期期中考试化学试题(已下线)题型43 次氯酸、氯的含氧酸盐的性质和应用【定心卷】2.2.1 氯气的性质随堂练习-人教版2023-2024学年必修第一册
5 . 某校化学兴趣小组用浓盐酸与二氧化锰加热反应来制取并收集氯气,装置如下图:

(1)写出该反应的离子方程式:______________
(2)上述反应中,还原剂是________ ,若有2 mol氧化剂参加反应,转移电子的物质的量是________ mol。
(3)实验开始前,某学生对装置进行了气密性检查。方法是:连接好装置之后,用弹簧夹夹住________ 处(填“A”或“B”)橡皮管;向分液漏斗中加水并打开活塞,当加到一定量时,停止加水,静置观察。当观察到分液漏斗中______________ 时,表明该装置不漏气。
(4)兴趣小组的某些同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为其中错误的是________ (填写序号)。
A 氢氧化钠溶液 B 碳酸钠溶液 C 浓硫酸

(1)写出该反应的离子方程式:
(2)上述反应中,还原剂是
(3)实验开始前,某学生对装置进行了气密性检查。方法是:连接好装置之后,用弹簧夹夹住
(4)兴趣小组的某些同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为其中错误的是
A 氢氧化钠溶液 B 碳酸钠溶液 C 浓硫酸
您最近一年使用:0次
解题方法
6 . 化学与人类生活密切相关。请按要求,回答下列问题:
(1) 春秋末期工艺官书《考工记》中记载有“涑帛”的方法,即利用含有碳酸钠的水溶液来洗涤丝帛。请写出碳酸钠水溶液中通入CO2气体的化学方程式__________ ,将54.8g Na2CO3和NaHCO3的混合物分成等量的两份,一份溶于水后加入足量盐酸,收集到气体V L,另一份直接加热至恒重,生成气体2.24L(所有气体体积均在标准状况下测定),则原固体混合物中Na2CO3的物质的量:n(Na2CO3)=__ ,气体V=___ 。
(2)“84”消毒液在生活中使用广泛,其有效成分是次氯酸钠。可在常温下将氯气通入NaOH溶液制得,该反应的离子方程式为_______ ,若有2mol氯气参与该反应,则此时转移的电子数为___ NA。
(3)小苏打可用于治疗胃酸过多,其反应的离子方程式为______ 。
(4)长石是地表岩石最重要的造岩矿物。某种长石的化学组成KAlSi3O8则将其改写成氧化物的组合形式为_______ 。
(1) 春秋末期工艺官书《考工记》中记载有“涑帛”的方法,即利用含有碳酸钠的水溶液来洗涤丝帛。请写出碳酸钠水溶液中通入CO2气体的化学方程式
(2)“84”消毒液在生活中使用广泛,其有效成分是次氯酸钠。可在常温下将氯气通入NaOH溶液制得,该反应的离子方程式为
(3)小苏打可用于治疗胃酸过多,其反应的离子方程式为
(4)长石是地表岩石最重要的造岩矿物。某种长石的化学组成KAlSi3O8则将其改写成氧化物的组合形式为
您最近一年使用:0次
解题方法
7 . (1)加入双氧水能提高软锰矿(主要成分是MnO2)的浸出率,锰转化成Mn2+。写出酸性条件下双氧水提高软锰矿浸出率的离子方程式:_________ 。
(2)碘与氢氧化钠反应的生成物中含有IO3-,写出反应过程的离子方程式:___ 。
(3) 电镀污泥中的Cr2O3与加入的Na2CO3在空气中焙烧,Cr2O3被氧化为Na2CrO4,还有CO2逸出,写出该反应的化学方程式:_____________ 。
(4)某科研小组在实验室用较浓的KOH溶液直接吸收氯气,研究发现反应进行一段时间后开始出现KClO3并逐渐增多,产生KClO3的离子方程式是_______ 。
(5) 用氧缺位铁酸铜(CuFe2O4-x)作催化剂,利用太阳能热化学循环分解H2O也可制H2,其物质转化如图1所示。
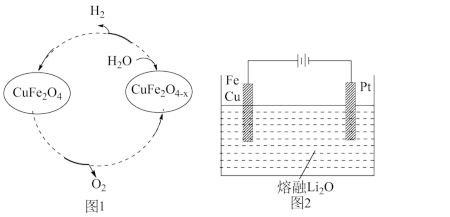
①氧缺位铁酸铜(CuFe2O4-x)与水反应的化学方程式为_________ 。
②CuFe2O4可用电化学方法得到,其原理如图2所示,则阳极的电极反应式为_________ 。
(2)碘与氢氧化钠反应的生成物中含有IO3-,写出反应过程的离子方程式:
(3) 电镀污泥中的Cr2O3与加入的Na2CO3在空气中焙烧,Cr2O3被氧化为Na2CrO4,还有CO2逸出,写出该反应的化学方程式:
(4)某科研小组在实验室用较浓的KOH溶液直接吸收氯气,研究发现反应进行一段时间后开始出现KClO3并逐渐增多,产生KClO3的离子方程式是
(5) 用氧缺位铁酸铜(CuFe2O4-x)作催化剂,利用太阳能热化学循环分解H2O也可制H2,其物质转化如图1所示。

①氧缺位铁酸铜(CuFe2O4-x)与水反应的化学方程式为
②CuFe2O4可用电化学方法得到,其原理如图2所示,则阳极的电极反应式为
您最近一年使用:0次
名校
8 . 2020年突如其来的“新冠肺炎”使人们认识到日常杀菌消毒的重要性。其中含氯消毒剂在生产生活中有着广泛的用途。
(1)工业上将氯气溶于一定浓度的氢氧化钠溶液可制得“84消毒液”,用电子式表示“84消毒液”的有效成分是__________ 。
(2)二氧化氯(ClO2)是一种黄绿色易溶于水的气体,也可用于自来水的杀菌消毒。工业上常用NaClO3和Na2SO3溶液混合并加入稀H2SO4酸化后反应制得,反应中NaClO3和Na2SO3的物质的量之比为______________ 。
(1)工业上将氯气溶于一定浓度的氢氧化钠溶液可制得“84消毒液”,用电子式表示“84消毒液”的有效成分是
(2)二氧化氯(ClO2)是一种黄绿色易溶于水的气体,也可用于自来水的杀菌消毒。工业上常用NaClO3和Na2SO3溶液混合并加入稀H2SO4酸化后反应制得,反应中NaClO3和Na2SO3的物质的量之比为
您最近一年使用:0次
9 . 根据下列实验过程,请回答:
(1)在常温下,将氯气通入氢氧化钠溶液中,所发生反应的离子方程式为:__ ;所得溶液具有漂白性,其有效成分的名称为__ 。
(2)将上述呈碱性的溶液与FeCl3溶液混合,可制得一种新型绿色消毒剂——高铁酸钠(Na2FeO4),反应如下:3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O则该反应中的氧化产物是__ (填离子符号),当反应中转移电子的数目是0.3NA时,所消耗的氧化剂的物质的量为__ 。
(3)证实最终所得溶液中含有Na+的操作是:进行焰色实验时,火焰呈现__ 色。
(1)在常温下,将氯气通入氢氧化钠溶液中,所发生反应的离子方程式为:
(2)将上述呈碱性的溶液与FeCl3溶液混合,可制得一种新型绿色消毒剂——高铁酸钠(Na2FeO4),反应如下:3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O则该反应中的氧化产物是
(3)证实最终所得溶液中含有Na+的操作是:进行焰色实验时,火焰呈现
您最近一年使用:0次
2020-04-28更新
|
168次组卷
|
3卷引用:广西百色市田阳区田阳高中2021-2022学年高一上学期12月月考化学试题
名校
10 . 氯及其化合物在日常生活中有广泛应用。漂白液通常用于家庭和公共场所的消毒,某品牌漂白液的包装说明如下:
(1)该漂白液中,NaClO的物质的量浓度约为___ mol·L-1。
(2)使用NaOH溶液和氯气来制取消毒液,写出该反应的离子方程式___ ,制取500mL此漂白液,需要5.0mol·L-1的NaOH溶液___ mL。
(3)漂白液易吸收空气中的CO2而生成NaHCO3,写出有关的化学方程式___ 。
| 净含量:500mL 密度:1.12g·cm-3 主要成分:7.45%NaClO 使用方法:稀释100倍(体积比)后使用 注意事项:密封保存,易吸收空气中的CO2变质 |
(1)该漂白液中,NaClO的物质的量浓度约为
(2)使用NaOH溶液和氯气来制取消毒液,写出该反应的离子方程式
(3)漂白液易吸收空气中的CO2而生成NaHCO3,写出有关的化学方程式
您最近一年使用:0次
2020-04-03更新
|
134次组卷
|
2卷引用:百校联盟2019-2020学年高一上学期第四次月考化学试题 化学



