解题方法
1 . “84”消毒液是一种常见的含氯消毒剂。
(1)“84”消毒液的有效成分为_______ (用化学式表示)。
(2)常温下,将氯气通入NaOH溶液中可制得“84”消毒液。写出反应的离子方程式:_______ 。
(3)针对不同物品消毒,“84”消毒液需要稀释到不同浓度使用。取含次氯酸钠0.2mol·L-1的“84”消毒液1mL,加水稀释至100mL,稀释后的溶液中次氯酸钠的物质的量浓度为_______  。
。
(1)“84”消毒液的有效成分为
(2)常温下,将氯气通入NaOH溶液中可制得“84”消毒液。写出反应的离子方程式:
(3)针对不同物品消毒,“84”消毒液需要稀释到不同浓度使用。取含次氯酸钠0.2mol·L-1的“84”消毒液1mL,加水稀释至100mL,稀释后的溶液中次氯酸钠的物质的量浓度为
 。
。
您最近一年使用:0次
名校
解题方法
2 . 按要求书写化学方程式或离子方程式。
(1)工业上用将氯气通入石灰乳中制漂白粉,相应的化学方程式为___________ 。
(2)硫酸厂附近的新收集雨水pH不断降低,相应的化学方程式为___________ 。
(3)木炭和浓硫酸混合加热产生大量的CO2和SO2,相应的化学方程式为___________ 。
(4)工业上用FeCl3溶液腐蚀铜线路板,相应的离子 方程式为___________ 。
(5)SO2能使氯水褪色,相应的离子 方程式为___________ 。
(1)工业上用将氯气通入石灰乳中制漂白粉,相应的化学方程式为
(2)硫酸厂附近的新收集雨水pH不断降低,相应的化学方程式为
(3)木炭和浓硫酸混合加热产生大量的CO2和SO2,相应的化学方程式为
(4)工业上用FeCl3溶液腐蚀铜线路板,相应的
(5)SO2能使氯水褪色,相应的
您最近一年使用:0次
3 . 消毒剂在生产生活中有极其重要的作用,开发具有广谱、高效、低毒的杀菌剂和消毒剂是今后发展的趋势。
(1) 、
、 、
、 (还原产物为
(还原产物为 )、
)、 都可以做消毒剂,都具有
都可以做消毒剂,都具有___________ 性。
(2)将紫色石蕊试液滴入氯水中现象是___________ 。
(3)漂白剂亚氯酸钠( )在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为
)在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为 (未配平)。在该反应中,被氧化的元素是
(未配平)。在该反应中,被氧化的元素是___________ ,13.7g 完全反应转移电子数是
完全反应转移电子数是___________ 。
(4)“84”消毒液(主要成分是NaClO),用氯气制取NaClO的离子方程式是___________ ,使用“84”消毒液时加入少量的稀硫酸效果更好,原理是___________ (用离子方程式表示)。
(1)
 、
、 、
、 (还原产物为
(还原产物为 )、
)、 都可以做消毒剂,都具有
都可以做消毒剂,都具有(2)将紫色石蕊试液滴入氯水中现象是
(3)漂白剂亚氯酸钠(
 )在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为
)在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为 (未配平)。在该反应中,被氧化的元素是
(未配平)。在该反应中,被氧化的元素是 完全反应转移电子数是
完全反应转移电子数是(4)“84”消毒液(主要成分是NaClO),用氯气制取NaClO的离子方程式是
您最近一年使用:0次
名校
4 . “84消毒液”是一种以NaClO为有效成分的高效消毒剂,在新冠肺炎防治中被广泛用于宾馆、旅游、医院、家庭等的卫生消毒。
Ⅰ.如表为“84”消毒液说明书,请回答下列问题。
(1)常温下用烧碱溶液吸收Cl2制备“84”消毒液。写出该反应的离子方程式___ ,若将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO和NaClO3的混合液。当混合液中Cl-和ClO 的个数比为15∶2时,混合液中ClO-和ClO
的个数比为15∶2时,混合液中ClO-和ClO 的个数比为
的个数比为___ ,从氧化还原角度分析Cl2表现了___ 性。
(2)家庭用“84”消毒液用法强调,做家庭物品消毒时,要做适当的稀释,喷洒后也不要急于用清水擦拭,要浸泡,这样效果会更好,原因是___ (用离子方程式表达)。(已知:酸性:H2CO3>HClO>HCO ),家庭消毒马桶时,不可在用洁厕灵(主要成分是盐酸)清洗马桶后,立刻使用“84”消毒液消毒,否则会产生黄绿色的有毒气体,其反应的离子方程式是
),家庭消毒马桶时,不可在用洁厕灵(主要成分是盐酸)清洗马桶后,立刻使用“84”消毒液消毒,否则会产生黄绿色的有毒气体,其反应的离子方程式是___ 。
Ⅱ.某“84消毒液”瓶体部分标签如图1所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
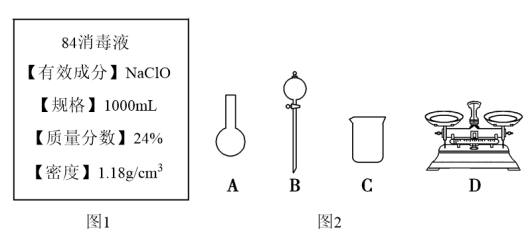
(3)此“84消毒液”的物质的量浓度约为___ mol·L-1。(计算结果保留一位小数)
(4)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL该消毒液。
①如图2所示的仪器中配制溶液需要使用的是___ 。(填仪器序号),还缺少的玻璃仪器是___ 。
②请计算该同学配制此溶液需用托盘天平称量NaClO固体的质量为___ g。
(5)若实验遇下列情况,导致所配溶液的物质的量浓度偏高的是___ (填字号)。
Ⅰ.如表为“84”消毒液说明书,请回答下列问题。
 说明书 | 药品名称 | 84消毒液 |
| 主要成分 | NaClO,有效氯含量50.00g/L~60.00g/L | |
| 注意事项 | 不可与其他洗涤剂或消毒液混合使用 | |
| 用法用量 | 稀释后浸泡或洗刷白色衣物,浴缸等1:200水溶液餐饮具,瓜果等1:100水溶液 |
(1)常温下用烧碱溶液吸收Cl2制备“84”消毒液。写出该反应的离子方程式
 的个数比为15∶2时,混合液中ClO-和ClO
的个数比为15∶2时,混合液中ClO-和ClO 的个数比为
的个数比为(2)家庭用“84”消毒液用法强调,做家庭物品消毒时,要做适当的稀释,喷洒后也不要急于用清水擦拭,要浸泡,这样效果会更好,原因是
 ),家庭消毒马桶时,不可在用洁厕灵(主要成分是盐酸)清洗马桶后,立刻使用“84”消毒液消毒,否则会产生黄绿色的有毒气体,其反应的离子方程式是
),家庭消毒马桶时,不可在用洁厕灵(主要成分是盐酸)清洗马桶后,立刻使用“84”消毒液消毒,否则会产生黄绿色的有毒气体,其反应的离子方程式是Ⅱ.某“84消毒液”瓶体部分标签如图1所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(3)此“84消毒液”的物质的量浓度约为
(4)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL该消毒液。
①如图2所示的仪器中配制溶液需要使用的是
②请计算该同学配制此溶液需用托盘天平称量NaClO固体的质量为
(5)若实验遇下列情况,导致所配溶液的物质的量浓度偏高的是
| A.定容时俯视制度线 | B.转移前,容量瓶内有蒸馏水 |
| C.未冷至室温就转移定容 | D.定容时水多用胶头滴管吸出 |
您最近一年使用:0次
名校
解题方法
5 . 工业上用 和碱制漂白粉、漂粉精及漂白液。请回答下列问题:
和碱制漂白粉、漂粉精及漂白液。请回答下列问题:
(1) Ca(ClO)2中Cl元素的化合价是___________ ;工业上将氯气制成漂白粉的主要目的是___________ 。工业上制成漂白粉的化学方程式:___________ 。
(2)下列物质露置在空气中会变质,在变质过程中既有非氧化还原反应发生,又有氧化还原反应发生的是___________(填字母)。
(3)浸泡衣物时加入漂粉精(有效成分Ca(ClO)2)在空气中放置一段时间漂白效果更好,请用化学方程式解释原因:___________ 。
(4)若将漂白液(有效成分NaClO)与洁厕灵(主要成分是盐酸)混合使用,则会产生有毒气体,其反应的离子方程式是___________ 。
(5)有效氯是漂白粉中有效成分Ca(ClO)2含量大小的标志。
已知:①Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;
②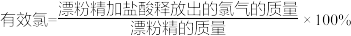 。
。
若某漂粉精的有效氯为60%,该漂粉精中Ca(ClO)2的质量分数为___________ (计算结果保留一位小数)。
 和碱制漂白粉、漂粉精及漂白液。请回答下列问题:
和碱制漂白粉、漂粉精及漂白液。请回答下列问题:(1) Ca(ClO)2中Cl元素的化合价是
(2)下列物质露置在空气中会变质,在变质过程中既有非氧化还原反应发生,又有氧化还原反应发生的是___________(填字母)。
| A.生石灰 | B.漂白粉 |
| C.NaOH | D. |
(4)若将漂白液(有效成分NaClO)与洁厕灵(主要成分是盐酸)混合使用,则会产生有毒气体,其反应的离子方程式是
(5)有效氯是漂白粉中有效成分Ca(ClO)2含量大小的标志。
已知:①Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;
②
 。
。若某漂粉精的有效氯为60%,该漂粉精中Ca(ClO)2的质量分数为
您最近一年使用:0次
名校
6 . NaCN超标的电镀废水可用两段氧化法处理:
a.NaCN与NaClO反应,生成NaOCN和NaCl
b.NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
已知HCN(Ki=6.3×10-10)有剧毒;HCN、HOCN中N元素的化合价相同。
完成下列填空:
(1)第一次氧化时,溶液的pH应调节为___________ (选填“酸性”、“碱性”或“中性”);原因是___________ 。
(2)写出第二次氧化时发生反应的离子方程式。___________
(3)(CN)2与Cl2的化学性质相似。(CN)2与NaOH溶液反应生成___________ 、___________ 和H2O。
a.NaCN与NaClO反应,生成NaOCN和NaCl
b.NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
已知HCN(Ki=6.3×10-10)有剧毒;HCN、HOCN中N元素的化合价相同。
完成下列填空:
(1)第一次氧化时,溶液的pH应调节为
(2)写出第二次氧化时发生反应的离子方程式。
(3)(CN)2与Cl2的化学性质相似。(CN)2与NaOH溶液反应生成
您最近一年使用:0次
2021-11-09更新
|
49次组卷
|
2卷引用:江苏省徐州市王杰中学2021-2022学年高三10月学情调研化学试题
7 . 回答下列问题:
(1)下列说法正确的是___ (填序号)。
①将1molNaCl溶解在1L水中,可得1mol·L-1NaCl的溶液
②实验室需要450mL0.1mol·L-1的硫酸铜溶液,则需要用天平称量12.5g胆矾进行配制
③用量筒量取浓硫酸配制一定浓度的稀硫酸时,格筒内液体转移后应对量筒进行洗涤,并将洗涤液转移到容量瓶中,以免所配溶液浓度偏低
④将0.4gNaOH溶于水配成100mL溶液,从中取出10mL,所取溶液物质的量浓度为0.1mol·L-1
(2)做有关氯气性质的实验中需要用烧碱溶液吸收剩余的氯气,发生的化学反应式为___ 。
(3)同温同压条件下,等质量的CO2与O2的体积比为___ ,原子数之比为___ ,密度之比为___ 。
(4)7.8g过氧化钠跟水反应,得到100mL溶液,反应后所得溶液的物质的浓度是__ 。
(1)下列说法正确的是
①将1molNaCl溶解在1L水中,可得1mol·L-1NaCl的溶液
②实验室需要450mL0.1mol·L-1的硫酸铜溶液,则需要用天平称量12.5g胆矾进行配制
③用量筒量取浓硫酸配制一定浓度的稀硫酸时,格筒内液体转移后应对量筒进行洗涤,并将洗涤液转移到容量瓶中,以免所配溶液浓度偏低
④将0.4gNaOH溶于水配成100mL溶液,从中取出10mL,所取溶液物质的量浓度为0.1mol·L-1
(2)做有关氯气性质的实验中需要用烧碱溶液吸收剩余的氯气,发生的化学反应式为
(3)同温同压条件下,等质量的CO2与O2的体积比为
(4)7.8g过氧化钠跟水反应,得到100mL溶液,反应后所得溶液的物质的浓度是
您最近一年使用:0次
8 . 游泳池水中的氯气含量应该控制在0.5~1.0 mg·L-1之间。
(1)写出氯气溶于水的化学方程式:___________ 。溶于水后的哪种物质可杀菌消毒:___________ (写化学式)。
(2)如图显示一星期中每天19时游泳池水中的氯气含量,哪几天19时使用游泳池不安全?___________ 。
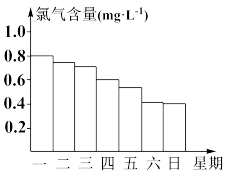
(3)你认为哪几天的天气炎热、阳光强烈?___________ ,说出一种理由___________ 。
(4)若把一片紫色的花瓣放入氯水中,可观察到的现象是___________ (花瓣所含色素性质与石蕊相似)。
(5)小型游泳池通常使用次氯酸钠溶液而非氯气给池水消毒,用化学方程式说明工业上如何生产次氯酸钠:___________ 。
(1)写出氯气溶于水的化学方程式:
(2)如图显示一星期中每天19时游泳池水中的氯气含量,哪几天19时使用游泳池不安全?

(3)你认为哪几天的天气炎热、阳光强烈?
(4)若把一片紫色的花瓣放入氯水中,可观察到的现象是
(5)小型游泳池通常使用次氯酸钠溶液而非氯气给池水消毒,用化学方程式说明工业上如何生产次氯酸钠:
您最近一年使用:0次
2021-10-26更新
|
67次组卷
|
2卷引用:福建省永安市第三中学高中校2021-2022学年高一上学期10月月考化学试题
解题方法
9 . 氯水中含有多种成分,因而具有多种性质,根据新制氯水(a)分别与图四种物质发生的反应填空(b、c、d、e 中重合部分代表物质间反应, 且氯水足量)。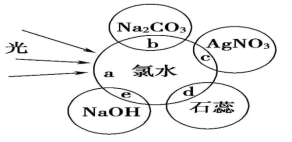
(1)能证明氯水具有漂白性的是______________ (填“b”“c”“d”或“e”)。
(2)c 过程中的现象是______ 。实验 室处理尾气氯气的化学方程式为_________
(3)久置的氯水变为______ , 用化学反应方程式表示为_____________ 。
(4)漂白粉的漂白原理_________ 。

(1)能证明氯水具有漂白性的是
(2)c 过程中的现象是
(3)久置的氯水变为
(4)漂白粉的漂白原理
您最近一年使用:0次
2021-10-23更新
|
207次组卷
|
2卷引用:山东省菏泽市单县第五中学希望部2021-2022学年高一上学期第一次月考化学试题
名校
10 .  和浓盐酸在一定温度下反应,会生成橙黄色的易爆物二氧化氯
和浓盐酸在一定温度下反应,会生成橙黄色的易爆物二氧化氯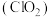 气体,该反应的化学方程式为
气体,该反应的化学方程式为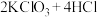 (浓)
(浓) 。
。
(1)该反应的氧化剂是___________ 还原产物是___________ (化学式)。氧化性
___________  (填< > =)。
(填< > =)。
(2)用双线桥在方程式中标出电子转移的情况:___________
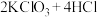 (浓)
(浓) 。
。
(3)以上反应中盐酸具有的性质是___________(填序号)。
(4)当发生二氧化氯泄漏和爆炸事故,人们逃离爆炸现场时,可用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的物质是___________(填序号)。
 和浓盐酸在一定温度下反应,会生成橙黄色的易爆物二氧化氯
和浓盐酸在一定温度下反应,会生成橙黄色的易爆物二氧化氯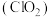 气体,该反应的化学方程式为
气体,该反应的化学方程式为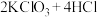 (浓)
(浓) 。
。(1)该反应的氧化剂是

 (填< > =)。
(填< > =)。(2)用双线桥在方程式中标出电子转移的情况:
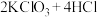 (浓)
(浓) 。
。(3)以上反应中盐酸具有的性质是___________(填序号)。
| A.只有还原性 | B.只有氧化性 |
| C.还原性和酸性 | D.氧化性和还原性,还有酸性 |
| A.NaOH | B.NaCl | C.KCl | D.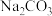 |
您最近一年使用:0次
2021-10-22更新
|
415次组卷
|
2卷引用:黑龙江省哈尔滨市第六中学2021-2022学年高一上学期10月月考化学试题



