名校
解题方法
1 . 实验是进行化学研究的重要手段之一、请回答下列问题:
(1)如图装置中,若A中盛有品红溶液,B中盛有氢氧化钠溶液。
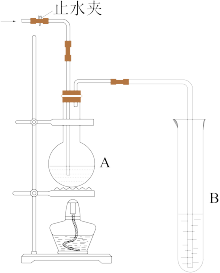
①向 A 中通入足量的 SO2气体,然后加热,整个过程中 A 中出现___________ 的现象。
②向 A 中通入足量的 Cl2气体,然后加热,整个过程中 A 中出现___________ 的现象,B 装置的作用___________ 。
(2)若 A 中盛的是浓硫酸,加入足量的铜片后,关闭止水夹并加热,写出 A中发生反应的化学方程式:___________ ;B 中发生反应的离子方程式:___________ 。
(3)若A 中盛放的是溴水,向 A 中通入足量的 SO2气体,则 A 中出现溴水褪色 ,解释这一现象的原因是:___________ 。(用化学方程式表示)
(1)如图装置中,若A中盛有品红溶液,B中盛有氢氧化钠溶液。

①向 A 中通入足量的 SO2气体,然后加热,整个过程中 A 中出现
②向 A 中通入足量的 Cl2气体,然后加热,整个过程中 A 中出现
(2)若 A 中盛的是浓硫酸,加入足量的铜片后,关闭止水夹并加热,写出 A中发生反应的化学方程式:
(3)若A 中盛放的是溴水,向 A 中通入足量的 SO2气体,则 A 中出现溴水褪色 ,解释这一现象的原因是:
您最近一年使用:0次
2 . 某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验,请回答下列问题:

(1)装置A中盛放亚硫酸钠(Na2SO3)的仪器名称是___________ ,其中发生反应的化学方程式为___________ 。
(2)实验过程中,装置B中紫红色变为无色,说明SO2具有___________ (填“氧化性”或“还原性”)。
(3)装置D的目的是探究SO2与品红溶液作用的可逆性,请写出实验操作及现象___________ 。
(4)尾气可以用NaOH溶液吸收,其反应的离子方程式为___________ 。

(1)装置A中盛放亚硫酸钠(Na2SO3)的仪器名称是
(2)实验过程中,装置B中紫红色变为无色,说明SO2具有
(3)装置D的目的是探究SO2与品红溶液作用的可逆性,请写出实验操作及现象
(4)尾气可以用NaOH溶液吸收,其反应的离子方程式为
您最近一年使用:0次
3 . 某化学课外兴趣小组为探究铜与浓硫酸的反应情况,用如图所示装置进行有关实验。请回答:

(1)装置A中发生反应的化学方程式为:___________ 。
(2)装置D中试管口放置的棉花应事先用一种液体浸湿,这种液体是___________
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭止水夹K并移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是___________ 。B中应放置的液体是___________ (填字母)。
A.水 B.酸性KMnO4溶液 C.浓溴水 D.饱和NaHSO3溶液
(4)实验中,取一定质量的铜片和一定体积18 mol·L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是___________
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是___________ (填字母)。
A.铁粉 B.BaCl2溶液 C.银粉 D.NaHCO3溶液

(1)装置A中发生反应的化学方程式为:
(2)装置D中试管口放置的棉花应事先用一种液体浸湿,这种液体是
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭止水夹K并移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是
A.水 B.酸性KMnO4溶液 C.浓溴水 D.饱和NaHSO3溶液
(4)实验中,取一定质量的铜片和一定体积18 mol·L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是
A.铁粉 B.BaCl2溶液 C.银粉 D.NaHCO3溶液
您最近一年使用:0次
2021-04-09更新
|
192次组卷
|
3卷引用:山东省嘉祥县第一中学2020-2021学年高一下学期第一次月考化学试题
解题方法
4 . 某研究性学习小组利用如图所示装置探究二氧化硫的性质。已知该实验过程可产生足量的二氧化硫。(装置中固定仪器未画出)
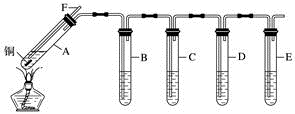
(1)A中所装试剂为铜片和_______ (填试剂名称),导管F的作用是_______ 。
(2)D中的试剂为0.5mol·L-1BaCl2溶液,实验中无明显现象,若改为同浓度的Ba(NO3)2溶液,则出现白色沉淀,此沉淀的化学式为_______ ,证明SO2具有_______ 性。
(3)装置B用于验证SO2的漂白性,则其中所装溶液为_______ (填字母)。
A.酸性高锰酸钾溶液B.品红溶液
C.石蕊溶液D.蓝色的碘-淀粉溶液
(4)实验时,B中溶液褪色,并有大量气泡冒出,但始终未见C中饱和澄清石灰水出现浑浊或沉淀。请推测可能的原因:_______ 。
(5)E中Na2S溶液用于验证SO2的氧化性,可观察到的现象为_______ 。
(6)指出上述装置中的不足之处:_______ 。

(1)A中所装试剂为铜片和
(2)D中的试剂为0.5mol·L-1BaCl2溶液,实验中无明显现象,若改为同浓度的Ba(NO3)2溶液,则出现白色沉淀,此沉淀的化学式为
(3)装置B用于验证SO2的漂白性,则其中所装溶液为
A.酸性高锰酸钾溶液B.品红溶液
C.石蕊溶液D.蓝色的碘-淀粉溶液
(4)实验时,B中溶液褪色,并有大量气泡冒出,但始终未见C中饱和澄清石灰水出现浑浊或沉淀。请推测可能的原因:
(5)E中Na2S溶液用于验证SO2的氧化性,可观察到的现象为
(6)指出上述装置中的不足之处:
您最近一年使用:0次
5 . SO2和Cl2是中学化学中常见的气体,探究二者的制法和性质是十分重要的内容。
(1)实验室可通过铜与浓硫酸加热制SO2。请写出该反应的化学方程式_______ ,该反应中氧化剂与还原剂的物质的量之比为:_______ 。
(2)某同学用如图装置探究SO2、Cl2的化学性质。通过控制弹簧夹a、b,向X中分别通入不同气体:
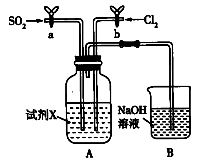
①若关闭b,打开a,X溶液为品红溶液,则X中的现象为_______ ,说明二氧化硫具有_______ 性。
②若关闭a,打开b,X溶液为紫色石蕊试液,则X中的现象为_______ 。
③若同时打开a、b,X溶液为紫色石蕊试液,同时通入体积比(同温同压)为1:1的气体,则X中的现象为_______ ,与②中现象不同的原因是_______ (用化学方程式表示)。
(1)实验室可通过铜与浓硫酸加热制SO2。请写出该反应的化学方程式
(2)某同学用如图装置探究SO2、Cl2的化学性质。通过控制弹簧夹a、b,向X中分别通入不同气体:

①若关闭b,打开a,X溶液为品红溶液,则X中的现象为
②若关闭a,打开b,X溶液为紫色石蕊试液,则X中的现象为
③若同时打开a、b,X溶液为紫色石蕊试液,同时通入体积比(同温同压)为1:1的气体,则X中的现象为
您最近一年使用:0次
2021-05-20更新
|
315次组卷
|
4卷引用:武汉市江夏实验高中2020-2021学年高一下学期3月月考化学试题
武汉市江夏实验高中2020-2021学年高一下学期3月月考化学试题(已下线)4.1.1 二氧化硫的性质与应用-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)云南省弥勒市第一中学2021-2022学年高一下学期第四次月考化学试题重庆市巫山大昌中学校2021-2022学年高一下学期期末考试化学试题
6 . (NH4)2Fe(SO4)2•6H2O俗称“摩尔盐”,是一种重要的化学试剂。当隔绝空气加热至500℃时,摩尔盐可完全分解,某小组欲探究其分解产物,设计实验如下,请回答:
(I)该小组认为分解产物可能有以下几种情况:
A.Fe2O3、SO3、NH3、H2O B.FeO、SO3、NH3、H2O
C.FeO、SO2、NH3、H2O D.Fe2O3、SO2、SO3、NH3、H2O
经认真分析,确定猜想___________ 不成立(填序号);
(II)为进一步确认分解产物,该小组设计了如下实验装置探究:
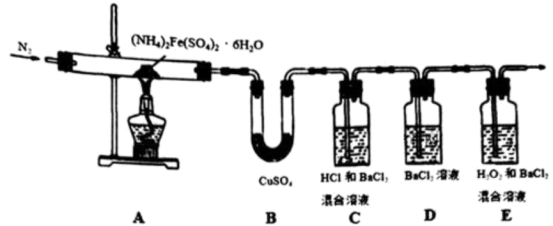
(1)仪器B的名称为___________ ;
(2)加热前先通一段时间N2,加热至完全分解后再通入过量N2,实验过程中观察到装置D始终无明显现象,装置C和E均产生白色沉淀。
①下列判断不正确的是___________
A.C中的沉淀一定有BaSO4
B.C中的沉淀不可能含有BaSO3
C.加热至完全分解后再通入过量N2的目的是将分解产生的气体全部排到B、C装置中使其全部被吸收
D.D中无明显现象是因为SO2不能与BaCl2反应
②写出E中所发生反应的化学方程式___________ ;
(III)实验结束后,A中的固体变为红棕色,某同学猜测可能还有FeO,并设计实验验证:
第一步:该红色固体用___________ 溶解(填“盐酸”或“稀硫酸”);
第二步:为了检验是否存在Fe2+,向所得溶液中滴加___________ 试剂,观察是否褪色。
(I)该小组认为分解产物可能有以下几种情况:
A.Fe2O3、SO3、NH3、H2O B.FeO、SO3、NH3、H2O
C.FeO、SO2、NH3、H2O D.Fe2O3、SO2、SO3、NH3、H2O
经认真分析,确定猜想
(II)为进一步确认分解产物,该小组设计了如下实验装置探究:

(1)仪器B的名称为
(2)加热前先通一段时间N2,加热至完全分解后再通入过量N2,实验过程中观察到装置D始终无明显现象,装置C和E均产生白色沉淀。
①下列判断不正确的是
A.C中的沉淀一定有BaSO4
B.C中的沉淀不可能含有BaSO3
C.加热至完全分解后再通入过量N2的目的是将分解产生的气体全部排到B、C装置中使其全部被吸收
D.D中无明显现象是因为SO2不能与BaCl2反应
②写出E中所发生反应的化学方程式
(III)实验结束后,A中的固体变为红棕色,某同学猜测可能还有FeO,并设计实验验证:
第一步:该红色固体用
第二步:为了检验是否存在Fe2+,向所得溶液中滴加
您最近一年使用:0次
名校
解题方法
7 . 某小组同学验证SO2的性质。装置如图所示,培养皿中A、B、C三个塑料瓶盖内盛有不同物质。向Na2SO3固体上滴加70%硫酸,迅速用玻璃片将培养皿盖严,实验记录如下。
已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O
(1)瓶盖___ (填字母)中的实验现象能证明SO2具有还原性。
(2)瓶盖C中发生反应的化学方程为___ 。
(3)瓶盖C无明显变化,若要证明C中发生了化学反应,可先在蒸馏水中滴入少量试剂x,x是___ (填字母)。
a.石蕊溶液 b.NaCl溶液
(4)上述实验可证明SO2具有还原性、___ 等性质。
| 实验装置 | 瓶盖 | 物质 | 实验现象 |
 | A | KMnO4酸性溶液 | 溶液褪色 |
| B | 蘸有品红溶液的棉花 | 品红溶液褪色 | |
| C | 蒸馏水 | 无明显变化 |
(1)瓶盖
(2)瓶盖C中发生反应的化学方程为
(3)瓶盖C无明显变化,若要证明C中发生了化学反应,可先在蒸馏水中滴入少量试剂x,x是
a.石蕊溶液 b.NaCl溶液
(4)上述实验可证明SO2具有还原性、
您最近一年使用:0次
2021-05-06更新
|
183次组卷
|
3卷引用:北京教育学院附属中学2020-2021学年高一下学期期中考试化学试题
8 . 二氧化硫是国内外允许使用的一种食品添加剂,可用于食物的增白、防腐等,但必须严格遵守国家有关标准使用。某学习小组设计了如图装置用于制取SO2并验证其性质。
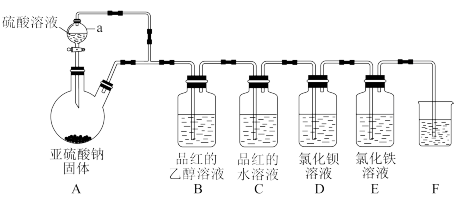
(1)仪器a的名称为_______ 。
(2)烧杯F中的试剂可以是_______ .(填序号)。
a.饱和Na2SO3溶液b.饱和Na2CO3溶液c.NaOH 溶液d.饱和NaCl溶液
(3)实验时装置E中溶液的现象为_______ 。
(4)实验时观察到装置B无明显现象,装置C红色褪去,则使品红的水溶液褪色的微粒一定不是_______ (填化学式)。
(5)学生甲预测装置D中没有白色沉淀产生,但随着反应的进行,发现装置D中产生了少量白色沉淀。为进一步探究产生沉淀的原因,分别用煮沸和未煮沸过的蒸馏水配制的Ba(NO3)2和BaCl2溶液,进行如下实验:
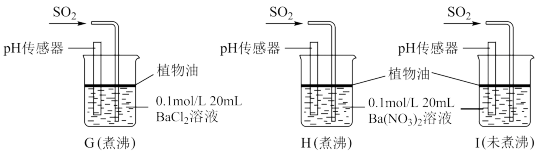
实验中G、H、I烧杯中观察到的现象如表:
①据 G 中现象得出的结论是_______ 。
②H 中白色沉淀的化学式为_______ ,其产生的原因是_______ (用离子方程式表示)。
③I 中出现白色沉淀的速率比 H 中快很多的原因可能是_______ 。

(1)仪器a的名称为
(2)烧杯F中的试剂可以是
a.饱和Na2SO3溶液b.饱和Na2CO3溶液c.NaOH 溶液d.饱和NaCl溶液
(3)实验时装置E中溶液的现象为
(4)实验时观察到装置B无明显现象,装置C红色褪去,则使品红的水溶液褪色的微粒一定不是
(5)学生甲预测装置D中没有白色沉淀产生,但随着反应的进行,发现装置D中产生了少量白色沉淀。为进一步探究产生沉淀的原因,分别用煮沸和未煮沸过的蒸馏水配制的Ba(NO3)2和BaCl2溶液,进行如下实验:

实验中G、H、I烧杯中观察到的现象如表:
| 烧杯 | 实验现象 |
| G | 无白色沉淀产生,pH传感器测的溶液pH=5.3 |
| H | 有白色沉淀产生 |
| I | 有白色沉淀产生,I中出现白色沉淀比H中快很多 |
②H 中白色沉淀的化学式为
③I 中出现白色沉淀的速率比 H 中快很多的原因可能是
您最近一年使用:0次
名校
解题方法
9 . 下图为实验室制取氨气、二氧化硫气体及有关性质实验的组合装置。
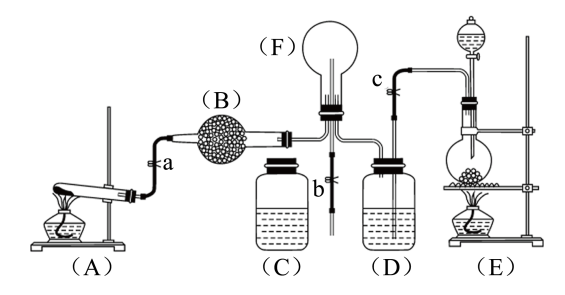
(1)如果A、E是气体制取装置,则按照题目要求,A中制取气体的化学反应方程式为____ ;
(2)实验中,B加入的药品是___ ;D中盛放的是____
(3)先加热A装置,使产生气体通入烧瓶F中,此时弹簧夹a、b打开、c关闭。当F中充满A中气体后,A停止制气,关闭a,打开弹簧夹c,使E中气体通入F中;
①如何测知F中已充满大量A中气体:____ ;
②E中气体进入F后,触发F中气体发生反应的操作是将烧瓶导管与塑料瓶C连接,并完成喷泉实验,F中气体发生反应的化学方程式为____ ;
(4)为了有效实现NO和NO2的相互转化,设计如下实验:按图组装好实验装置,并检查装置气密性,实验前用排水法收集半瓶NO气体。

①打开止水夹,推动针筒活塞,使氧气进入烧瓶。
②关上止水夹,轻轻摇动烧瓶,此时,观察到烧瓶中的现象为____
(5)可用酸性高锰酸钾溶液,吸收上述实验中的尾气,已知NO能与 在酸性条件下反应生成
在酸性条件下反应生成 和Mn2+,写出该反应的离子方程式
和Mn2+,写出该反应的离子方程式_____ 。

(1)如果A、E是气体制取装置,则按照题目要求,A中制取气体的化学反应方程式为
(2)实验中,B加入的药品是
(3)先加热A装置,使产生气体通入烧瓶F中,此时弹簧夹a、b打开、c关闭。当F中充满A中气体后,A停止制气,关闭a,打开弹簧夹c,使E中气体通入F中;
①如何测知F中已充满大量A中气体:
②E中气体进入F后,触发F中气体发生反应的操作是将烧瓶导管与塑料瓶C连接,并完成喷泉实验,F中气体发生反应的化学方程式为
(4)为了有效实现NO和NO2的相互转化,设计如下实验:按图组装好实验装置,并检查装置气密性,实验前用排水法收集半瓶NO气体。

①打开止水夹,推动针筒活塞,使氧气进入烧瓶。
②关上止水夹,轻轻摇动烧瓶,此时,观察到烧瓶中的现象为
(5)可用酸性高锰酸钾溶液,吸收上述实验中的尾气,已知NO能与
 在酸性条件下反应生成
在酸性条件下反应生成 和Mn2+,写出该反应的离子方程式
和Mn2+,写出该反应的离子方程式
您最近一年使用:0次
2021-05-10更新
|
235次组卷
|
2卷引用:广东省珠海市第二中学2020-2021学年高一下学期期中考试化学试题
解题方法
10 . 大气污染物SO2是一种无色刺激性气味气体。某学习小组利用下图所示装置探究SO2的相关性质:

回答下列问题:
(1)装置 A 用于制取SO2气体,其中发生反应的化学方程式为_______ 。
(2)实验开始时,先打开分液漏斗的_______ (填“玻璃塞 a”或“活塞 b”,下同),再打开_______ ,逐滴加入80%的H2SO4;
(3)一段时间后,装置 B 中出现淡黄色(S)沉淀,可证明SO2具有_______ (填“氧化性”或“还原性”);
(4)充分反应后取装置 C 中溶液,加入_______ (填“AgNO3溶液”、“品红溶液”或“BaCl2溶液”),出现_______ 现象,可证明SO2具有还原性;
(5)装置 D 的作用是_______ ,发生的离子方程式为_______

回答下列问题:
(1)装置 A 用于制取SO2气体,其中发生反应的化学方程式为
(2)实验开始时,先打开分液漏斗的
(3)一段时间后,装置 B 中出现淡黄色(S)沉淀,可证明SO2具有
(4)充分反应后取装置 C 中溶液,加入
(5)装置 D 的作用是
您最近一年使用:0次



