解题方法
1 . 高铁酸钠( )是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用离子方程式表示为
)是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用离子方程式表示为 。下列说法错误的是
。下列说法错误的是
 )是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用离子方程式表示为
)是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用离子方程式表示为 。下列说法错误的是
。下列说法错误的是A. 中 中 原子的杂化轨道类型为 原子的杂化轨道类型为 |
B.该反应中氧化产物与还原产物的物质的量之比为 |
| C.依据该反应原理,可设计原电池 |
D.完全反应后,可用 溶液检验反应后的溶液中是否存在 溶液检验反应后的溶液中是否存在 |
您最近一年使用:0次
2 . 根据下列实验操作和实验现象,得出相应实验结论错误的是
| 实验操作 | 实验现象 | 实验结论 | |
| A | 向AgCl悬浊液中加入少量KI固体 | 沉淀由白色转化为黄色 |  |
| B | 向2mL0.1mol·L-1的FeCl3溶液中加入足量铁粉,振荡,加1滴KSCN溶液 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性: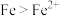 |
| C | 测定不同浓度NaHCO3溶液与Na2CO3溶液的pH | 后者pH更大 |  的水解程度小于 的水解程度小于 |
| D | 向滴有酚酞的Na2SO3溶液中加入少量BaCl2固体 | 生成白色沉淀,且红色逐渐变浅 | Na2SO3溶液中存在水解平衡 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其转化如下图所示(CuS不溶于水),下列说法中不正确的是

| A.过程①中,生成CuS的反应为H2S+Cu2+=CuS↓+2H+ |
| B.过程②中,Fe3+作氧化剂 |
| C.过程③中,氧化剂和还原剂的物质的量之比为4:1 |
D.回收S的总反应为2H2S+O2 2H2O+2S↓ 2H2O+2S↓ |
您最近一年使用:0次
2023-12-15更新
|
759次组卷
|
13卷引用:湖南省邵东市第三中学2023-2024学年高二上学期1月期末考试化学试卷
湖南省邵东市第三中学2023-2024学年高二上学期1月期末考试化学试卷 湖南省长沙市明德中学2023-2024学年高一上学期期末考试化学试题湖南省长沙市周南中学2023-2024学年高一下学期开学考试化学试题北京师范大学2023--2024学年附属实验中学高一上学期化学12月统练黑龙江省肇东市第四中学2023-2024学年高一上学期期末考试化学试卷福建省三明第一中学2023-2024学年高一上学期12月月考化学试题山东省淄博第七中学2023-2024学年高一上学期阶段检测(月考)化学试题北京师范大学附属实验中学2023-2024学年高一上学期12月月考化学试题海南省白沙学校2023-2024学年高一上学期期末考试化学试题安徽省合肥市六校联盟2023-2024学年高一上学期1月期末化学试题江西省上饶市广丰一中2023-2024学年高一上学期12月考试化学试卷安徽省安庆市第七中学2023-2024学年高一下学期开学考试化学试题重庆市巴川国际高级中学校2023-2024学年高一下学期第一次月考化学试题
名校
解题方法
4 . 某小组在验证反应“ ”,实验探究过程如下。结合探究过程回答下列问题。
”,实验探究过程如下。结合探究过程回答下列问题。
向硝酸酸化的 硝酸银溶液中(忽略
硝酸银溶液中(忽略 的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。
的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。
(1)检测到滤液中含有 ,可以选用的试剂为
,可以选用的试剂为___________ (填化学式)溶液。 产生的原因可能有以下几种。
产生的原因可能有以下几种。
假设a:可能是铁粉表面有氧化层,能产生 。
。
假设b:空气中存在 ,
, 被氧化为
被氧化为 ,写出反应的离子方程式:
,写出反应的离子方程式:___________ 。
假设c:酸性溶液中的 具有氧化性,可产生
具有氧化性,可产生 。
。
(2)某同学证明上面假设c不成立,向硝酸酸化的___________ 硝酸钠溶液中加入过量铁粉,搅拌后静置,一段时间后,上层清液未变黄色,经检验无 。
。
(3)取过滤后的黑色固体,洗涤后,___________ (填操作和现象),证明黑色固体中含有Ag。
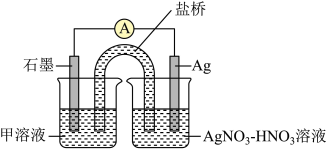
(4)某同学利用原电池证明 可以将
可以将 氧化为
氧化为 ,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除
,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除 )。甲溶液中的溶质为
)。甲溶液中的溶质为___________ 。写出石墨电极上发生的电极反应式:___________ 。电流表指针不再偏转后,向左侧烧杯中加入 固体,发现电流表指针反向偏转,此时石墨电极为
固体,发现电流表指针反向偏转,此时石墨电极为___________ (填“正极”或“负极”),银电极的电极反应式为___________ 。
 ”,实验探究过程如下。结合探究过程回答下列问题。
”,实验探究过程如下。结合探究过程回答下列问题。向硝酸酸化的
 硝酸银溶液中(忽略
硝酸银溶液中(忽略 的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。
的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。(1)检测到滤液中含有
 ,可以选用的试剂为
,可以选用的试剂为 产生的原因可能有以下几种。
产生的原因可能有以下几种。假设a:可能是铁粉表面有氧化层,能产生
 。
。假设b:空气中存在
 ,
, 被氧化为
被氧化为 ,写出反应的离子方程式:
,写出反应的离子方程式:假设c:酸性溶液中的
 具有氧化性,可产生
具有氧化性,可产生 。
。(2)某同学证明上面假设c不成立,向硝酸酸化的
 。
。(3)取过滤后的黑色固体,洗涤后,
(4)某同学利用原电池证明
 可以将
可以将 氧化为
氧化为 ,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除
,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除 )。甲溶液中的溶质为
)。甲溶液中的溶质为 固体,发现电流表指针反向偏转,此时石墨电极为
固体,发现电流表指针反向偏转,此时石墨电极为
您最近一年使用:0次
2023-10-26更新
|
612次组卷
|
7卷引用:湖南省娄底市新化县2023-2024学年高二上学期期末考试化学试题
名校
解题方法
5 . 下列实验操作能达到实验目的的是
| 选项 | 操作 | 目的 |
| A | 取一张pH试纸放在表面皿上,用洁净的玻璃棒蘸取NaClO溶液滴于试纸的中部,与标准比色卡对比 | 测定NaClO溶液的pH |
| B | 向含有酚酞的 溶液中滴入 溶液中滴入 溶液,观察溶液颜色的变化 溶液,观察溶液颜色的变化 | 证明 溶液中存在水解平衡 溶液中存在水解平衡 |
| C | 取等体积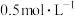 和 和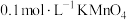 溶液分别滴加3滴 溶液分别滴加3滴 草酸溶液,观察变色情况 草酸溶液,观察变色情况 | 探究浓度对化学反应速率的影响 |
| D | 将 样品溶于稀盐酸后,滴加KSCN溶液,观察溶液是否变红 样品溶于稀盐酸后,滴加KSCN溶液,观察溶液是否变红 | 检验 样品是否变质 样品是否变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
6 . 取一定体积的两种试剂进行反应,改变两种试剂的滴加顺序(试剂浓度均为 ),反应现象没有明显差别的是
),反应现象没有明显差别的是
 ),反应现象没有明显差别的是
),反应现象没有明显差别的是| 选项 | 试剂① | 试剂② |
| A | 盐酸 |  溶液 溶液 |
| B |  溶液 溶液 |  溶液 溶液 |
| C |  溶液 溶液 | 酸性 溶液 溶液 |
| D |  溶液 溶液 |  溶液 溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-09-17更新
|
89次组卷
|
2卷引用:湖南省长沙市周南中学2023-2024学年高二上学期入学考试化学试题
名校
7 . 绿矾( )是一种绿色晶体,是治疗缺铁性贫血的特效药,临床上主要用于慢性失血的治疗。某工厂以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾,生产工艺流程如下图所示:
)是一种绿色晶体,是治疗缺铁性贫血的特效药,临床上主要用于慢性失血的治疗。某工厂以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾,生产工艺流程如下图所示:

查询资料,得有关物质的数据如下表
(1)检验制得的绿矾晶体中是否含有 ,最好选用的试剂为_______。
,最好选用的试剂为_______。
(2)操作Ⅱ中,通入硫化氢至饱和的目的是_______ ,在溶液中用硫酸酸化至 的目的是
的目的是_______ 。
(3)操作Ⅳ的顺序依次为_______ 、冷却结晶、_______ 。
(4)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②_______ 。
(5)测定绿矾产品中 含量的方法是:
含量的方法是:
a.称取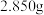 绿矾产品,溶解,在
绿矾产品,溶解,在 容量瓶中定容;
容量瓶中定容;
b.量取 待测溶液于锥形瓶中;
待测溶液于锥形瓶中;
c.用硫酸酸化的
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液体积的平均值为
溶液体积的平均值为 。
。
①判断此滴定实验达到终点的方法是_______ 。
②计算上述样品中 的质量分数为
的质量分数为_______ 。
 )是一种绿色晶体,是治疗缺铁性贫血的特效药,临床上主要用于慢性失血的治疗。某工厂以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾,生产工艺流程如下图所示:
)是一种绿色晶体,是治疗缺铁性贫血的特效药,临床上主要用于慢性失血的治疗。某工厂以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾,生产工艺流程如下图所示:
查询资料,得有关物质的数据如下表
| 25℃时 | pH |
饱和 溶液 溶液 | 3.9 |
 沉淀完全 沉淀完全 | 1.6 |
 开始沉淀 开始沉淀 | 3.0 |
 沉淀完全 沉淀完全 | 5.5 |
(1)检验制得的绿矾晶体中是否含有
 ,最好选用的试剂为_______。
,最好选用的试剂为_______。A. 溶液 溶液 | B. 溶液 溶液 | C. 溶液 溶液 | D.新制氯水 |
(2)操作Ⅱ中,通入硫化氢至饱和的目的是
 的目的是
的目的是(3)操作Ⅳ的顺序依次为
(4)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②
(5)测定绿矾产品中
 含量的方法是:
含量的方法是:a.称取
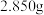 绿矾产品,溶解,在
绿矾产品,溶解,在 容量瓶中定容;
容量瓶中定容;b.量取
 待测溶液于锥形瓶中;
待测溶液于锥形瓶中;c.用硫酸酸化的

 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液体积的平均值为
溶液体积的平均值为 。
。①判断此滴定实验达到终点的方法是
②计算上述样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
8 . 用含铬不锈钢废渣(含 、
、 、
、 、
、 等)制取
等)制取 (铬绿)的工艺流程如图所示:
(铬绿)的工艺流程如图所示:

回答下列问题:
(1)“碱熔”时,为使废渣充分氧化可采取的措施是_____ 。
(2) 、KOH、
、KOH、 反应生成
反应生成 的化学方程式为
的化学方程式为_____ 。
(3)为检验“水浸”后的滤液中是否含有 ,可选用的化学试剂是
,可选用的化学试剂是_____ 。
(4)常温下,“酸化”时pH不宜过低的原因是_____ ;若此时溶液的 ,则
,则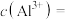
_____  。{已知:常温下,
。{已知:常温下,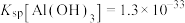 }
}
(5)“还原”时发生反应的离子方程式为_____ 。
(6)由 制取铬绿的方法是
制取铬绿的方法是_____ 。
 、
、 、
、 、
、 等)制取
等)制取 (铬绿)的工艺流程如图所示:
(铬绿)的工艺流程如图所示:
回答下列问题:
(1)“碱熔”时,为使废渣充分氧化可采取的措施是
(2)
 、KOH、
、KOH、 反应生成
反应生成 的化学方程式为
的化学方程式为(3)为检验“水浸”后的滤液中是否含有
 ,可选用的化学试剂是
,可选用的化学试剂是(4)常温下,“酸化”时pH不宜过低的原因是
 ,则
,则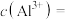
 。{已知:常温下,
。{已知:常温下,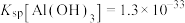 }
}(5)“还原”时发生反应的离子方程式为
(6)由
 制取铬绿的方法是
制取铬绿的方法是
您最近一年使用:0次
解题方法
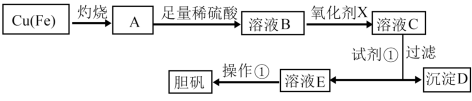
9 . 下图是利用废铜屑(含杂质铁)制备胆矾(硫酸铜晶体)的流程。
已知:
请回答:
(1)溶液B中含有的阳离子有_______ (填离子符号)。
(2)下列物质中最适宜做氧化剂X的是_______ (填字母)。
a.NaClO b.H2O2 c.KMnO4
(3)加入试剂①是为了调节pH,试剂①可以选择_______ (填化学式)。
(4)沉淀D加入盐酸可以得到FeCl3,关于FeCl3溶液的性质中说法不正确的是_______ 。
a.将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
b.向FeCl3溶液滴加NaOH溶液,出现红褐色沉淀
c.将FeCl3溶液加热蒸干并灼烧,得到FeCl3固体
d.向FeCl3溶液中滴加KSCN溶液,溶液变为红色
(5)沉淀D加入盐酸和铁粉,可以制得FeCl2溶液,实验室保存FeCl2溶液,需加入过量的铁粉,其原因是_______ (用离子方程式表示),还需要加入过量的盐酸,原因是_______ 。

已知:
| 溶液中被沉淀离子 | Fe3+ | Fe2+ | Cu2+ |
| 完全生成氢氧化物沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
(1)溶液B中含有的阳离子有
(2)下列物质中最适宜做氧化剂X的是
a.NaClO b.H2O2 c.KMnO4
(3)加入试剂①是为了调节pH,试剂①可以选择
(4)沉淀D加入盐酸可以得到FeCl3,关于FeCl3溶液的性质中说法不正确的是
a.将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
b.向FeCl3溶液滴加NaOH溶液,出现红褐色沉淀
c.将FeCl3溶液加热蒸干并灼烧,得到FeCl3固体
d.向FeCl3溶液中滴加KSCN溶液,溶液变为红色
(5)沉淀D加入盐酸和铁粉,可以制得FeCl2溶液,实验室保存FeCl2溶液,需加入过量的铁粉,其原因是
您最近一年使用:0次
名校
解题方法
10 . 将H2S和空气的混合气体通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法错误的是
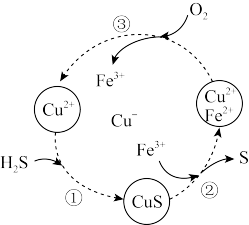

| A.整个转化过程中Fe3+可以循环使用 |
| B.过程①发生复分解反应 |
C.过程②中,发生反应的离子方程式为 |
| D.过程中n(Fe3+)不变,当有1mol硫生成时,消耗0.5molO2 |
您最近一年使用:0次
2022-09-06更新
|
1060次组卷
|
9卷引用:湖南省永州市第一中学2022-2023学年高二下学期开学考试化学试题
湖南省永州市第一中学2022-2023学年高二下学期开学考试化学试题广东省茂名市“五校联盟” 2021-2022学年高一上学期期末联考化学试题辽宁省大连市2022-2023学年高一上学期期末考试化学试题山东省临沂第四中学本部2022-2023学年高一上学期期末考试化学试题广东省广州市协和中学、华侨中学和增城中学三校2022-2023学年高一上学期期末联考化学试题辽宁省铁岭市清河高级中学2022-2023学年高一上学期期末考试化学试题山东省枣庄市第八中学南校2022-2023学年高一1月线上测试化学试题广东省广州市白云中学2022-2023学年高一上学期期末考试化学试题江西省南昌市第三中学2023-2024学年高一上学期期中考试化学试题



