名校
1 .  (三草酸合铁酸钾)是制备负载型活性铁催化剂的主要原料。
(三草酸合铁酸钾)是制备负载型活性铁催化剂的主要原料。
回答下列问题:
I.利用如图所示装置检验三草酸合铁酸钾受热分解所得产物中是否含有 ,
, (下列仪器可重复使用)。
(下列仪器可重复使用)。
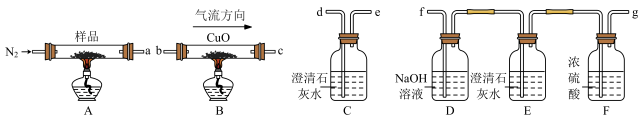
(1)为达到实验目的,连接以上装置,c接___________ (填小写标号),D装置的作用是___________ 。
(2)样品完全分解后,装置A中残留物含有FeO和Fe2O3,为证明残留物中存在FeO,选择的试剂包含___________ (填写试剂的编号)。
提供试剂:①稀盐酸 ②稀硫酸 ③KSCN溶液 ④氯水 ⑤NaOH溶液 ⑥KMnO4溶液。
Ⅱ.测定三草酸合铁酸钾样品(含杂质)中铁元素的含量。
(3)称取mg三草酸合铁酸钾样品,溶于水配成250mL溶液,所需玻璃仪器除烧杯、玻璃棒、量筒外还有___________ (填仪器名称)。
(4)取25mL上述溶液于锥形瓶中,加入稀硫酸酸化,再滴加KMnO4溶液至恰好与 反应,反应的离子方程式为
反应,反应的离子方程式为___________ 。
(5)向(4)反应后溶液中加入足量Zn固体,将Fe3+还原成Fe2+,过滤,用cmol/L酸性KMnO4溶液滴定。测得实验数据如下表:
酸性高锰酸钾溶液应该装在如图___________ (填“A”或“B”)滴定管中,晶体中铁元素的质量分数为___________ ,若配制样品溶液定容时俯视读数会导致测定结果___________ (填“偏高”“偏低”或“无影响”)。

 (三草酸合铁酸钾)是制备负载型活性铁催化剂的主要原料。
(三草酸合铁酸钾)是制备负载型活性铁催化剂的主要原料。回答下列问题:
I.利用如图所示装置检验三草酸合铁酸钾受热分解所得产物中是否含有
 ,
, (下列仪器可重复使用)。
(下列仪器可重复使用)。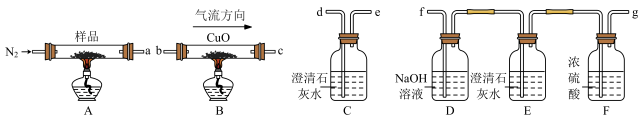
(1)为达到实验目的,连接以上装置,c接
(2)样品完全分解后,装置A中残留物含有FeO和Fe2O3,为证明残留物中存在FeO,选择的试剂包含
提供试剂:①稀盐酸 ②稀硫酸 ③KSCN溶液 ④氯水 ⑤NaOH溶液 ⑥KMnO4溶液。
Ⅱ.测定三草酸合铁酸钾样品(含杂质)中铁元素的含量。
(3)称取mg三草酸合铁酸钾样品,溶于水配成250mL溶液,所需玻璃仪器除烧杯、玻璃棒、量筒外还有
(4)取25mL上述溶液于锥形瓶中,加入稀硫酸酸化,再滴加KMnO4溶液至恰好与
 反应,反应的离子方程式为
反应,反应的离子方程式为(5)向(4)反应后溶液中加入足量Zn固体,将Fe3+还原成Fe2+,过滤,用cmol/L酸性KMnO4溶液滴定。测得实验数据如下表:
| 实验次数 | 滴定前读数/mL | 滴定后读数/mL |
| 1 | 0.10 | 20.20 |
| 2 | 0.52 | 20.52 |
| 3 | 1.85 | 21.75 |
| 4 | 0.00 | 24.06 |

您最近一年使用:0次
名校
解题方法
2 . 新冠肺炎疫情期间,环境消毒是极其关键的,常常喷洒“84”消毒液,其有效成分为NaClO。已知某“84”消毒液瓶体部分标签如图所示,该“84”消毒液通常稀释100倍(体积之比)后使用。请回答下列问题:
(1)某同学取10mL该“84”消毒液,其中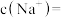
_______  。(保留到小数点后一位)
。(保留到小数点后一位)
(2)该同学参阅该“84”消毒液的配方,欲用NaClO固体配制 此消毒液。
此消毒液。
①配制过程中使用的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒、_______ 。
②关于配制过程的说法正确的是_______ (填字母)。
A.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
B.需要称量NaClO固体的质量为65.6g
C.称量时,所使用的砝码生锈可能导致结果偏高
D.未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
E.定容时,俯视观察刻度线可能导致结果偏低
F.定容摇匀后,将溶液保存于容量瓶中,随用随取
(3)曾有报道,在清洗卫生间时,因混合使用“洁厕灵”(主要成分是盐酸)与“84”消毒液而发生氯气中毒事件,在这个生成氯气的反应中,氧化产物与还原产物的物质的量之比为_______ 。用相似的原理,实验室可用 与盐酸制
与盐酸制 ,如
,如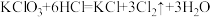
(4)某小组为确定一份加碘盐(可能含有 、KI、
、KI、 、
、 )的成分,设计定性实验加以猜想和验证。已知:Cl2、Br2、I2在有机溶剂中的溶解度远远大于在水中的溶解度,它们溶在有机溶剂中的颜色分别为黄绿色、红棕色、紫红色。
)的成分,设计定性实验加以猜想和验证。已知:Cl2、Br2、I2在有机溶剂中的溶解度远远大于在水中的溶解度,它们溶在有机溶剂中的颜色分别为黄绿色、红棕色、紫红色。
实验过程如下:步骤1:取一定量加碘盐,用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为2份。
第一份做如下实验:
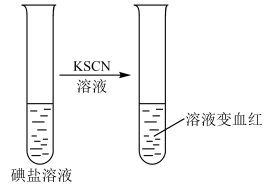
步骤2:
第二份做如下实验:其中X为密度比水大的有机溶剂CCl4
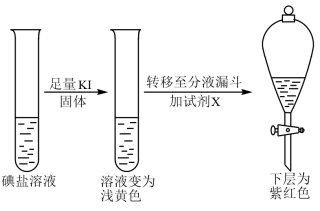
由实验现象得出碘盐中肯定含_______ ,一定不含_______ ;加入足量KI固体后,反应的离子方程式为_______ 、_______ 。
| 84消毒液 有效成分:NaClO NaClO相对分子质量:74.5 规格:100mL 质量分数:25% 密度:  |
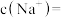
 。(保留到小数点后一位)
。(保留到小数点后一位)(2)该同学参阅该“84”消毒液的配方,欲用NaClO固体配制
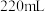 此消毒液。
此消毒液。①配制过程中使用的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒、
②关于配制过程的说法正确的是
A.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
B.需要称量NaClO固体的质量为65.6g
C.称量时,所使用的砝码生锈可能导致结果偏高
D.未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
E.定容时,俯视观察刻度线可能导致结果偏低
F.定容摇匀后,将溶液保存于容量瓶中,随用随取
(3)曾有报道,在清洗卫生间时,因混合使用“洁厕灵”(主要成分是盐酸)与“84”消毒液而发生氯气中毒事件,在这个生成氯气的反应中,氧化产物与还原产物的物质的量之比为
 与盐酸制
与盐酸制 ,如
,如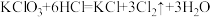
(4)某小组为确定一份加碘盐(可能含有
 、KI、
、KI、 、
、 )的成分,设计定性实验加以猜想和验证。已知:Cl2、Br2、I2在有机溶剂中的溶解度远远大于在水中的溶解度,它们溶在有机溶剂中的颜色分别为黄绿色、红棕色、紫红色。
)的成分,设计定性实验加以猜想和验证。已知:Cl2、Br2、I2在有机溶剂中的溶解度远远大于在水中的溶解度,它们溶在有机溶剂中的颜色分别为黄绿色、红棕色、紫红色。实验过程如下:步骤1:取一定量加碘盐,用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为2份。
第一份做如下实验:

步骤2:
第二份做如下实验:其中X为密度比水大的有机溶剂CCl4

由实验现象得出碘盐中肯定含
您最近一年使用:0次
3 . 已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质,C、F是无色无味的气体,M为红褐色固体,D为具有磁性的黑色固体,请回答下列问题:
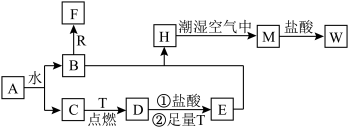
(1)A中含有的化学键类型有_______ 。A与 反应,生成气体为11.2L(标准状况下测定)时,转移到电子数为
反应,生成气体为11.2L(标准状况下测定)时,转移到电子数为_______ 。
(2)请写出R与B溶液反应的离子方程式_______ 。
(3)检验W溶液中金属阳离子的试剂为_______ (填化学式)
(4)反应①发生反应的离子方程式为_______ 。
(5)H生成M的现象为_______ ,反应的化学方程式为_______ 。

(1)A中含有的化学键类型有
 反应,生成气体为11.2L(标准状况下测定)时,转移到电子数为
反应,生成气体为11.2L(标准状况下测定)时,转移到电子数为(2)请写出R与B溶液反应的离子方程式
(3)检验W溶液中金属阳离子的试剂为
(4)反应①发生反应的离子方程式为
(5)H生成M的现象为
您最近一年使用:0次
解题方法
4 . 氢溴酸常用于合成镇静剂和麻醉剂等医药用品。已知: 液溴是易挥发的深红棕色液体,沸点为58.78℃。质量分数为47%的氢溴酸是易挥发的无色液体,沸点 为 126℃. 实验室制备质量分数为47%的氢溴酸的一种方法如下。回答下列问题:
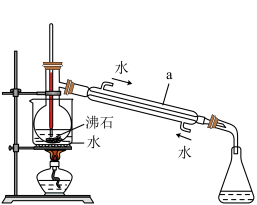
(2)操作 II的蒸馏装置如图所示(部分夹持装置省略),仪器a的名称是_________ ,装置中除缺石棉网外还有两处明显错误,分别是_________ 、 _______________ 。
(3)操作III加入适量Na2SO3发生反应的离子方程式为__________ 。
(4)工业生产制得的氢溴酸常常有淡淡的黄色, 有同学推测是因为含Fe3+,可用试剂__________ 检验。若观察到的现象为________ ,则推测正确。
(5)质量分数为 47%的氢溴酸的产率为__________ 。
实验橾作 | 现象 |
| I .向锥形瓶中依次加入适量冰水、m1g 液溴,再通入SO2充分反应 | 得到淡黄色溶液 |
| II. 将操作 I 所得溶液转移至蒸馏烧瓶,蒸馏 | 锥形瓶中得橙黄色粗产品 |
| III.在不断搅拌下,向锥形瓶中加入适量Na2SO3溶液 | (1)① |
| IV.继续加入适量 Ba(OH)2溶液 | ② |
| V.过滤,滤液经蒸馏后得质量分数为47%的氢溴酸m2g |

(3)操作III加入适量Na2SO3发生反应的离子方程式为
(4)工业生产制得的氢溴酸常常有淡淡的黄色, 有同学推测是因为含Fe3+,可用试剂
(5)质量分数为 47%的氢溴酸的产率为
您最近一年使用:0次
名校
5 . 甘氨酸亚铁[(NH2CH2COO)2Fe]因其良好的生物利用率和化学稳定性,可作为新型铁营养强化剂。实验室可用甘氨酸和硫酸亚铁制备甘氨酸亚铁,实验装置和步骤如下:
I.称取一定质量的甘氨酸,在三颈烧瓶中溶解,水浴加热至50℃,恒温。待甘氨酸完全溶解后,加入复合抗氧化剂。
II.制备硫酸亚铁,并使硫酸亚铁溶液与甘氨酸溶液混合,用40%NaOH溶液调pH至5.5,反应15min。
III.将反应液用离心机分离,取上层清液加入乙醇得到沉淀,经过滤、洗涤、干燥后得到产品。
已知:甘氨酸亚铁易溶于水,难溶于乙醇
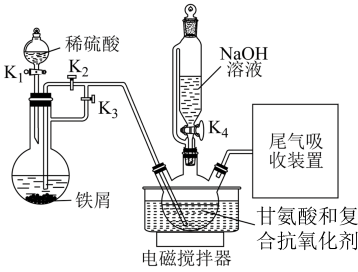
回答下列问题:
(1)盛装氢氧化钠溶液的仪器名称是___________
(2)制备硫酸亚铁的同时制得氢气,氢气的作用是___________ 、___________ ;使硫酸亚铁溶液与甘氨酸溶液混合的操作是___________ 。
(3)三颈烧瓶中发生反应的化学方程式为___________ ;若NaOH溶液调pH过高,可能导致甘氨酸亚铁产量下降,原因是(用离子方程式表示)___________ 。
(4)步骤皿中,取上层清液加入乙醇的目的是___________ 。
(5)检验产品甘氨酸亚铁中是否含有Fe3+的方法是___________ 。
(6)亚铁含量测定:称取mg产品,加入稀硫酸溶解,再加入10%磷酸溶液,配成100mL溶液,取25.00mL溶液于锥形瓶中,加入2滴二苯胺硫磺酸钠指示剂,用0.1000mol·L-1硫酸铈标准液滴定至溶液由绿色变为紫红色,消耗硫酸铈标准溶液24.00mL,测得亚铁含量为___________ %。(已知:Ce4++Fe2+=Ce3++Fe3+)
I.称取一定质量的甘氨酸,在三颈烧瓶中溶解,水浴加热至50℃,恒温。待甘氨酸完全溶解后,加入复合抗氧化剂。
II.制备硫酸亚铁,并使硫酸亚铁溶液与甘氨酸溶液混合,用40%NaOH溶液调pH至5.5,反应15min。
III.将反应液用离心机分离,取上层清液加入乙醇得到沉淀,经过滤、洗涤、干燥后得到产品。
已知:甘氨酸亚铁易溶于水,难溶于乙醇

回答下列问题:
(1)盛装氢氧化钠溶液的仪器名称是
(2)制备硫酸亚铁的同时制得氢气,氢气的作用是
(3)三颈烧瓶中发生反应的化学方程式为
(4)步骤皿中,取上层清液加入乙醇的目的是
(5)检验产品甘氨酸亚铁中是否含有Fe3+的方法是
(6)亚铁含量测定:称取mg产品,加入稀硫酸溶解,再加入10%磷酸溶液,配成100mL溶液,取25.00mL溶液于锥形瓶中,加入2滴二苯胺硫磺酸钠指示剂,用0.1000mol·L-1硫酸铈标准液滴定至溶液由绿色变为紫红色,消耗硫酸铈标准溶液24.00mL,测得亚铁含量为
您最近一年使用:0次
名校
6 . 中药药剂砒霜(主要成分As2O3,微溶于水)在医疗上用于治疗急性白血病。某课题组以一种含砷精矿石粉(主要成份为As4S4、As2S3、FeS2及其它惰性杂质)为原料制取As2O3,工艺流程图如下:
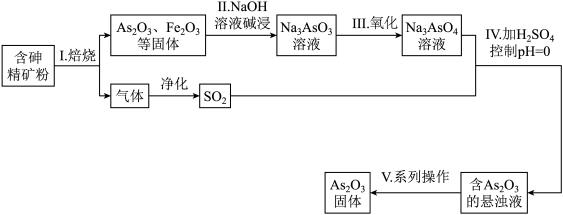
(1)过程 I 中所得SO2气体可回收再利用,下列有关SO2用途的说法正确的是_______ 。
A 工业制硫酸 B 漂白纸张 C 自来水消毒
(2)过程II中发生的反应_______ 氧化还原反应(填“是”或“不是”)。
(3)过程V中操作为_______ (填实验基本操作名称)。
(4)①检验Na3AsO3溶液中是否含有Fe3+的实验操作_______ 。
②过程IV中生成As2O3的离子反应方程式为_______ 。
(5)有毒的AsO33-通过电解反应可转化为无毒的AsO43-。用石墨为电极,在强碱性溶液中电解含AsO33-的溶液,阳极的电极反应式为_______ 。
(6)测定某As2O3粗产品(含As2O5杂质)中As2O3的质量分数的实验过程如下:
a.称取m g粗产品溶解于NaOH溶液,得到含AsO33-、AsO43-的混合溶液100mL。
b.分别移取25.00mL上述溶液,用0.02500mol·L−1的I2标准溶液进行滴定(I2将AsO33-氧化为AsO43-,淀粉溶液为指示剂)。每次滴定开始时液面读数如图一所示,三次滴定结束时,I2标准溶液液面读数如图二~图四所示。
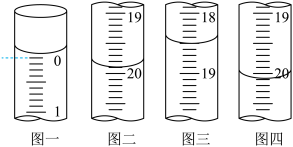
①描述滴定终点的现象_______ 。
②粗产品中As2O3的质量分数为_______ (用含有m的代数式表示)。

(1)过程 I 中所得SO2气体可回收再利用,下列有关SO2用途的说法正确的是
A 工业制硫酸 B 漂白纸张 C 自来水消毒
(2)过程II中发生的反应
(3)过程V中操作为
(4)①检验Na3AsO3溶液中是否含有Fe3+的实验操作
②过程IV中生成As2O3的离子反应方程式为
(5)有毒的AsO33-通过电解反应可转化为无毒的AsO43-。用石墨为电极,在强碱性溶液中电解含AsO33-的溶液,阳极的电极反应式为
(6)测定某As2O3粗产品(含As2O5杂质)中As2O3的质量分数的实验过程如下:
a.称取m g粗产品溶解于NaOH溶液,得到含AsO33-、AsO43-的混合溶液100mL。
b.分别移取25.00mL上述溶液,用0.02500mol·L−1的I2标准溶液进行滴定(I2将AsO33-氧化为AsO43-,淀粉溶液为指示剂)。每次滴定开始时液面读数如图一所示,三次滴定结束时,I2标准溶液液面读数如图二~图四所示。

①描述滴定终点的现象
②粗产品中As2O3的质量分数为
您最近一年使用:0次
2020-01-21更新
|
148次组卷
|
2卷引用:云南省昆明市云南民族大学附属中学2019-2020学年高二上学期期末考试化学试题
7 . 水泥是重要的建筑材料,硅酸盐水泥主要为硅酸二钙(2CaO·SiO2)、硅酸三钙(3CaO ·SiO2)、铝酸三钙(3CaO·Al2O3)。铁铝酸四钙(4CaO·Al2O3·Fe2O3)和氧化镁等的混合物。《水泥化学分析方法》中用EDTA(一种常用作滴定金属离子含量的有机物)滴定法测定水泥样品中钙、镁的含量。其过程如图所示:
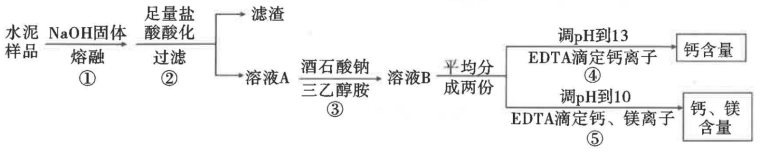
已知:相关金属离子浓度为0.1mol/L时,形成氢氧化物沉淀的pH范围如表:
回答下列问题:
(1)工业制水泥的主要原料是黏土和______ (填名称)。
(2)步骤①中选择用银坩埚而不用瓷坩埚,其理由是_____ .滤渣的主要成分为_____ 。(填化学式)。
(3)步骤③中加入的酒石酸钠和三乙醇胺作为掩蔽剂,可掩蔽杂质离子的干扰,在该过程中,主要掩蔽的离子有_____ 。 掩蔽剂需要在调pH前加入,若在碱性溶液中则起不到掩蔽作用,试从要掩蔽的离子性质分析原因:_______ 。
(4)步骤④和⑤中,调pH时,最好选用试剂_____ (填序号)。
A.氨水 B. MgO C. CaCO3
(5)水泥样品中的钙的含量通过步骤④滴定结果可计算得出;而步骤⑤滴定的是钙、镁总量,所以测定镁的含量准确性还依赖于步骤④。当溶液pH大于12时,会生成硅酸钙沉淀,所以若滴定前,溶液中还有少量的硅酸,则需加入适量氟化钾,以消除硅酸的干扰。若未加氟化钾,残留的硅酸会使镁含量测定结果______ (填“偏高”“偏低”或“无影响”)。
(6)镁含量的测定还受水泥试样中一氧化锰含量的影响,当一氧化锰含量小于0.5%时,干扰不明显,可忽略不计;但大于0.5%时,还需要再测出一氧化锰含量。一氧化锰的测定是在硫酸介质中,用高碘酸钾将其氧化为高锰酸根离子,进行测量。写出该过程中反应的离子方程式:______ (该反应中的一种产物可以作为食盐的添加剂)。

已知:相关金属离子浓度为0.1mol/L时,形成氢氧化物沉淀的pH范围如表:
| 金属离子 | Mg2+ | Ca2+ | Al3+ | Fe3+ |
| 开始沉淀的pH | 11 | 13.5 | 3.5 | 2 |
| 完全沉淀的pH | 13 | >14 | 4.5 | 3.5 |
(1)工业制水泥的主要原料是黏土和
(2)步骤①中选择用银坩埚而不用瓷坩埚,其理由是
(3)步骤③中加入的酒石酸钠和三乙醇胺作为掩蔽剂,可掩蔽杂质离子的干扰,在该过程中,主要掩蔽的离子有
(4)步骤④和⑤中,调pH时,最好选用试剂
A.氨水 B. MgO C. CaCO3
(5)水泥样品中的钙的含量通过步骤④滴定结果可计算得出;而步骤⑤滴定的是钙、镁总量,所以测定镁的含量准确性还依赖于步骤④。当溶液pH大于12时,会生成硅酸钙沉淀,所以若滴定前,溶液中还有少量的硅酸,则需加入适量氟化钾,以消除硅酸的干扰。若未加氟化钾,残留的硅酸会使镁含量测定结果
(6)镁含量的测定还受水泥试样中一氧化锰含量的影响,当一氧化锰含量小于0.5%时,干扰不明显,可忽略不计;但大于0.5%时,还需要再测出一氧化锰含量。一氧化锰的测定是在硫酸介质中,用高碘酸钾将其氧化为高锰酸根离子,进行测量。写出该过程中反应的离子方程式:
您最近一年使用:0次
2020-12-13更新
|
1031次组卷
|
7卷引用:云南师范大学附属中学2021届高三高考适应性月考(四)理综化学试题
云南师范大学附属中学2021届高三高考适应性月考(四)理综化学试题(已下线)培优09 除杂提纯类工业流程(提高练)-2021年高考化学大题培优练(新高考地区专用)(已下线)大题02 化学工艺流程题(二)-【考前抓大题】备战2021年高考化学(全国通用)(已下线)考点10 碳、硅及其无机非金属材料-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点10 碳、硅及其无机非金属材料-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点12 硅及其无机非金属材料-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点12 硅及其无机非金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
8 . 硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
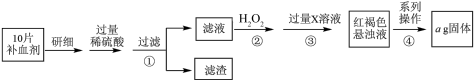
请回答下列问题:
(1)向操作①的滤液中滴加KSCN 溶液后变为红色,则该滤液中含有______ (填离子符号)。
(2)操作②中反应的离子方程式:__________________________________ 。
(3)操作③中反应的离子方程式:__________________________________ 。
(4)操作④中一系列处理的操作步骤:过滤、______ 、灼烧、_______ 、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为______ g。(用含a的代数式表示)

请回答下列问题:
(1)向操作①的滤液中滴加KSCN 溶液后变为红色,则该滤液中含有
(2)操作②中反应的离子方程式:
(3)操作③中反应的离子方程式:
(4)操作④中一系列处理的操作步骤:过滤、
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为
您最近一年使用:0次
2018-01-31更新
|
875次组卷
|
19卷引用:云南省昆明市寻甸县第五中学2019-2020学年高一上学期期末考试化学试题
云南省昆明市寻甸县第五中学2019-2020学年高一上学期期末考试化学试题四川省雅安市2017-2018学年高一上学期期末考试化学试题四川省棠湖中学2017-2018学年高一下学期开学考试化学试题云南省盈江县第一高级中学2019-2020学年高一上学期期末考试化学试题云南省西双版纳傣族自治州勐腊县第一中学2019-2020学年高一上学期期末考试化学试题云南省元阳县第三中学2019-2020学年高一上学期期末考试化学试题云南省红河县第一中学2019-2020学年高一上学期期末考试化学试题云南省普洱市镇沅县第一中学2019—2020学年高一上学期期末考试化学试题云南省盐津县第三中学2019-2020学年高一上学期期末考试化学试题贵州省罗甸县第一中学2019-2020学年高一上学期期末考试化学试题广西武宣县第二中学2019-2020学年高一上学期期末考试化学试题广西来宾市象州县中学2019-2020学年高一上学期期末考试化学试题黑龙江省齐齐哈尔市三立高级中学2021-2022学年高三上学期第一次月考(10月)化学试题云南省马关县第一中学2021-2022学年高二下学期2月份考试化学试题云南省富宁县第一中学2021-2022学年高一下学期开学考试化学试题安徽亳州市利辛县启明中学2022-2023学年高一上学期期末考试化学试题天津市新华中学2022-2023学年高一上学期期末考试化学试题云南省玉溪第三中学2022-2023学年高一下学期期末考试化学试题云南省玉溪市第二中学2022-2023学年高一下学期期末考试 化学试题



