名校
解题方法
1 . 铸铁的主要成分为 和C,用下图所示实验研究铸铁与热的浓硫酸的反应(夹持和加热装置已略去)。
和C,用下图所示实验研究铸铁与热的浓硫酸的反应(夹持和加热装置已略去)。 、
、 ,他们依据的反应为
,他们依据的反应为 、
、___________ 。
(2)检测反应后A中所得溶液中含有 ,实验方案是取少量待测溶液,将其加入适量水中稀释,
,实验方案是取少量待测溶液,将其加入适量水中稀释,___________ 。
(3)实验现象证明A中确实有 、
、 生成。
生成。
①U型管a侧棉花的紫红色褪去,证明有___________ 生成。
②证明有 生成的实验现象是
生成的实验现象是___________ 。
(4)下列试剂中,也可用于该实验中检验 的是
的是___________ (填序号)。
a. 溶液 b.品红溶液 c.紫色石蕊溶液
溶液 b.品红溶液 c.紫色石蕊溶液
(5)取上述反应生成的0.56L(标准状况下)混合气体通入足量 溶液中,发生反应的化学方程式是
溶液中,发生反应的化学方程式是___________ ,反应完全后,向溶液中加入足量 溶液生成白色沉淀,分离、干燥后得到固体4.66g,混合气体中
溶液生成白色沉淀,分离、干燥后得到固体4.66g,混合气体中 的体积分数为
的体积分数为___________ 。
 和C,用下图所示实验研究铸铁与热的浓硫酸的反应(夹持和加热装置已略去)。
和C,用下图所示实验研究铸铁与热的浓硫酸的反应(夹持和加热装置已略去)。
 、
、 ,他们依据的反应为
,他们依据的反应为 、
、(2)检测反应后A中所得溶液中含有
 ,实验方案是取少量待测溶液,将其加入适量水中稀释,
,实验方案是取少量待测溶液,将其加入适量水中稀释,(3)实验现象证明A中确实有
 、
、 生成。
生成。①U型管a侧棉花的紫红色褪去,证明有
②证明有
 生成的实验现象是
生成的实验现象是(4)下列试剂中,也可用于该实验中检验
 的是
的是a.
 溶液 b.品红溶液 c.紫色石蕊溶液
溶液 b.品红溶液 c.紫色石蕊溶液(5)取上述反应生成的0.56L(标准状况下)混合气体通入足量
 溶液中,发生反应的化学方程式是
溶液中,发生反应的化学方程式是 溶液生成白色沉淀,分离、干燥后得到固体4.66g,混合气体中
溶液生成白色沉淀,分离、干燥后得到固体4.66g,混合气体中 的体积分数为
的体积分数为
您最近一年使用:0次
名校
2 . 氰化氢(HCN,一元弱酸,易挥发)主要应用于电镀、采矿、药物合成等工业生产。HCN,CN-能抑制人体组织细胞内酶的活性,不能直接排放到环境中。
(1)Na2S2O3在临床上常用于氰化物的解毒剂。解毒的原理是 将CN-转化为SCN-和
将CN-转化为SCN-和 。验证该转化过程中生成SCN-的实验方法是:向NaCN溶液中加入过量的Na2S2O3的溶液,充分反应后,取少量反应后的溶液于试管中,加入足量稀盐酸酸化,
。验证该转化过程中生成SCN-的实验方法是:向NaCN溶液中加入过量的Na2S2O3的溶液,充分反应后,取少量反应后的溶液于试管中,加入足量稀盐酸酸化,___________ 。
(2)Cu2+可催化过氧化氢氧化废水中的CN-。
①反应不能在酸性条件下进行,原因是___________ 。
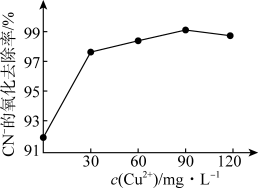
②在含氰废水总景、过氧化氢用量和溶液pH一定的情况下,反应相同时间,测得CN-的氧化去除率随c(Cu2+)的变化与如图所示。c(Cu2+)超过90mg·L-1时,CN-的氧化去除率有所下降,原因是___________ 。 ,其反应的离子方程式为
,其反应的离子方程式为___________ 。
(4)在铜镍为催化剂(Cu、CuO为活性组分,Cu的催化活性效果更好)的条件下,可利用反应:HCN(g)+H2O(g) NH3(g)+CO(g) △H>0
NH3(g)+CO(g) △H>0
除去废气中的HCN。将含相同比例的HCN(g)、H2O(g)、CO(g)[或N2(g)]混合气体分别通过催化剂,反应相同的时间,测得HCN(g)的去除率随温度变化如图所示。200℃时含CO的混合气体中HCN(g)的去除率较高,而400℃时含CO的混合气体中HCN(g)的去除率较低。其原因是___________ 。
(1)Na2S2O3在临床上常用于氰化物的解毒剂。解毒的原理是
 将CN-转化为SCN-和
将CN-转化为SCN-和 。验证该转化过程中生成SCN-的实验方法是:向NaCN溶液中加入过量的Na2S2O3的溶液,充分反应后,取少量反应后的溶液于试管中,加入足量稀盐酸酸化,
。验证该转化过程中生成SCN-的实验方法是:向NaCN溶液中加入过量的Na2S2O3的溶液,充分反应后,取少量反应后的溶液于试管中,加入足量稀盐酸酸化,(2)Cu2+可催化过氧化氢氧化废水中的CN-。
①反应不能在酸性条件下进行,原因是
②在含氰废水总景、过氧化氢用量和溶液pH一定的情况下,反应相同时间,测得CN-的氧化去除率随c(Cu2+)的变化与如图所示。c(Cu2+)超过90mg·L-1时,CN-的氧化去除率有所下降,原因是
 ,其反应的离子方程式为
,其反应的离子方程式为(4)在铜镍为催化剂(Cu、CuO为活性组分,Cu的催化活性效果更好)的条件下,可利用反应:HCN(g)+H2O(g)
 NH3(g)+CO(g) △H>0
NH3(g)+CO(g) △H>0除去废气中的HCN。将含相同比例的HCN(g)、H2O(g)、CO(g)[或N2(g)]混合气体分别通过催化剂,反应相同的时间,测得HCN(g)的去除率随温度变化如图所示。200℃时含CO的混合气体中HCN(g)的去除率较高,而400℃时含CO的混合气体中HCN(g)的去除率较低。其原因是

您最近一年使用:0次
名校
3 . 化合物甲(化学式可表示为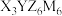 )是德国化学家L。 Leopold Gmelin于1882年发现的一种配合物,可用于颜料、钢铁等行业。X、Y、Z、M为前4周期主族或副族元素,四种元素原子的电子数总和为58;X、Y同周期,Z、M同周期相邻。基态X最高能层的原子轨道为球形,且只填充了1个电子;基态Y的价电子排布中有4个单电子。下列说法不正确的是
)是德国化学家L。 Leopold Gmelin于1882年发现的一种配合物,可用于颜料、钢铁等行业。X、Y、Z、M为前4周期主族或副族元素,四种元素原子的电子数总和为58;X、Y同周期,Z、M同周期相邻。基态X最高能层的原子轨道为球形,且只填充了1个电子;基态Y的价电子排布中有4个单电子。下列说法不正确的是
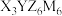 )是德国化学家L。 Leopold Gmelin于1882年发现的一种配合物,可用于颜料、钢铁等行业。X、Y、Z、M为前4周期主族或副族元素,四种元素原子的电子数总和为58;X、Y同周期,Z、M同周期相邻。基态X最高能层的原子轨道为球形,且只填充了1个电子;基态Y的价电子排布中有4个单电子。下列说法不正确的是
)是德国化学家L。 Leopold Gmelin于1882年发现的一种配合物,可用于颜料、钢铁等行业。X、Y、Z、M为前4周期主族或副族元素,四种元素原子的电子数总和为58;X、Y同周期,Z、M同周期相邻。基态X最高能层的原子轨道为球形,且只填充了1个电子;基态Y的价电子排布中有4个单电子。下列说法不正确的是A.第一电离能: |
| B.化合物甲中除含配位键,还含离子键、非极性键 |
C.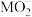 的VSEPR模型为三角形 的VSEPR模型为三角形 |
D.化合物甲的溶液可用于检验 |
您最近一年使用:0次
2024-04-27更新
|
82次组卷
|
2卷引用:广东省佛山市南海区西樵高级中学2023-2024学年高三下学期3月月考化学试题
名校
4 . 利用金属矿渣(含有FeS2、SiO2及Cu2O)制备FeCO3的实验流程如下。已知煅烧过程中FeS2和Cu2O转化为Fe2O3和CuO。___________ (写化学式),该物质是工业制备硅的原料,写出该物质与焦炭反应制备硅的化学方程式:___________ 。
(2)FeS2在空气中煅烧的化学方程式为___________ 。
(3)在“还原”步骤,在向酸浸后溶液加入过量铁屑,除了能将 转化为
转化为 外,还能
外,还能___________ 。若将6g铁粉加入200mLFe2(SO4)3和CuSO4的混合溶液中,充分反应得到200mL FeSO4溶液和5.2g固体沉淀物。
FeSO4溶液和5.2g固体沉淀物。
①5.2g固体沉淀物的成份为___________ (写化学式)。
②原Fe2(SO4)3溶液的物质的量浓度是___________ 。(写出计算过程)
(4)检验 是否完全被还原的实验操作是
是否完全被还原的实验操作是___________ 。
(5)制备FeCO3,写出“沉铁”步骤发生反应的离子方程式:___________ 。
(2)FeS2在空气中煅烧的化学方程式为
(3)在“还原”步骤,在向酸浸后溶液加入过量铁屑,除了能将
 转化为
转化为 外,还能
外,还能 FeSO4溶液和5.2g固体沉淀物。
FeSO4溶液和5.2g固体沉淀物。①5.2g固体沉淀物的成份为
②原Fe2(SO4)3溶液的物质的量浓度是
(4)检验
 是否完全被还原的实验操作是
是否完全被还原的实验操作是(5)制备FeCO3,写出“沉铁”步骤发生反应的离子方程式:
您最近一年使用:0次
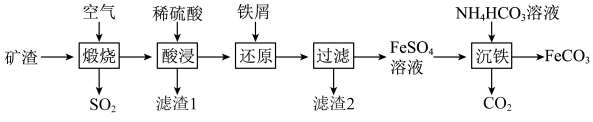
5 . 某固体粉末甲中可能含有K2CO3、KNO3、NaNO2、K2SO3、Na2SO4、Fe、FeO、Fe2O3中的若干种。某同学为确定该固体粉末的成分,取甲进行连续实验。实验过程及现象如下:
| A.固体粉末中含有钠元素,但不含钾元素 |
| B.固体粉末中无法确定是否含有K2SO3 |
| C.固体粉末中至少含有KNO3、NaNO2中的一种 |
| D.固体粉末中可能含有K2CO3、不含Fe2O3 |
您最近一年使用:0次
名校
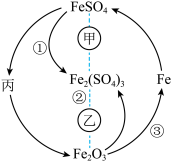
6 . 在一定条件下,某些物质具有如图所示的转化关系。丙为白色固体,其悬浊液在空气中会迅速变为灰绿色,最终变为红褐色。请回答下列问题:
(1)根据分析可知丙为________________ (填化学式);甲可能是__________ (填标号,下同),乙可能是__________ 。
A.稀硝酸 B. 溶液 C.
溶液 C. D.
D. 溶液
溶液
(2)实验室保存 溶液时,为了防止其被氧化,可以往溶液中加入适量
溶液时,为了防止其被氧化,可以往溶液中加入适量___________ (填药品名称);可以用______________ (填化学式)溶液来检验 溶液中的
溶液中的 是否被氧化。
是否被氧化。
(3)丙的悬浊液在空气中变色的原因为____________________ (填化学方程式);工业上高炉炼铁可以实现③的转化,所得到的炽热的铁水注入模具之前,模具必须进行充分的干燥处理,原因是____________________ (填化学方程式)。
(1)根据分析可知丙为
A.稀硝酸 B.
 溶液 C.
溶液 C. D.
D. 溶液
溶液(2)实验室保存
 溶液时,为了防止其被氧化,可以往溶液中加入适量
溶液时,为了防止其被氧化,可以往溶液中加入适量 溶液中的
溶液中的 是否被氧化。
是否被氧化。(3)丙的悬浊液在空气中变色的原因为
您最近一年使用:0次
2024-04-21更新
|
162次组卷
|
2卷引用:河北省保定市定州市第二中学2023-2024学年高一下学期3月月考化学试题
名校
解题方法
7 . 工业上以辉铋矿粉(主要成分是 ,含少量
,含少量 、
、 、
、 等杂质)为原料制备
等杂质)为原料制备 (铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下:
(铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下: 难溶于水;
难溶于水;
②酸浸后,矿粉中的硫元素完全变为硫单质;
回答下列问题:
(1) 中Cu的化合价为
中Cu的化合价为___________ ,酸浸过程中, 反应的离子方程式
反应的离子方程式___________ 。
(2)检验“酸浸”液中是否含 ,可选择
,可选择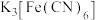 溶液。能证明不存在
溶液。能证明不存在 的实验现象是
的实验现象是___________ 。
(3)氧化后,从反应体系中分离出 粗产品的操作名称是
粗产品的操作名称是___________ 。
(4)上述流程中,基态原子未成对电子数最多的金属元素名称是___________ 。
(5)向 和
和 混合溶液中通入氯气制备
混合溶液中通入氯气制备 的离子方程式
的离子方程式___________ 。
(6)已知常温下, ,调节FeCl3溶液至
,调节FeCl3溶液至 ,所得溶液中c(Fe3+)=
,所得溶液中c(Fe3+)=___________ 。
 ,含少量
,含少量 、
、 、
、 等杂质)为原料制备
等杂质)为原料制备 (铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下:
(铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下: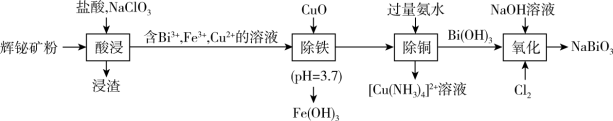
 难溶于水;
难溶于水;②酸浸后,矿粉中的硫元素完全变为硫单质;
回答下列问题:
(1)
 中Cu的化合价为
中Cu的化合价为 反应的离子方程式
反应的离子方程式(2)检验“酸浸”液中是否含
 ,可选择
,可选择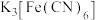 溶液。能证明不存在
溶液。能证明不存在 的实验现象是
的实验现象是(3)氧化后,从反应体系中分离出
 粗产品的操作名称是
粗产品的操作名称是(4)上述流程中,基态原子未成对电子数最多的金属元素名称是
(5)向
 和
和 混合溶液中通入氯气制备
混合溶液中通入氯气制备 的离子方程式
的离子方程式(6)已知常温下,
 ,调节FeCl3溶液至
,调节FeCl3溶液至 ,所得溶液中c(Fe3+)=
,所得溶液中c(Fe3+)=
您最近一年使用:0次
名校
解题方法
8 . 华铁粉的主要成分为醋酸亚铁,可清热解毒,凉血消肿。以粗氯化铁(含少量 )为原料制备华铁粉的流程如下:
)为原料制备华铁粉的流程如下:
 )为原料制备华铁粉的流程如下:
)为原料制备华铁粉的流程如下: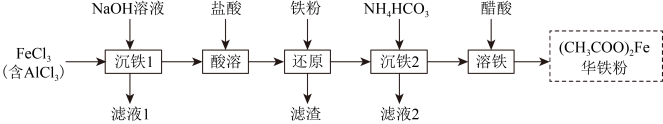
A.“沉铁1”中可用氨水替代 溶液 溶液 |
B.“还原”时加入铁粉的目的是将 转化成 转化成 |
C.滤液2的主要成分是 |
D.“溶铁”的离子方程式为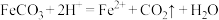 |
您最近一年使用:0次
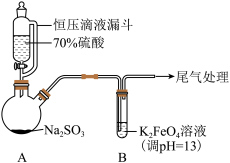
9 . 某实验小组探究SO2与K2FeO4的反应,实验如下。
资料:i.K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
ii.Fe3+可以与C2O 形成[Fe(C2O4)3]3-;
形成[Fe(C2O4)3]3-;
(1)A中产生SO2的化学方程式为___________ 。
(2)暗红褐色沉淀X可能含Fe3+、OH-、SO 、SO
、SO ,检验如下:
,检验如下:
实验二:向X中加入足量盐酸,沉淀溶解。取少量溶液,滴加KSCN溶液后变红。证明溶液中存在___________ 。另取少量溶液滴加BaCl2溶液,产生白色沉淀,但不能确认含有SO ,原因是
,原因是___________ 。
实验三:向X中加入H2C2O4溶液,沉淀溶解。继续滴加BaCl2溶液,产生白色沉淀,过滤后,向沉淀中加入盐酸,白色沉淀溶解。确认X中不含SO 。
。
实验三中用H2C2O4溶液溶解沉淀的目的是:___________ 。
实验四:向X中加入足量盐酸,沉淀溶解。加入几滴碘水(含淀粉),蓝色立即褪去。静置,一段时间后蓝色复现,振荡,不褪色。
结合离子方程式解释沉淀溶解后的现象:___________ 。
(3)查阅资料:a.Fe3+、SO 、H2O(或OH﹣)会形成配合物HOFeOSO2。
、H2O(或OH﹣)会形成配合物HOFeOSO2。 和O2在金属离子的催化作用下产生具有强氧化性的过一硫酸(HSO
和O2在金属离子的催化作用下产生具有强氧化性的过一硫酸(HSO
①向溶液Y中滴加2滴KSCN溶液,未见红色;再加几滴6mol·L-1盐酸,溶液变红。溶液Y中存在Fe(Ⅲ),但直接滴加KSCN溶液未见红色的原因是___________ 。
②取出部分实验一中的橙色溶液,久置不褪色。结合资料a中过程ii分析实验一中溶液最终“几乎无色”的原因:___________ 。
总结:SO2与K2FeO4发生了氧化还原反应和复分解反应,并且遵循化学反应速率和限度规律。
资料:i.K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
ii.Fe3+可以与C2O
 形成[Fe(C2O4)3]3-;
形成[Fe(C2O4)3]3-;| 装置 | 操作及现象 |
| 实验一:向B中通入SO2,产生暗红褐色沉淀X和溶液Y(略显红色);继续通入SO2一段时间后,溶液呈红色,继而变为橙色,最终沉淀消失,溶液几乎无色。 |
(1)A中产生SO2的化学方程式为
(2)暗红褐色沉淀X可能含Fe3+、OH-、SO
 、SO
、SO ,检验如下:
,检验如下:实验二:向X中加入足量盐酸,沉淀溶解。取少量溶液,滴加KSCN溶液后变红。证明溶液中存在
 ,原因是
,原因是实验三:向X中加入H2C2O4溶液,沉淀溶解。继续滴加BaCl2溶液,产生白色沉淀,过滤后,向沉淀中加入盐酸,白色沉淀溶解。确认X中不含SO
 。
。实验三中用H2C2O4溶液溶解沉淀的目的是:
实验四:向X中加入足量盐酸,沉淀溶解。加入几滴碘水(含淀粉),蓝色立即褪去。静置,一段时间后蓝色复现,振荡,不褪色。
结合离子方程式解释沉淀溶解后的现象:
(3)查阅资料:a.Fe3+、SO
 、H2O(或OH﹣)会形成配合物HOFeOSO2。
、H2O(或OH﹣)会形成配合物HOFeOSO2。
 和O2在金属离子的催化作用下产生具有强氧化性的过一硫酸(HSO
和O2在金属离子的催化作用下产生具有强氧化性的过一硫酸(HSO
①向溶液Y中滴加2滴KSCN溶液,未见红色;再加几滴6mol·L-1盐酸,溶液变红。溶液Y中存在Fe(Ⅲ),但直接滴加KSCN溶液未见红色的原因是
②取出部分实验一中的橙色溶液,久置不褪色。结合资料a中过程ii分析实验一中溶液最终“几乎无色”的原因:
总结:SO2与K2FeO4发生了氧化还原反应和复分解反应,并且遵循化学反应速率和限度规律。
您最近一年使用:0次
10 . 实验室由硫铁矿烧渣(主要成分为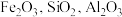 )制备软磁性材料
)制备软磁性材料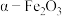 。主要转化流程如图:
。主要转化流程如图:

(1)制绿矾。烧渣到绿矾的工艺中涉及“酸浸”“还原”“除杂”“结晶”等实验流程。
①酸浸。
②还原。向“酸浸”后的溶液中加入过量铁粉,使 完全转化为
完全转化为 。该过程除生成
。该过程除生成 外,还会生成
外,还会生成_______ (填化学式);检验 是否还原完全的实验操作是
是否还原完全的实验操作是_______ 。
③除杂。向“还原”后滤液中加入 溶液,调节
溶液,调节 为
为_______ ,使 除去完全。[已知:
除去完全。[已知: 时
时 为沉淀完全,
为沉淀完全, 时
时 开始沉淀。]
开始沉淀。]
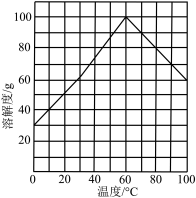
④结晶。结合题图所示的绿矾溶解度曲线,补充完整获得 晶体的实验操作。向
晶体的实验操作。向 溶液中再加入稀硫酸酸化,
溶液中再加入稀硫酸酸化,_______ ,过滤,少量冰水洗涤,低温干燥,得到 晶体。
晶体。
(2)制 。将
。将 溶液与氨水
溶液与氨水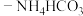 混合溶液中的一种加入三颈瓶中(装置见图),通过分液漏斗缓慢滴加另一种溶液,充分反应,过滤。
混合溶液中的一种加入三颈瓶中(装置见图),通过分液漏斗缓慢滴加另一种溶液,充分反应,过滤。
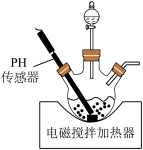
①分液漏斗中的溶液是_______ ;生成 的离子方程式为
的离子方程式为_______ 。
②生成的 沉淀需“洗涤完全”,检验方法是
沉淀需“洗涤完全”,检验方法是_______ 。
(3)制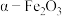 。将纯净的
。将纯净的 放入管式炉内煅烧
放入管式炉内煅烧 ,获得产品
,获得产品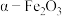 。图为其他条件相同时不同煅烧温度对产品中
。图为其他条件相同时不同煅烧温度对产品中 质量分数的影响,当煅烧温度高于
质量分数的影响,当煅烧温度高于 时,产品中
时,产品中 质量分数降低,铁元素质量分数升高,其可能原因是
质量分数降低,铁元素质量分数升高,其可能原因是_______ 。

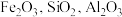 )制备软磁性材料
)制备软磁性材料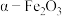 。主要转化流程如图:
。主要转化流程如图:
(1)制绿矾。烧渣到绿矾的工艺中涉及“酸浸”“还原”“除杂”“结晶”等实验流程。
①酸浸。
②还原。向“酸浸”后的溶液中加入过量铁粉,使
 完全转化为
完全转化为 。该过程除生成
。该过程除生成 外,还会生成
外,还会生成 是否还原完全的实验操作是
是否还原完全的实验操作是③除杂。向“还原”后滤液中加入
 溶液,调节
溶液,调节 为
为 除去完全。[已知:
除去完全。[已知: 时
时 为沉淀完全,
为沉淀完全, 时
时 开始沉淀。]
开始沉淀。]④结晶。结合题图所示的绿矾溶解度曲线,补充完整获得
 晶体的实验操作。向
晶体的实验操作。向 溶液中再加入稀硫酸酸化,
溶液中再加入稀硫酸酸化, 晶体。
晶体。
(2)制
 。将
。将 溶液与氨水
溶液与氨水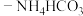 混合溶液中的一种加入三颈瓶中(装置见图),通过分液漏斗缓慢滴加另一种溶液,充分反应,过滤。
混合溶液中的一种加入三颈瓶中(装置见图),通过分液漏斗缓慢滴加另一种溶液,充分反应,过滤。
①分液漏斗中的溶液是
 的离子方程式为
的离子方程式为②生成的
 沉淀需“洗涤完全”,检验方法是
沉淀需“洗涤完全”,检验方法是(3)制
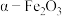 。将纯净的
。将纯净的 放入管式炉内煅烧
放入管式炉内煅烧 ,获得产品
,获得产品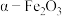 。图为其他条件相同时不同煅烧温度对产品中
。图为其他条件相同时不同煅烧温度对产品中 质量分数的影响,当煅烧温度高于
质量分数的影响,当煅烧温度高于 时,产品中
时,产品中 质量分数降低,铁元素质量分数升高,其可能原因是
质量分数降低,铁元素质量分数升高,其可能原因是
您最近一年使用:0次