真题
名校
1 . 用FeCl3溶液腐蚀印刷电路板上的铜,所得的溶液中加入铁粉。对加入铁粉充分反应后的溶液分析合理的是
| A.若无固体剩余,则溶液中一定有Fe3+ |
| B.若有固体存在,则溶液中一定有Fe2+ |
| C.若溶液中有Cu2+,则一定没有固体析出 |
| D.若溶液中有Fe2+,则一定有Cu析出 |
您最近一年使用:0次
2019-01-30更新
|
4624次组卷
|
70卷引用:2014-2015学年山东省费县实验中学高二下5月月考化学试卷
2014-2015学年山东省费县实验中学高二下5月月考化学试卷山东省枣庄市第三中学2017-2018学年高一1月学情调查化学试题山东省新泰市第一中学2019届高三上学期第二次质量检测化学试题山东省滨州市邹平双语学校2019年高一上学期《氧化还原专题》检测山东省肥城市第一高级中学等学校2023-2024学年高一上学期12月大联考化学试题山东省枣庄市第三中学2023-2024学年高一上学期1月期末模拟化学试题 2014年全国普通高等学校招生统一考试理科综合能力测试化学(上海卷)2015届浙江省诸暨中学高三上学期期中化学试卷2016届海南省海口市第一中学高三上学期第一次月考化学试卷2016届四川省彭州中学高三9月月考化学试卷2016届甘肃省天水市第三中学高三上学期第三次测试化学试卷2016届陕西西安第一中学高三上学期期中考试化学试卷2015-2016学年湖南省常德一中高一上12月月考化学试卷2016届北京一五六中学上学期高三期中考试化学试卷2015-2016学年福建省厦门一中高一上12月月考化学试卷2016届陕西省西安中学高三上学期第四次质检化学试卷12016届甘肃省武威二中高三下学期开学考试理综化学试卷2015-2016学年河南省安阳三十六中高二6月月考化学试卷2017届陕西省西安一中高三上期中化学试卷2016-2017学年湖北省武钢三中高一12月月考化学试卷上海市交通大学附属中学2017-2018学年高二上学期第一次月考化学试题1上海市交通大学附属中学2017-2018学年高二上学期第一次月考化学试题2宁夏固原市第一中学2017-2018学年高一上学期12月月考化学试题上海交通大学附属中学2017-2018学年高二上学期第一次月考化学试题山西大学附属中学2017-2018学年高一上学期第三次月考(12月)化学试题山西大学附中 2017~2018学年高一上学期第三次月考(12月)化学试题(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第3讲 氧化还原反应【教学案】(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第3讲 铁及其化合物【教学案】(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第3讲 铁及其化合物【押题专练】安徽省宣城市郎溪县郎溪中学2018-2019学年高二上学期返校考化学试题江西省赣州市第四中学2017届高三上学期第二次月考化学试题上海市交通大学附属中学2017-2018学年高二上学期第一次月考化学试题3云南省双柏县第一中学2018-2019学年高一上学期期中考试化学试题(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第3讲 铁及其化合物 (教学案)(已下线)2019高考热点题型和提分秘籍 第二章 化学物质及其变化 第3讲 氧化还原反应 (教学案)湖北省武汉市汉阳一中2018-2019学年高一上学期12月月考化学试题(已下线)2019高考备考二轮复习精品资料-专题3 氧化还原反应(教学案)(已下线)2019高考备考二轮复习精品资料-专题5 金属及其化合物(教学案)陕西省吴起高级中学2019届高三上学期期中考试化学试题【全国百强校】湖南省长沙市雅礼中学2017-2018学年高一第一学期期末考试化学试题上海市七宝中学2017届高三上学期期中考试化学试题(已下线)考点03 氧化还原反应——《备战2020年高考精选考点专项突破题集》(已下线)上海市上海交通大学附属中学2017-2018学年高二10月月考化学试题(已下线)【新东方】2020-75上海市青浦二中2016届高三10月月考化学试题(已下线)上海市行知中学2014-2015学年高二上学期期中考试化学试题山西省太原市实验中学2020届高三上学期第一次月考化学试题(已下线)专题五 离子反应(提分特训)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训广东省珠海市珠海一中 2019-2020学年度高一下学期期中考试化学试题(已下线)【南昌新东方】江西省九江市第一中学2015-2016学年高一上学期第二次(12月)月考化学试题(已下线)【南昌新东方】江西省九江一中2015-2016学年高一上学期第二次月考化学试卷河北省衡水市深州市中学2019-2020学年高一下学期期末考试化学试题人教版(2019)高一必修第一册 第三章素养检测(已下线)小题必刷15 铁、铜及其化合物——2021年高考化学一轮复习小题必刷(通用版)上海市南洋模范中学2021届高三9月初态考试化学试题浙江省诸暨中学2020-2021学年高一上学期10月阶段性考试化学(实验班)试题宁夏回族自治区海原县第一中学2021届高三上学期第一次月考化学试题(已下线)【浙江新东方】61黑龙江省鹤岗市第一中学2020-2021学年高一上学期12月月考化学试题四川省绵阳市南山中学2020-2021学年高一下学期入学考试化学试题重庆市开州中学高 2021-2022学年高三上学期10月月考化学试题江苏省南京师范大学附属中学2019-2020学年高一上学期12月月考化学试题安徽省芜湖市第一中学2021-2022学年高一上学期第二次月末诊断测试化学试题(已下线)5.2.3 重要的金属化合物(第3课时)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)浙江省临海市回浦中学2021-2022学年高一上学期第二次质量抽测(12月)化学试题上海理工大学附属中学中2021-2022学年高一下学期期中考试化学试题天津市第一中学2022-2023学年高一上学期第二次月考化学试题上海高考2017届压轴卷 化学试题河南省郑州外国语学校2020-2021学年高一上学期第二次月考化学试题广东省中山市华侨中学2023-2024学年高一上学期第二次段考化学试题
2 . 下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
| 选项 | 实验 | 现象 | 结论 |
| A | 将SO2通入Ba(NO3)2溶液中 | 有白色沉淀生成 | BaSO3不溶于水 |
| B | 将铝片加入冷的浓硫酸中 | 没有明显现象 | 铝与浓硫酸不发生反应 |
| C | 在滴有酚酞的Na2CO3溶液中加入BaCl2溶液 | 溶液红色退去 | Na2CO3溶液中存在水解平衡 |
| D | FeCl3和CuCl2的混合液中加入一定量的铁粉 | 无固体存在 | 溶液中一定只含两种金属离子 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 聚合硫酸铁又称聚铁,化学式[Fe2(OH)n(SO4)3-0.5n]n,广泛用于污水处理,实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、 SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下:
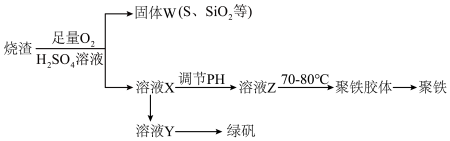
(1)验证固体W焙烧后产生的气体含有SO2的方法是_____________ 。
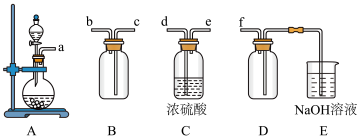
(2)实验室制备,收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器口,顺序为a→_____ →_____ →_____ →_____ →f。装置D的作用是_________ ,装置E中NaOH溶液的作用是________________ 。
(3)制备绿矾时,向溶液X中加入过量_________ ,充分反应后,经_________ 操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。
(4)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为________ 。
若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏_____________________ 。

(1)验证固体W焙烧后产生的气体含有SO2的方法是
(2)实验室制备,收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器口,顺序为a→

(3)制备绿矾时,向溶液X中加入过量
(4)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为
若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏
您最近一年使用:0次
2019-01-30更新
|
1021次组卷
|
5卷引用:2010年普通高等学校招生全国统一考试理综化学部分(山东卷)
2010年普通高等学校招生全国统一考试理综化学部分(山东卷)2010年高考化学试题分项专题十二 非金属元素及其化合物2010年高考化学试题分项专题十五 化学实验(已下线)2010-2011学年浙江省瑞安中学高二下学期期中考试化学试卷(已下线)2013届福建省清流一中高三第三阶段考试化学试卷
名校
解题方法
4 . 下列物质反应后一定有+3价铁生成的是 ( )
①过量的Fe与Cl2反应②Fe与过量稀H2SO4反应③Fe和Fe2O3的混合物溶于盐酸中
①过量的Fe与Cl2反应②Fe与过量稀H2SO4反应③Fe和Fe2O3的混合物溶于盐酸中
| A.只有① | B.①② | C.①②③ | D.①③ |
您最近一年使用:0次
2018-12-14更新
|
394次组卷
|
9卷引用:山东省德州一中2018-2019学年高一第一学期第三次月考化学试题
山东省德州一中2018-2019学年高一第一学期第三次月考化学试题山东省泰安市宁阳一中2018-2019学年高一上学期阶段性考试二(12月)化学试题【全国百强校】山东省招远市第一中学2018-2019学年高一上学期12月月考化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高一上学期期末考试化学试题黑龙江省伊春市伊美区第二中学2019-2020学年高一上学期第三次月考化学试题鲁科版(2019)高一必修第一册第3章 物质的性质与转化 第1节 铁的多样性云南省元阳县一中2020-2021学年高一下学期6月份考试化学试题(已下线)易错专题21 铁单质的性质-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)广东肇庆中学2023届高一上学期期中测试化学试题
名校
5 . 将 19.20 g Cu 和 Fe2O3 的混合物完全溶解在 400 mL稀硫酸中, 然后向溶液中加铁粉, 剩余固体质量与加入铁粉质量的关系如图。

(1)混合物中 n(Cu)∶n(Fe2O3)为__________ ;
(2)稀硫酸的浓度为_____________ 。

(1)混合物中 n(Cu)∶n(Fe2O3)为
(2)稀硫酸的浓度为
您最近一年使用:0次
2018-03-19更新
|
593次组卷
|
3卷引用:山东省山东师范大学附属中学2019-2020学年高一上学期12月份月考化学试题
山东省山东师范大学附属中学2019-2020学年高一上学期12月份月考化学试题浙江省学考选考科目考试绍兴市适应性试卷(2018年3月)化学试题(已下线)第03章 铁 金属材料(A卷基础强化篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)
名校
6 . 将铁粉、铜粉加入到盛有FeCl3、FeCl2、CuCl2的混合液的烧杯中,判断下列情况烧杯中的固体及金属阳离子(用化学式表示):
(1)若反应后铁粉有剩余,则一定有______________ 。
(2)若反应后有Cu2+和Cu,则不可能有_________ 。
(3)若反应后有Cu2+和Fe3+,则一定有_______________ 。
(1)若反应后铁粉有剩余,则一定有
(2)若反应后有Cu2+和Cu,则不可能有
(3)若反应后有Cu2+和Fe3+,则一定有
您最近一年使用:0次
2018-03-04更新
|
549次组卷
|
4卷引用:山东省泰安市2017-2018学年高一上学期期末考试化学试题
山东省泰安市2017-2018学年高一上学期期末考试化学试题【全国百强校】江西省高安中学2017-2018学年高二下学期期末考试化学试题(已下线)《2018-2019学年同步单元双基双测AB卷》 第三单元 金属及其化合物单元测试 A卷江西省会昌中学2020-2021学年高一上学期第二次月考化学试题
名校
解题方法
7 . 现有一包铝热剂是铝粉和氧化铁粉末的混合物,在高温下使之充分反应,将反应后的固体分为两等份,进行如下实验(计算浓度时假定溶液体积没有变化):
①向其中一份固体中加入100mL 2.0mol/L的NaOH溶液,加热使其充分反应后过滤,测得滤液的c(OH-)=1mol/L;
②向另一份固体中加入140mL 4.0 mol/L的HCl溶液,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+和Al3+三种阳离子且c(H+)=1mol/L。
(1)写出该铝热反应的化学方程式:_______________________________
写出实验①发生的离子方程式:_________________________________ 。
(2)这包铝热剂中铝粉的质量为___________________________ 。
(3)这包铝热剂中氧化铁粉末的质量为__________________________________ 。
①向其中一份固体中加入100mL 2.0mol/L的NaOH溶液,加热使其充分反应后过滤,测得滤液的c(OH-)=1mol/L;
②向另一份固体中加入140mL 4.0 mol/L的HCl溶液,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+和Al3+三种阳离子且c(H+)=1mol/L。
(1)写出该铝热反应的化学方程式:
写出实验①发生的离子方程式:
(2)这包铝热剂中铝粉的质量为
(3)这包铝热剂中氧化铁粉末的质量为
您最近一年使用:0次
8 . 把一定量的铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+与 Fe3+的物质的量浓度之比为3∶2。则已反应的Fe3+与未反应的Fe3+的物质的量之比是( )
| A.1∶1 | B.1∶2 | C.2∶1 | D.2∶3 |
您最近一年使用:0次
9 . 煤燃烧产生的粉煤灰(主要含有SiO2、Fe2O3、Al2O3等)是火电厂产生的废渣,若不加处理会污染环境。为综合利用,研究人员对其进行如下处理:

(1)滤渣主要成分是________________ ;滤液①中的阳离子为_____________________ 。
(2)滤液①中还加入还原剂原因是________________ ;若加入的还原剂为铁粉,反应的离子方程式为_____________________________________ 。
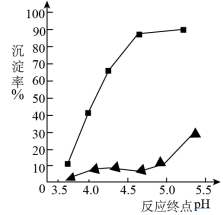
(3)加入氨水是为了调节pH使铝离子沉淀,其离子方程式为_________________ ;反应终点的pH对铝和铁分离效果的影响如右图。根据实验结果,为达到好的分离效果,反应过程中控制pH的范围是__________ ,选择该范围的理由是_________ 。
(4)NH4HSO4和H2SO4按物质的量比1:1混合溶于水配制成浸取液,220℃时可将高铝粉煤灰中Al2O3转化为硫酸铝铵[NH4Al(SO4) 2],然后分离、煅烧获得纯Al2O3。
查阅资料知硫酸铝铵:①溶解度:0℃时,S=5.2g;100℃时,S=421.9g 。②280℃时分解。
①依据资料可知,将硫酸铝铵与其他溶质分离的方法是_____________ 。
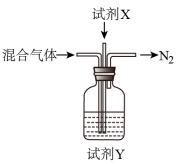
②煅烧NH4Al(SO4) 2时发生4NH4Al(SO4)2 2Al2O3+5SO3↑+3SO2↑+2NH3↑+N2↑+5H2O↑,得到混合气体(NH3、N2、SO2、SO3、H2O )。若16mol混合气体按如下装置被完全吸收制得浸取液。则右下图中,试剂X是
2Al2O3+5SO3↑+3SO2↑+2NH3↑+N2↑+5H2O↑,得到混合气体(NH3、N2、SO2、SO3、H2O )。若16mol混合气体按如下装置被完全吸收制得浸取液。则右下图中,试剂X是___________ (填化学式);试剂Y是_________ (填名称),其中溶质的物质的量为_____________ 。

(1)滤渣主要成分是
(2)滤液①中还加入还原剂原因是
(3)加入氨水是为了调节pH使铝离子沉淀,其离子方程式为

(4)NH4HSO4和H2SO4按物质的量比1:1混合溶于水配制成浸取液,220℃时可将高铝粉煤灰中Al2O3转化为硫酸铝铵[NH4Al(SO4) 2],然后分离、煅烧获得纯Al2O3。
查阅资料知硫酸铝铵:①溶解度:0℃时,S=5.2g;100℃时,S=421.9g 。②280℃时分解。
①依据资料可知,将硫酸铝铵与其他溶质分离的方法是
②煅烧NH4Al(SO4) 2时发生4NH4Al(SO4)2
 2Al2O3+5SO3↑+3SO2↑+2NH3↑+N2↑+5H2O↑,得到混合气体(NH3、N2、SO2、SO3、H2O )。若16mol混合气体按如下装置被完全吸收制得浸取液。则右下图中,试剂X是
2Al2O3+5SO3↑+3SO2↑+2NH3↑+N2↑+5H2O↑,得到混合气体(NH3、N2、SO2、SO3、H2O )。若16mol混合气体按如下装置被完全吸收制得浸取液。则右下图中,试剂X是
您最近一年使用:0次
11-12高一上·黑龙江·期末
名校
解题方法
10 . 将足量铁粉放入由盐酸、MgCl2溶液、FeCl3溶液、CuCl2溶液组成的混合液中,充分反应后,铁粉有剩余,则溶液中含有大量的阳离子是
| A.Cu2+和Fe2+ | B.Fe2+和Mg2+ | C.Fe3+和Fe2+ | D.H+和Cu2+ |
您最近一年使用:0次
2017-02-17更新
|
266次组卷
|
20卷引用:2011-2012学年山东省济宁市曲阜一中高一上学期期末模拟化学试卷
(已下线)2011-2012学年山东省济宁市曲阜一中高一上学期期末模拟化学试卷山东省昌邑市第一中学2017-2018学年高一上学期期末模拟化学试题(已下线)2010—2011学年黑龙江省哈六中高一上学期期末考试化学试卷(已下线)2011-2012学年浙江省桐乡市第一中学高二上学期期中考试化学(文)试卷(已下线)2011-2012学年黑龙江省龙东地区高一上学期高中教学联合体期末考试化学试卷(已下线)2013-2014学年江苏省扬州市高一上学期期末调研测试化学试卷(已下线)2013-2014学年福建省四地六校高一下学期第一次月考化学试卷2015-2016学年广东省潮州市高一上学期期末教学质检化学试卷2015-2016学年甘肃省永昌一中高一上学期期末化学试卷2015-2016学年黑龙江省海林林业局一中高一上学期期末化学试卷2017届湖南省岳阳市华容县四校高三联考二化学试卷2016-2017学年福建省漳平一中等三校高一上联考二化学卷2016-2017学年河北省张家口市第一中学高一(衔接班)上学期期中(文)化学试卷甘肃省嘉峪关市酒钢三中2017-2018学年高一上学期第二次月考化学试题贵州省台江县第二中学2019-2020学年高一上学期期末考试化学试题江西省萍乡市第二中学2019-2020上学期高一上学期期末测试化学试题宁夏回族自治区银川市六盘山市高级中学2020-2021学年高一上学期第二次月考化学试题吉林省长春市第二实验中学2020-2021学年高一下学期开学考试化学试题安徽省霍邱县第一中学2021-2022学年高一上学期第二次段考化学试题(已下线)BBWYhjhx1007.pdf



