1 . 铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
(1)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_______ 。
(2)甲、乙两位同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
①甲同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将FeCl2氧化。FeCl2溶液与氯水反应的化学方程式为_______ 。
②乙同学认为甲的实验不够严谨,该同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_______ 。
(3)如图所示装置可用来制取和观察氢氧化亚铁在空气中被氧化时颜色的变化。实验时必须使用铁屑和6 mol/L的硫酸,其他试剂任选。
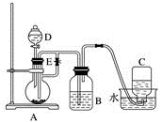
①实验开始时就先将止水夹E_______  填“打开”或“关闭”
填“打开”或“关闭” 。
。
②待装置B中出现较多白色沉淀时,拔去装置B中的橡皮塞,使空气进入,请写出白色沉淀变为红褐色沉淀的化学方程式_______ 。
(1)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
(2)甲、乙两位同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
①甲同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将FeCl2氧化。FeCl2溶液与氯水反应的化学方程式为
②乙同学认为甲的实验不够严谨,该同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是
(3)如图所示装置可用来制取和观察氢氧化亚铁在空气中被氧化时颜色的变化。实验时必须使用铁屑和6 mol/L的硫酸,其他试剂任选。

①实验开始时就先将止水夹E
 填“打开”或“关闭”
填“打开”或“关闭” 。
。②待装置B中出现较多白色沉淀时,拔去装置B中的橡皮塞,使空气进入,请写出白色沉淀变为红褐色沉淀的化学方程式
您最近一年使用:0次
名校
解题方法
2 . 下列有关铁及其化合物的说法中正确的是
| A.Fe3O4为红棕色粉末,俗称铁红 |
| B.Fe(OH)2为白色固体,不溶于水,在空气中能稳定存在 |
| C.FeCl3溶液中加入NaOH溶液,生成红棕色沉淀 |
| D.除去铁粉中混有的铝粉,可以加入足量氢氧化钠溶液,然后过滤 |
您最近一年使用:0次
名校
解题方法
3 . 价一类二维图是学习元素化合物知识的重要模型和工具,它以元素的化合价为纵坐标,以物质类别为横坐标。下图为铁元素的价一类二维图,其中的箭头表示部分物质间的转化关系。下列说法正确的是


| A.用铁丝在氧气中燃烧可实现上述转化① |
| B.转化⑤是Na2FeO4用于自来水消毒杀菌,等物质的量的Na2FeO4和HClO消毒效率相同 |
| C.转化⑦发生反应的类型是化合反应 |
| D.加热Fe(OH)3发生转化⑥,加水溶解可实现转化③ |
您最近一年使用:0次
2021-01-03更新
|
236次组卷
|
3卷引用:安徽省示范高中培优联盟2020-2021学年高一上学期冬季联赛化学试题
名校
解题方法
4 . Ⅰ.铁是生产、生活及生命中的重要元素。
(1)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2结合的能力。药品美蓝是其有效的解毒剂,解毒时美蓝发生___________ (填“氧化”或“还原”)反应。
(2)现有一瓶放置了一段时间的某浓度的FeCl2溶液,请设计实验检验其中是否含有Fe3+:___________ 。
(3)普通铁粉与水蒸气在高温下反应生成铁的某种氧化物和氢气,该氧化物和氢气在高温下发生逆反应得到“引火铁”。若一定量的普通铁粉和水蒸气在高温下反应生成44.8 L H2(已换算到标况下),则转移电子数目为___________ ;“引火铁”是一种极细的铁粉,它在空气中可以自燃,其原因是___________ 。
Ⅱ.化合物M是某种具有磁学性质的新型电子材料的主要成分,由两种元素组成。为了研究其组成,设计如下实验:

气体甲可使湿润红色石蕊试纸变蓝。请回答:
(4)M的化学式为___________ 。
(5)白色沉淀乙在空气中变成红褐色沉淀丙的原因是(用化学方程式表示)___________ 。
(6)高温条件下,丁与甲反应生成两种单质和水,该反应的化学方程式为___________ 。
(1)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2结合的能力。药品美蓝是其有效的解毒剂,解毒时美蓝发生
(2)现有一瓶放置了一段时间的某浓度的FeCl2溶液,请设计实验检验其中是否含有Fe3+:
(3)普通铁粉与水蒸气在高温下反应生成铁的某种氧化物和氢气,该氧化物和氢气在高温下发生逆反应得到“引火铁”。若一定量的普通铁粉和水蒸气在高温下反应生成44.8 L H2(已换算到标况下),则转移电子数目为
Ⅱ.化合物M是某种具有磁学性质的新型电子材料的主要成分,由两种元素组成。为了研究其组成,设计如下实验:

气体甲可使湿润红色石蕊试纸变蓝。请回答:
(4)M的化学式为
(5)白色沉淀乙在空气中变成红褐色沉淀丙的原因是(用化学方程式表示)
(6)高温条件下,丁与甲反应生成两种单质和水,该反应的化学方程式为
您最近一年使用:0次
名校
5 . 通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是( )
| 选项 | 操作、现象 | 解释 |
| A | 向KI-淀粉溶液中加入FeCl3溶液,溶液变蓝 | Fe3+能与淀粉发生显色反应 |
| B | 把生铁放置于潮湿的空气中,铁表面有一层红棕色的斑点 | 铁在潮湿的空气中易生成Fe(OH)3 |
| C | 向盐酸中加入少量铁粉,有气泡产生 | 说明Fe被氧化为Fe3+ |
| D | 新制Fe(OH)2露置于空气中一段时间,白色物质变成了红褐色 | 说明Fe(OH)2易被O2氧化成Fe(OH)3 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-12-04更新
|
629次组卷
|
9卷引用:安徽省滁州市定远县民族中学2020-2021学年高一11月月考化学试题
安徽省滁州市定远县民族中学2020-2021学年高一11月月考化学试题安徽省六安市新安中学2020-2021学年高一下学期入学考试化学试题广东省珠海市第二中学2020-2021学年高一12月月考化学试题吉林省前郭尔罗斯蒙古族自治县蒙古族中学2021-2022学年高一上学期第二次月考化学试题北京市第五中学2021-2022学年高一上学期第二次阶段性考试化学试题内蒙古霍林郭勒市第一中学2021-2022学年高二上学期12月月考化学试题河南省洛阳市伊川县第一高中2021-2022学年高一上学期第二次月考化学试题江西省南昌市豫章中学20212-2022学年高一下学期第一次月考化学试题作业(十八) 铁盐和亚铁盐
名校
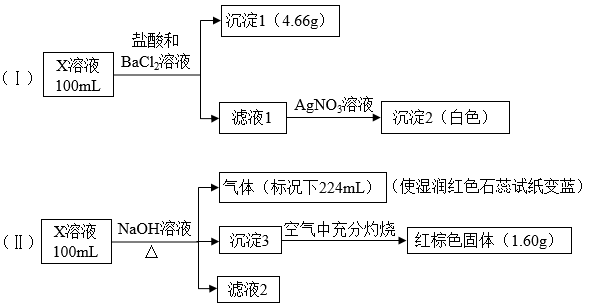
6 . X溶液中可能含有下列8种离子中的几种:Fe3+、Fe2+、Na+、NH 、CO
、CO 、Cl−、SO
、Cl−、SO 、SO
、SO 。某同学为确定其成分,设计并完成以下实验(已知:Fe3+与SCN−呈血红色,且不考虑水解,所加试剂均足量):
。某同学为确定其成分,设计并完成以下实验(已知:Fe3+与SCN−呈血红色,且不考虑水解,所加试剂均足量):
下列说法正确的是
 、CO
、CO 、Cl−、SO
、Cl−、SO 、SO
、SO 。某同学为确定其成分,设计并完成以下实验(已知:Fe3+与SCN−呈血红色,且不考虑水解,所加试剂均足量):
。某同学为确定其成分,设计并完成以下实验(已知:Fe3+与SCN−呈血红色,且不考虑水解,所加试剂均足量):
下列说法正确的是
A.X溶液中一定存在Na+、SO 、SO 、SO 、CO 、CO |
B.X溶液中一定存在NH 、Na+、SO 、Na+、SO ,至少含有Fe3+、Fe2+离子中的一种 ,至少含有Fe3+、Fe2+离子中的一种 |
| C.取少量X溶液,先加入适量氯水,再加少量KSCN溶液,若溶液呈血红色,则含有Fe2+ |
D.X溶液中一定含有Cl−,且c(Cl−) 0.1mol·L−1 0.1mol·L−1 |
您最近一年使用:0次
2020-11-29更新
|
655次组卷
|
2卷引用:安徽省安庆市第一中学2020-2021学年高一上学期期中考试化学试题
名校
解题方法
7 . 某溶液中有Cu2+、Mg2+、Fe2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是
| A.Cu2+ | B.Mg2+ | C.Fe2+ | D.Al3+ |
您最近一年使用:0次
2020-09-14更新
|
122次组卷
|
7卷引用:安徽省安庆市宿松县程集中学2021届高三上学期9月月考化学试题
名校
8 . I.完成以下方程式:⑴写离子方程式,⑵⑶⑷写化学方程式
⑴Na与H2O:________________ ;
⑵氢氧化亚铁露置在空气中:________________ ;
⑶制粗Si:________________ ;
⑷少量CO2通入Na2SiO3溶液:________________ 。
II.有以下物质:①Fe2O3②Na2CO3③Cl2④浓盐酸⑤浓硫酸⑥SO2⑦高岭石Al2(Si2O5)(OH)4
⑸属于碱性氧化物的是________________ (填序号);
⑹工业上用③与石灰乳制取漂白粉,漂白粉的有效成分的化学式是_____________ ;
⑺写出Cu与⑤反应的化学方程式________________ 。
⑻请将物质⑦改写成氧化物的形式________________ 。
⑴Na与H2O:
⑵氢氧化亚铁露置在空气中:
⑶制粗Si:
⑷少量CO2通入Na2SiO3溶液:
II.有以下物质:①Fe2O3②Na2CO3③Cl2④浓盐酸⑤浓硫酸⑥SO2⑦高岭石Al2(Si2O5)(OH)4
⑸属于碱性氧化物的是
⑹工业上用③与石灰乳制取漂白粉,漂白粉的有效成分的化学式是
⑺写出Cu与⑤反应的化学方程式
⑻请将物质⑦改写成氧化物的形式
您最近一年使用:0次
2020-09-11更新
|
229次组卷
|
2卷引用:安徽省安庆市太湖县太湖中学2019-2020学年高一上学期期末考试化学试题
名校
9 . 如图是一些中学常见的物质之间的转化关系(其中部分反应产物省略),其中A和B常温下都是气体,且水溶液都有漂白性;I是一种金属单质;F、M、N均为难溶于水的白色沉淀,H为红褐色沉淀,其中M和N不溶于稀硝酸,C和D是两种常见的强酸。请回答下列问题:

(1)写出①的化学方程式_________ 。
(2)写反应②的离子方程式_________ 。
(3)写出将A通入石灰乳的化学方程式________ 。
(4)将NaOH溶液加入到E中的现象为________ 。
(5)写出反应⑥的化学反应方程式________ 。

(1)写出①的化学方程式
(2)写反应②的离子方程式
(3)写出将A通入石灰乳的化学方程式
(4)将NaOH溶液加入到E中的现象为
(5)写出反应⑥的化学反应方程式
您最近一年使用:0次
2020-08-20更新
|
60次组卷
|
2卷引用:安徽省马鞍山市含山县第二中学2021-2022学年高三上学期第一次月考化学试题
名校
10 . 已知A、B、C、D分别是AlCl3、BaCl2、FeSO4、NaOH四种化合物中的一种,它们的水溶液之间的一些反应现象如下:
①A+B→白色沉淀,加入稀硝酸,沉淀不溶解。
②B+D→白色沉淀,在空气中放置,沉淀由白色转化为红褐色。
③C+D→白色沉淀,继续加D溶液,白色沉淀逐渐消失。
(1)则各是什么物质的化学式为:A_______ 、B_______ 、C_______ 、D_______ 。
(2)现象②中所发生的反应的化学方程式为:__________________________________ 、______________________________ 。
(3)现象③中所发生反应的离子方程式为:__________________________________ 、________________________________ 。
①A+B→白色沉淀,加入稀硝酸,沉淀不溶解。
②B+D→白色沉淀,在空气中放置,沉淀由白色转化为红褐色。
③C+D→白色沉淀,继续加D溶液,白色沉淀逐渐消失。
(1)则各是什么物质的化学式为:A
(2)现象②中所发生的反应的化学方程式为:
(3)现象③中所发生反应的离子方程式为:
您最近一年使用:0次
2020-05-05更新
|
152次组卷
|
12卷引用:2015-2016学年安徽省合肥三中高一上学期12月月考化学试卷
2015-2016学年安徽省合肥三中高一上学期12月月考化学试卷(已下线)2011-2012学年陕西省西安市第一中学高一上学期期末化学试卷2014-2015河北省正定中学高一上学期期末考试化学试卷2016-2017学年河北省沧州一中高二上开学测化学试卷西藏日喀则市南木林高级中学2017-2018学年高一上学期期末考试化学试题陕西省西安市长安区第一中学2017-2018学年高一上学期第二次月考化学(重点、平行班)试题【全国百强校】甘肃省天水一中2018-2019学年高一上学期期末考试化学试题陕西省西安市第一中学2018-2019学年高一上学期期末考试化学试题四川省绵阳市三台中学2019-2020学年高一12月月考化学试题甘肃省陇南市徽县第三中学2020-2021学年高一上学期期末考试化学试题甘肃省武威市凉州区2022-2023学年高三上学期第二次考试化学试题海南省农垦中学2023-2024学年高一上学期期末考试化学试题(重点班)



