名校
解题方法
1 . 某化合物A(由三种元素构成),为了探究其组成,进行了如下实验:
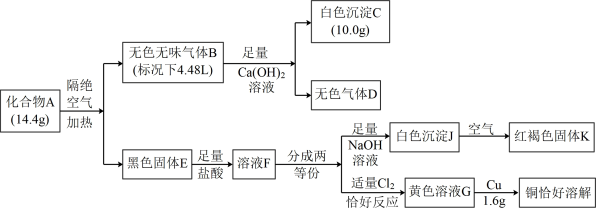
已知:气体D在标准状况下的密度为1.25g/L。试回答:
(1)无色气体D的化学式为___________ ,化合物A的化学式为___________ 。
(2)请写出白色沉淀J变成红褐色固体K的化学方程式___________ 。
(3)请写出溶液F中阳离子的检验方法___________ 。

已知:气体D在标准状况下的密度为1.25g/L。试回答:
(1)无色气体D的化学式为
(2)请写出白色沉淀J变成红褐色固体K的化学方程式
(3)请写出溶液F中阳离子的检验方法
您最近一年使用:0次
2 . 利用铁元素价类二维图可以多角度研究含铁物质的性质及转化关系,请完成下列问题。

(1)下列说法不正确的是
(2)写出反应⑥的化学方程式__________________
(3)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象________________________ 。
(4)K2FeO4常用作杀菌消毒剂,生产K2FeO4的反应原理如下:
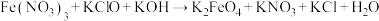 (未配平),则该反应中氧化剂与还原剂的粒子数之比为
(未配平),则该反应中氧化剂与还原剂的粒子数之比为______ 。
(5)从制造印刷电路板的废液中(含)FeCl2和CuCl2)回收铜,并重新获得FeCl3溶液的工艺流程如下:

请写出上述流程中加入①和④的有关物质的化学式:①__________________ ④__________________ 。请写出通入⑥反应的离子方程式__________________

(1)下列说法不正确的是
| A.Fe2O3是碱性氧化物 |
| B.铁与高温水蒸气的反应可实现上述转化① |
| C.能用酸性高锰酸钾溶液褪色鉴定FeCl2和FeCl3溶液。 |
| D.硫酸亚铁片和维生素C(具有还原性)同时服用能增强治疗缺铁性贫血的效果 |
(2)写出反应⑥的化学方程式
(3)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象
(4)K2FeO4常用作杀菌消毒剂,生产K2FeO4的反应原理如下:
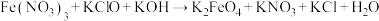 (未配平),则该反应中氧化剂与还原剂的粒子数之比为
(未配平),则该反应中氧化剂与还原剂的粒子数之比为(5)从制造印刷电路板的废液中(含)FeCl2和CuCl2)回收铜,并重新获得FeCl3溶液的工艺流程如下:

请写出上述流程中加入①和④的有关物质的化学式:①
您最近一年使用:0次
名校
解题方法
3 . 某小组同学为了获取在 制备过程中,沉淀颜色的改变与氧气有关的证据,用下图所示装置进行了实验(夹持装置已略去,气密性已检验)。
制备过程中,沉淀颜色的改变与氧气有关的证据,用下图所示装置进行了实验(夹持装置已略去,气密性已检验)。
实验步骤:
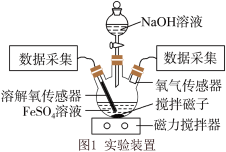
Ⅰ.向三颈瓶中加入饱和 溶液,按如图1所示装置连接;
溶液,按如图1所示装置连接;
Ⅱ.打开磁力搅拌器,立即加入 溶液;
溶液;
Ⅲ.采集瓶内空气中 含量和溶液中
含量和溶液中 含量(DO)的数据。
含量(DO)的数据。
实验数据:
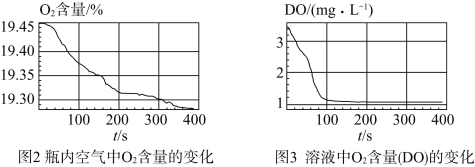
问题与解释:
(1)盛放 溶液的仪器名称为
溶液的仪器名称为___________ 。
(2)若溶液中 含量(DO)取值为1.6,则该溶液中
含量(DO)取值为1.6,则该溶液中 含量可以表示为
含量可以表示为___________  。生成白色沉淀的离子方程式是
。生成白色沉淀的离子方程式是___________ 。
(3)溶液中白色絮状沉淀 易被氧化,沉淀转化过程的现象是
易被氧化,沉淀转化过程的现象是___________ 。
(4)通过上述实验,可得到“在 制备过程中,沉淀颜色改变与氧气有关”的结论,其实验证据是
制备过程中,沉淀颜色改变与氧气有关”的结论,其实验证据是___________ 。
(5)打印机使用的墨粉中含有 。将
。将 溶液和
溶液和 溶液按一定比例混合,再加入一定量的
溶液按一定比例混合,再加入一定量的 溶液,水浴加热,可制得
溶液,水浴加热,可制得 ,写出该离子方程式:
,写出该离子方程式:___________ 。
 制备过程中,沉淀颜色的改变与氧气有关的证据,用下图所示装置进行了实验(夹持装置已略去,气密性已检验)。
制备过程中,沉淀颜色的改变与氧气有关的证据,用下图所示装置进行了实验(夹持装置已略去,气密性已检验)。实验步骤:

Ⅰ.向三颈瓶中加入饱和
 溶液,按如图1所示装置连接;
溶液,按如图1所示装置连接;Ⅱ.打开磁力搅拌器,立即加入
 溶液;
溶液;Ⅲ.采集瓶内空气中
 含量和溶液中
含量和溶液中 含量(DO)的数据。
含量(DO)的数据。实验数据:

问题与解释:
(1)盛放
 溶液的仪器名称为
溶液的仪器名称为(2)若溶液中
 含量(DO)取值为1.6,则该溶液中
含量(DO)取值为1.6,则该溶液中 含量可以表示为
含量可以表示为 。生成白色沉淀的离子方程式是
。生成白色沉淀的离子方程式是(3)溶液中白色絮状沉淀
 易被氧化,沉淀转化过程的现象是
易被氧化,沉淀转化过程的现象是(4)通过上述实验,可得到“在
 制备过程中,沉淀颜色改变与氧气有关”的结论,其实验证据是
制备过程中,沉淀颜色改变与氧气有关”的结论,其实验证据是(5)打印机使用的墨粉中含有
 。将
。将 溶液和
溶液和 溶液按一定比例混合,再加入一定量的
溶液按一定比例混合,再加入一定量的 溶液,水浴加热,可制得
溶液,水浴加热,可制得 ,写出该离子方程式:
,写出该离子方程式:
您最近一年使用:0次
2023-12-24更新
|
126次组卷
|
2卷引用:江苏省“江南十校”2023-2024学年高一上学期分科诊断摸底联考化学试卷
名校
4 . 已知A常温常压下为无色液体,A为气体时与R反应生成B和E,M、R是两种常见的金属,M是地壳中含量最多的金属元素的单质,T是淡黄色固体,B. C是无色无味的气体,E是具有磁性的黑色晶体,H是红褐色固体。
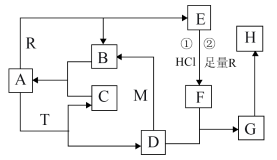
(1)物质T的化学式为___________ 。15.6g T与足量的A反应电子转移数为___________ 个(已知:阿伏伽德罗常数为NA)。
(2)D和M在溶液中反应生成B的离子反应方程式为___________ 。
(3)G在潮湿空气中转化为H的化学方程式为___________ 。
(4)T和F反应只生成C、H和一种盐,其离子反应方程式为_________ 。
(5)若向E和R的混合物中加入100mL 2mol/L的盐酸,恰好使混合物完全溶解,放出448mL(标准状况)气体,向所得溶液中加入KSCN溶液,无血红色出现。若用足量的CO在高温下还原相同质量的上述混合物,得到的固体质量为___________ g。

(1)物质T的化学式为
(2)D和M在溶液中反应生成B的离子反应方程式为
(3)G在潮湿空气中转化为H的化学方程式为
(4)T和F反应只生成C、H和一种盐,其离子反应方程式为
(5)若向E和R的混合物中加入100mL 2mol/L的盐酸,恰好使混合物完全溶解,放出448mL(标准状况)气体,向所得溶液中加入KSCN溶液,无血红色出现。若用足量的CO在高温下还原相同质量的上述混合物,得到的固体质量为
您最近一年使用:0次
2023-12-15更新
|
411次组卷
|
2卷引用:辽宁省实验中学2023-2024学年高一上学期12月化学试卷
5 . 铁及其化合物在日常生活中有广泛应用。
(1)向硫酸亚铁溶液中滴加氢氧化钠溶液,生成白色沉淀,迅速___________ (补全实验现象),化学方程式为___________ 。
(2)绿矾( )是补血剂的原料,易变质。设计实验证明绿矾未
)是补血剂的原料,易变质。设计实验证明绿矾未完全 变质________ 。
(3)利用绿矾制备还原铁粉的工业流程如下:
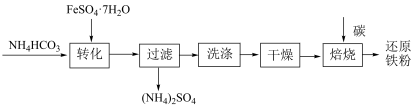
①“转化”是在水溶液中进行,产生白色沉淀和无色无味气体。写出反应的离子方程式___________ 。
②干燥过程主要是为了脱去游离水和结晶水,过程中会有少量 在空气中被氧化为
在空气中被氧化为 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(4)某同学在:实验室进行铁盐与亚铁盐相互转化的实验:
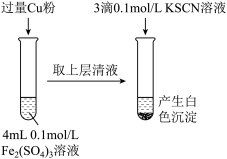
实验 :将
:将 转化为
转化为
① 与
与 粉发生反应的离子方程式为
粉发生反应的离子方程式为___________ 。
②探究白色沉淀产生的原因,请填写实验方案:
查阅资料:i. 的依学性质与
的依学性质与 相似;ii.
相似;ii.
 与
与 反应的离子方程式为
反应的离子方程式为____________________ 。
实验II:将 转化为
转化为
③用离子方程式表示溶液变红的原因是___________ 、 ,为探究红色消失的原因,继续查阅资料:SCN中C为+4价,N为-3价,可被强氧化剂氧化为CO2、N2和
,为探究红色消失的原因,继续查阅资料:SCN中C为+4价,N为-3价,可被强氧化剂氧化为CO2、N2和 ,用离子方程式表示红色消失的原因为:
,用离子方程式表示红色消失的原因为:___________ 。
(1)向硫酸亚铁溶液中滴加氢氧化钠溶液,生成白色沉淀,迅速
(2)绿矾(
 )是补血剂的原料,易变质。设计实验证明绿矾未
)是补血剂的原料,易变质。设计实验证明绿矾未(3)利用绿矾制备还原铁粉的工业流程如下:

①“转化”是在水溶液中进行,产生白色沉淀和无色无味气体。写出反应的离子方程式
②干燥过程主要是为了脱去游离水和结晶水,过程中会有少量
 在空气中被氧化为
在空气中被氧化为 ,该反应的化学方程式为
,该反应的化学方程式为(4)某同学在:实验室进行铁盐与亚铁盐相互转化的实验:

实验
 :将
:将 转化为
转化为
①
 与
与 粉发生反应的离子方程式为
粉发生反应的离子方程式为②探究白色沉淀产生的原因,请填写实验方案:
查阅资料:i.
 的依学性质与
的依学性质与 相似;ii.
相似;ii.
 与
与 反应的离子方程式为
反应的离子方程式为实验II:将
 转化为
转化为
| 实验方案 | 现象 |
| 向0.1mol/LFeCl2溶液中加入一滴KSCN溶液;再通入氯气 | 溶液颜色无明显变化;溶液变红,一段时间后红色消失。 |
 ,为探究红色消失的原因,继续查阅资料:SCN中C为+4价,N为-3价,可被强氧化剂氧化为CO2、N2和
,为探究红色消失的原因,继续查阅资料:SCN中C为+4价,N为-3价,可被强氧化剂氧化为CO2、N2和 ,用离子方程式表示红色消失的原因为:
,用离子方程式表示红色消失的原因为:
您最近一年使用:0次
名校
解题方法
6 . 某小组用下图所示装置来制取 ,并观察其在空气中被氧化过程的颜色变化.实验时所使用的试剂有:铁屑、稀硫酸和氢氧化钠溶液.请完成下列问题:
,并观察其在空气中被氧化过程的颜色变化.实验时所使用的试剂有:铁屑、稀硫酸和氢氧化钠溶液.请完成下列问题:
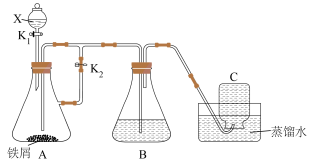
(1)仪器X的名称为___________ ;B中盛装的试剂为___________ .
(2)A中主要反应的离子方程式为___________ .
(3)配制氢氧化钠溶液时,为除去蒸馏水中溶解的 ,常采用的方法是
,常采用的方法是___________ .
(4)实验开始时应先将
___________ (填“关闭”或“打开”),再打开 .
.
(5)实验完毕后,取下装置B的橡胶塞,B瓶中可观察到的现象为___________ ,发生反应的化学方程式为___________ .
(6)实验中产生 的作用有
的作用有___________ (填序号).
A.排出装置内的空气
B.将A中溶液压入B中
C.保护 不被空气氧化
不被空气氧化
 ,并观察其在空气中被氧化过程的颜色变化.实验时所使用的试剂有:铁屑、稀硫酸和氢氧化钠溶液.请完成下列问题:
,并观察其在空气中被氧化过程的颜色变化.实验时所使用的试剂有:铁屑、稀硫酸和氢氧化钠溶液.请完成下列问题:
(1)仪器X的名称为
(2)A中主要反应的离子方程式为
(3)配制氢氧化钠溶液时,为除去蒸馏水中溶解的
 ,常采用的方法是
,常采用的方法是(4)实验开始时应先将

 .
.(5)实验完毕后,取下装置B的橡胶塞,B瓶中可观察到的现象为
(6)实验中产生
 的作用有
的作用有A.排出装置内的空气
B.将A中溶液压入B中
C.保护
 不被空气氧化
不被空气氧化
您最近一年使用:0次
2023-12-06更新
|
228次组卷
|
2卷引用:辽宁省丹东市2023-2024学年高一上学期期中教学质量调研测试化学试题
解题方法
7 . 金属钛素有“太空金属”、“海洋金属”、“未来金属”等美誉,我国有丰富的钛矿资源。一种以钛铁矿 ,含
,含 ,等杂质)为主要原料制备钛白粉
,等杂质)为主要原料制备钛白粉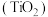 的工艺流程如下图所示。
的工艺流程如下图所示。
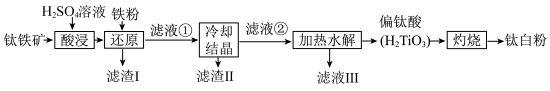
已知:① 不溶于水和稀酸;
不溶于水和稀酸;
②“酸浸”后钛元素主要以 形式存在;
形式存在;
③ 在
在 时生成沉淀,
时生成沉淀, 时沉淀完全。
时沉淀完全。
回答下列问题:
(1)提高“酸浸”浸出率的方法有___________ 。
(2)写出“酸浸”操作 发生反应的化学方程式
发生反应的化学方程式___________ 。
(3)滤渣Ⅰ的主要成分为___________ (填写化学式)。
(4)该流程中常加入铁粉来还原体系中的 。某课题研究小组为探究最佳反应条件,在保持相同的反应时间的条件下获得如下探究结果。图A为保持其它反应条件不变,还原体系中Fe(Ⅲ)含量随pH的变化图,图B为保持其它反应条件不变,还原体系中Fe(Ⅲ)含量随温度的变化图)
。某课题研究小组为探究最佳反应条件,在保持相同的反应时间的条件下获得如下探究结果。图A为保持其它反应条件不变,还原体系中Fe(Ⅲ)含量随pH的变化图,图B为保持其它反应条件不变,还原体系中Fe(Ⅲ)含量随温度的变化图)

①分析图A中M点以后体系中Fe(Ⅲ)含量随pH增大而增大的原因___________ 。
②图B所示还原体系中Fe(Ⅲ)的最佳反应温度是___________ ℃。
(5)经处理后,流程中可循环利用有___________ (填写化学式)。
(6)一种电解法制钛的工艺如下图所示,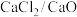 共熔体为介质,在阴极被还原的钙进一步还原
共熔体为介质,在阴极被还原的钙进一步还原 得到钛,在阴极制取钛的相关反应方程式为
得到钛,在阴极制取钛的相关反应方程式为___________ 。

 ,含
,含 ,等杂质)为主要原料制备钛白粉
,等杂质)为主要原料制备钛白粉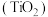 的工艺流程如下图所示。
的工艺流程如下图所示。
已知:①
 不溶于水和稀酸;
不溶于水和稀酸;②“酸浸”后钛元素主要以
 形式存在;
形式存在;③
 在
在 时生成沉淀,
时生成沉淀, 时沉淀完全。
时沉淀完全。回答下列问题:
(1)提高“酸浸”浸出率的方法有
(2)写出“酸浸”操作
 发生反应的化学方程式
发生反应的化学方程式(3)滤渣Ⅰ的主要成分为
(4)该流程中常加入铁粉来还原体系中的
 。某课题研究小组为探究最佳反应条件,在保持相同的反应时间的条件下获得如下探究结果。图A为保持其它反应条件不变,还原体系中Fe(Ⅲ)含量随pH的变化图,图B为保持其它反应条件不变,还原体系中Fe(Ⅲ)含量随温度的变化图)
。某课题研究小组为探究最佳反应条件,在保持相同的反应时间的条件下获得如下探究结果。图A为保持其它反应条件不变,还原体系中Fe(Ⅲ)含量随pH的变化图,图B为保持其它反应条件不变,还原体系中Fe(Ⅲ)含量随温度的变化图)
①分析图A中M点以后体系中Fe(Ⅲ)含量随pH增大而增大的原因
②图B所示还原体系中Fe(Ⅲ)的最佳反应温度是
(5)经处理后,流程中可循环利用有
(6)一种电解法制钛的工艺如下图所示,
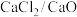 共熔体为介质,在阴极被还原的钙进一步还原
共熔体为介质,在阴极被还原的钙进一步还原 得到钛,在阴极制取钛的相关反应方程式为
得到钛,在阴极制取钛的相关反应方程式为
您最近一年使用:0次
名校
解题方法
8 . 物质A和B均为中学化学常见物质,A、B含同种元素。A在一定条件下转化为B的反应如下图所示。已知该反应为氧化还原反应,部分产物略去。回答下列问题:
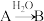
(1)若A为单质:
①A的焰色为黄色,则反应的离子方程式为:___________ ;
②B为金属氧化物,则反应的化学方程式为:___________ ;
③A既为氧化剂又为还原剂,则反应的离子方程式为:___________ ;
(2)若A为金属氧化物,则反应的化学方程式为:___________ ;
(3)若A为氢氧化物,且转化为B时有 参加反应,则反应的化学方程式为:
参加反应,则反应的化学方程式为:___________ 。
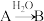
(1)若A为单质:
①A的焰色为黄色,则反应的离子方程式为:
②B为金属氧化物,则反应的化学方程式为:
③A既为氧化剂又为还原剂,则反应的离子方程式为:
(2)若A为金属氧化物,则反应的化学方程式为:
(3)若A为氢氧化物,且转化为B时有
 参加反应,则反应的化学方程式为:
参加反应,则反应的化学方程式为:
您最近一年使用:0次
2023-11-27更新
|
206次组卷
|
3卷引用:黑龙江省哈尔滨市2023-2024学年师大附中高一上学期化学期中测试
解题方法
9 . I.Na2CO3和NaHCO3是厨房中常见的两种盐。回答下列问题:
(1)与酸反应的差异进行鉴别。甲组进行了如图4组实验。
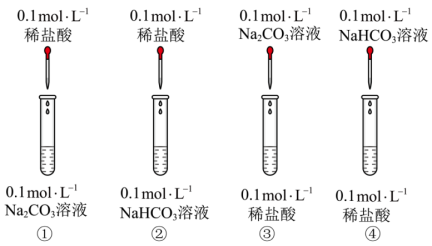
其中实验___________ 和___________ (填实验序号)可以鉴别Na2CO3和NaHCO3。
(2)利用如图实验比较碳酸钠和碳酸氢钠的热稳定性,则物质甲的化学式为___________ 。
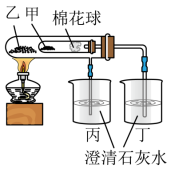
取某碳酸钠和碳酸氢钠混合物2.74g,加热到质量不再变化时,剩余固体的质量为2.12g,则混合物中碳酸钠的质量为___________ 克。
Ⅱ.如图所示,此装置可用来制备Fe(OH)2并验证其还原性,填写下列空白:
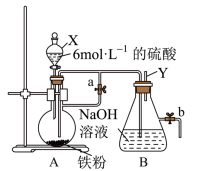
(3)制备Fe(OH)2:
仪器X的名称为___________ ,实验开始时先将止水夹“a”打开,滴入H2SO4和铁粉反应。一段时间后关闭止水夹a,使A中溶液流入B中进行反应。
(4)验证Fe(OH)2还原性:
实验完毕,打开b处止水夹,充入一部分空气,此时B瓶中发生的反应为(写化学方程式)________ ,现象:___________ 。
(5)某同学欲用36.5%浓盐酸(密度1.2g/mL)配制480mL上述实验所需盐酸。
配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果___________ (填写“偏大”、“偏小”、“不变”)。
(1)与酸反应的差异进行鉴别。甲组进行了如图4组实验。

其中实验
(2)利用如图实验比较碳酸钠和碳酸氢钠的热稳定性,则物质甲的化学式为

取某碳酸钠和碳酸氢钠混合物2.74g,加热到质量不再变化时,剩余固体的质量为2.12g,则混合物中碳酸钠的质量为
Ⅱ.如图所示,此装置可用来制备Fe(OH)2并验证其还原性,填写下列空白:

(3)制备Fe(OH)2:
仪器X的名称为
(4)验证Fe(OH)2还原性:
实验完毕,打开b处止水夹,充入一部分空气,此时B瓶中发生的反应为(写化学方程式)
(5)某同学欲用36.5%浓盐酸(密度1.2g/mL)配制480mL上述实验所需盐酸。
配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果
您最近一年使用:0次
名校
10 . A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体,B为黄绿色气体,C为无色气体;D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种无氧强酸溶液,E为黑色固体,H在常温下为液体,它们之间的转化关系如图所示(其中某些反应条件和部分反应产物己略去):
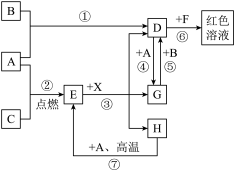
(1)写出下列物质的化学式:D___________ ;X___________ 。
(2)在反应①~⑦中,不属于氧化还原反应的是___________ (填字号)。
(3)往G溶液中加入 溶液观察到的现象是
溶液观察到的现象是___________ 。
(4)反应⑦的化学方程式为___________ ,该反应中每消耗 的A,可转移电子
的A,可转移电子___________ mol。
(5)反应⑥的离子方程式___________ 。

(1)写出下列物质的化学式:D
(2)在反应①~⑦中,不属于氧化还原反应的是
(3)往G溶液中加入
 溶液观察到的现象是
溶液观察到的现象是(4)反应⑦的化学方程式为
 的A,可转移电子
的A,可转移电子(5)反应⑥的离子方程式
您最近一年使用:0次



