1 . 由五种元素组成的化合物X,某学习小组按如图流程进行探究实验。
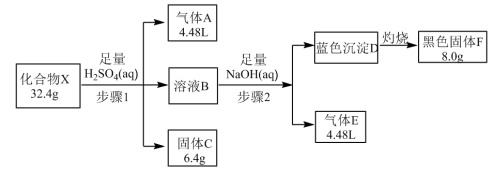
已知:化合物X难溶于水;气体体积均在标准状况下测定,气体A能使品红溶液褪色,气体E在标况下的密度为0.76g/L,固体C呈紫红色。
请回答:
(1)写出气体E的结构式___ ;溶液B中含有的溶质(除了H2SO4)有___ (用化学式表示)。
(2)化合物X含有的元素有Cu、H、___ (写出另外三种元素)。写出步骤1反应的化学方程式___ 。
(3)一定条件下,往溶液B中通入气体A和E,可制备化合物X,写出该反应的离子方程式___ 。
(4)气体E可将Fe2O3还原得到黑色固体(不含Fe3O4),请设计实验验证黑色固体的成分___ 。

已知:化合物X难溶于水;气体体积均在标准状况下测定,气体A能使品红溶液褪色,气体E在标况下的密度为0.76g/L,固体C呈紫红色。
请回答:
(1)写出气体E的结构式
(2)化合物X含有的元素有Cu、H、
(3)一定条件下,往溶液B中通入气体A和E,可制备化合物X,写出该反应的离子方程式
(4)气体E可将Fe2O3还原得到黑色固体(不含Fe3O4),请设计实验验证黑色固体的成分
您最近一年使用:0次
2 . 固体化合物由两种元素组成,某小组开展如下探究实验,其中气体A有刺激性气味,能使湿润的红色石蕊试纸变蓝。为探究X的组成,某研究小组进行如下实验:

(1)X的化学式是_______ ;刺激性气体分子电子式_______ ;
(2)X在纯氧中加强热的化学方程式_______ ;
(3)X与稀硫酸的离子反应方程式:_______ ;
(4)为探究固体丙是否是纯净物,请设计简单的实验方案:_______ 。

(1)X的化学式是
(2)X在纯氧中加强热的化学方程式
(3)X与稀硫酸的离子反应方程式:
(4)为探究固体丙是否是纯净物,请设计简单的实验方案:
您最近一年使用:0次
3 . 某实验小组对 溶液分别与
溶液分别与 、
、 溶液的反应进行探究。
溶液的反应进行探究。
已知:Ⅰ.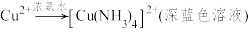
Ⅱ.
回答下列问题:
(1)推测实验Ⅰ中的无色气体为 ,实验验证:用湿润的品红试纸接近试管口,视察到
,实验验证:用湿润的品红试纸接近试管口,视察到___________ ,将品红试纸在烘箱中低温烘干又观察到___________ 。
(2)推测实验Ⅰ中的白色沉淀为 ,实验验证步骤如下:
,实验验证步骤如下:
①实验Ⅰ完成后,立即过滤、洗涤。
②取少量已洗净的白色沉淀于试管中,滴加足量浓氨水,先观察到___________ ,反应的离子方程式为___________ ;露置一段时间,又观察到___________ 。
(3)对比实验Ⅰ、Ⅱ,提出假设, 增强了
增强了 的氧化性。
的氧化性。
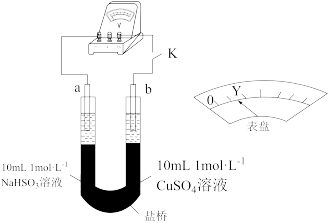
①若假设合理,实物Ⅰ反应的离子方程式为___________ 和 。
。
②用以下实验来验证假设合理,装置如图所示。实验方案:闭合K,电压表的指针偏转至“Y”处;向U形管___________ (补全实验操作及现象)。
(4)将实验Ⅱ的溶液静置24h或加热后,得到红色沉淀。经检验,红色沉淀中含有 、
、 和
和 。甲、乙两位同学通过实验Ⅲ验证把红色沉淀中含有
。甲、乙两位同学通过实验Ⅲ验证把红色沉淀中含有 和
和 。
。
实验Ⅲ:
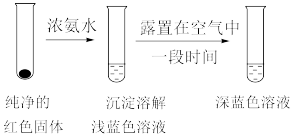
①甲同学认为红色沉淀中含有 ,他判断的理由是
,他判断的理由是___________ 。
②乙同学认为实验Ⅲ不足以证实红色沉淀中含有 ,理由是
,理由是___________ 。
 溶液分别与
溶液分别与 、
、 溶液的反应进行探究。
溶液的反应进行探究。| 实验 | 装置 | 试剂a | 操作及现象 |
| I |   溶液 溶液 |  溶液 溶液 | 加入 溶液,得到绿色溶液,30s时有无色气泡和白色沉淀产生,上层溶液颜色变浅。 溶液,得到绿色溶液,30s时有无色气泡和白色沉淀产生,上层溶液颜色变浅。 |
| Ⅱ |  溶液 溶液 | 加入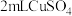 溶液,得到绿色溶液, 溶液,得到绿色溶液, 未见明显变化。 未见明显变化。 |
Ⅱ.

回答下列问题:
(1)推测实验Ⅰ中的无色气体为
 ,实验验证:用湿润的品红试纸接近试管口,视察到
,实验验证:用湿润的品红试纸接近试管口,视察到(2)推测实验Ⅰ中的白色沉淀为
 ,实验验证步骤如下:
,实验验证步骤如下:①实验Ⅰ完成后,立即过滤、洗涤。
②取少量已洗净的白色沉淀于试管中,滴加足量浓氨水,先观察到
(3)对比实验Ⅰ、Ⅱ,提出假设,
 增强了
增强了 的氧化性。
的氧化性。①若假设合理,实物Ⅰ反应的离子方程式为
 。
。②用以下实验来验证假设合理,装置如图所示。实验方案:闭合K,电压表的指针偏转至“Y”处;向U形管

(4)将实验Ⅱ的溶液静置24h或加热后,得到红色沉淀。经检验,红色沉淀中含有
 、
、 和
和 。甲、乙两位同学通过实验Ⅲ验证把红色沉淀中含有
。甲、乙两位同学通过实验Ⅲ验证把红色沉淀中含有 和
和 。
。实验Ⅲ:
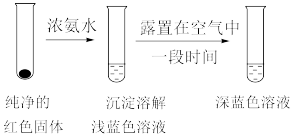
①甲同学认为红色沉淀中含有
 ,他判断的理由是
,他判断的理由是②乙同学认为实验Ⅲ不足以证实红色沉淀中含有
 ,理由是
,理由是
您最近一年使用:0次
4 . A、B、C、D、E五种物质间的转化关系如下:
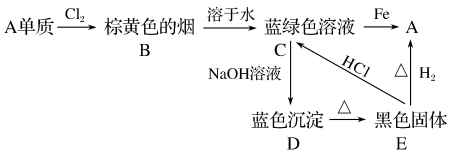
(1)写出A、E的化学式:A___________ 、E___________ 。
(2)写出下列各步反应的化学方程式:
C→A___________ ;
C→D___________ ;
E→A___________ ;
E→C___________ 。

(1)写出A、E的化学式:A
(2)写出下列各步反应的化学方程式:
C→A
C→D
E→A
E→C
您最近一年使用:0次
5 . 以印刷线路板的碱性蚀刻废液(主要成分为[Cu(NH3)4]Cl2)或焙烧过的铜精炼炉渣(主要成分为CuO、SiO2少量Fe2O3)为原料均能制备CuSO4·5H2O晶体。
(1)取一定量蚀刻废液和稍过量的NaOH溶液加入到如图所示实验装置的三颈瓶中,在搅拌下加热反应并通入空气,待产生大量的黑色沉淀时停止反应,趁热过滤、洗涤,得到CuO固体;所得固体经酸溶、结晶、过滤等操作,得到CuSO4·5H2O晶体。_______ 。
②检验CuO固体是否洗净的实验操作是_______ 。
③装置图中装置X的作用是_______ 。
(2)以焙烧过的铜精炼炉渣为原料制备CuSO4·5H2O晶体时,请补充完整相应的实验方案:取一定量焙烧过的铜精炼炉渣,_______ ,加热浓缩、冷却结晶、过滤、晾干,得到CuSO4·5H2O晶体。已知:①该实验中pH=3.2时,Fe3+完全沉淀;pH=4.7时,Cu2+开始沉淀。②实验中可选用的试剂:1.0 mol/L H2SO4、1.0 mol/L HCl、1.0 mol/L NaOH。
(3)通过下列方法测定产品纯度:准确称取0.5000g CuSO4·5H2O样品,加适量水溶解,转移至碘量瓶中,加过量KI溶液并用稀H2SO4酸化,以淀粉溶液为指示剂,用0.1000 mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3的溶液19.48mL。测定过程中发生下列反应:2Cu2++4I-=2CuI↓+I2、2S2O +I2= S4O
+I2= S4O +2I-。计算CuSO4·5H2O样品的纯度:
+2I-。计算CuSO4·5H2O样品的纯度:_______ 。
(1)取一定量蚀刻废液和稍过量的NaOH溶液加入到如图所示实验装置的三颈瓶中,在搅拌下加热反应并通入空气,待产生大量的黑色沉淀时停止反应,趁热过滤、洗涤,得到CuO固体;所得固体经酸溶、结晶、过滤等操作,得到CuSO4·5H2O晶体。
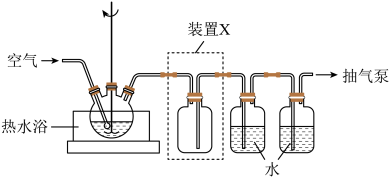
②检验CuO固体是否洗净的实验操作是
③装置图中装置X的作用是
(2)以焙烧过的铜精炼炉渣为原料制备CuSO4·5H2O晶体时,请补充完整相应的实验方案:取一定量焙烧过的铜精炼炉渣,
(3)通过下列方法测定产品纯度:准确称取0.5000g CuSO4·5H2O样品,加适量水溶解,转移至碘量瓶中,加过量KI溶液并用稀H2SO4酸化,以淀粉溶液为指示剂,用0.1000 mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3的溶液19.48mL。测定过程中发生下列反应:2Cu2++4I-=2CuI↓+I2、2S2O
 +I2= S4O
+I2= S4O +2I-。计算CuSO4·5H2O样品的纯度:
+2I-。计算CuSO4·5H2O样品的纯度:
您最近一年使用:0次
2021-07-15更新
|
869次组卷
|
10卷引用:大题03 无机制备类实验题-【考前抓大题】备战2021年高考化学(全国通用)
(已下线)大题03 无机制备类实验题-【考前抓大题】备战2021年高考化学(全国通用)(已下线)培优01 无机制备类实验 基础训练-2021年高考化学大题培优练(新高考地区专用)山东省济南大学城实验高级中学2021届高三4月阶段性测试化学试题黑龙江省哈尔滨师范大学附属中学2020-2021学年高二下学期期末考试化学试题江苏省2021年普通高中学业水平选择考适应性测试化学试题江苏省苏州市姑苏区第十中学2020-2021学年高一下学期期初化学考试江苏省淮安市高中校协作体2021-2022学年高三上学期期中考试化学试题江苏省苏州市张家港市2021-2022学年高三下学期开学考试化学试题湖南省常宁市第一中学2021-2022学年高三下学期期中考试化学试题江苏省苏州实验中学2021-2022学年高二下学期期中考试化学试题
6 . 硫酸铜晶体(CuSO4·5H2O)是铜盐中重要的无机化工原料,广泛应用于农业、电镀、饲料添加剂、催化剂、石油、选矿、油漆等行业。
I.采用孔雀石[主要成分CuCO3·Cu(OH)2]、硫酸(70%)、氨水为原料制取硫酸铜晶体。其工艺流程如图:

已知:(1)硫酸铜晶体易溶于水,难溶于乙醇。
(2)硫酸铜晶体在102℃时失水成CuSO4·3H2O,在113℃时失水成CuSO4·H2O,在258℃时失水成CuSO4。
请回答下列问题:
(1)已知氨浸时发生的反应为CuCO3·Cu(OH)2+8NH3·H2O=[Cu(NH3)4]2(OH)2CO3+8H2O,蒸氨时得到的固体呈黑色。孔雀石经过氨浸、蒸氨操作目的是:___ 。
(2)下列说法正确的是___ 。
A.步骤I,高温可提高浸取率
B.预处理时用破碎机将孔雀石破碎成粒子直径<1mm,其目的是提高反应速率和浸取率
C.步骤III,蒸氨出来的气体有污染,需要净化处理,经吸收净化所得的溶液可作化肥
D.步骤IV,固液分离操作可采用常压过滤,也可采用减压过滤
(3)步骤IV为一系列的操作:
①使晶体从溶液中析出,可采取的方式有___ (写出两条)。
②减压过滤后,洗涤沉淀可能需要用到以下操作:
a.加入水至浸没沉淀物;b.加入乙醇至浸没沉淀物;c.洗涤剂缓慢通过沉淀物;d.洗涤剂快速通过沉淀物;e.关小水龙头;f.开大水龙头;g.重复2-3次。
请选出正确的操作并排序 → → →f→___ 。
③晶体中所含结晶水可通过重量分析法测定,主要步骤有:a.称量b.置于烘箱中脱结晶水c.冷却d.称量e.重复b~d至恒重f.计算。步骤e的目的是___ 。
④若测得结晶水的含量偏低,则杂质可能是___ 。
II.采用金属铜单质制备硫酸铜晶体
(4)某兴趣小组查阅资料得知:Cu+CuCl2=2CuCl,4CuCl+O2+2H2O=2[Cu(OH)2·CuCl2],[Cu(OH)2·CuCl2]+H2SO4=CuSO4+CuCl2+2H2O。现设计如下实验来制备硫酸铜晶体,装置及相关物质溶解度随温度变化如图:

向铜和稀硫酸的混合物中加入氯化铜溶液,利用二连球鼓入空气,将铜溶解,当三颈烧瓶中呈乳状浑浊液时,滴加浓硫酸。装置中存在一处缺陷是___ ;最后可以利用重结晶的方法纯化硫酸铜晶体的原因为___ 。
I.采用孔雀石[主要成分CuCO3·Cu(OH)2]、硫酸(70%)、氨水为原料制取硫酸铜晶体。其工艺流程如图:

已知:(1)硫酸铜晶体易溶于水,难溶于乙醇。
(2)硫酸铜晶体在102℃时失水成CuSO4·3H2O,在113℃时失水成CuSO4·H2O,在258℃时失水成CuSO4。
请回答下列问题:
(1)已知氨浸时发生的反应为CuCO3·Cu(OH)2+8NH3·H2O=[Cu(NH3)4]2(OH)2CO3+8H2O,蒸氨时得到的固体呈黑色。孔雀石经过氨浸、蒸氨操作目的是:
(2)下列说法正确的是
A.步骤I,高温可提高浸取率
B.预处理时用破碎机将孔雀石破碎成粒子直径<1mm,其目的是提高反应速率和浸取率
C.步骤III,蒸氨出来的气体有污染,需要净化处理,经吸收净化所得的溶液可作化肥
D.步骤IV,固液分离操作可采用常压过滤,也可采用减压过滤
(3)步骤IV为一系列的操作:
①使晶体从溶液中析出,可采取的方式有
②减压过滤后,洗涤沉淀可能需要用到以下操作:
a.加入水至浸没沉淀物;b.加入乙醇至浸没沉淀物;c.洗涤剂缓慢通过沉淀物;d.洗涤剂快速通过沉淀物;e.关小水龙头;f.开大水龙头;g.重复2-3次。
请选出正确的操作并排序 → → →f→
③晶体中所含结晶水可通过重量分析法测定,主要步骤有:a.称量b.置于烘箱中脱结晶水c.冷却d.称量e.重复b~d至恒重f.计算。步骤e的目的是
④若测得结晶水的含量偏低,则杂质可能是
II.采用金属铜单质制备硫酸铜晶体
(4)某兴趣小组查阅资料得知:Cu+CuCl2=2CuCl,4CuCl+O2+2H2O=2[Cu(OH)2·CuCl2],[Cu(OH)2·CuCl2]+H2SO4=CuSO4+CuCl2+2H2O。现设计如下实验来制备硫酸铜晶体,装置及相关物质溶解度随温度变化如图:

向铜和稀硫酸的混合物中加入氯化铜溶液,利用二连球鼓入空气,将铜溶解,当三颈烧瓶中呈乳状浑浊液时,滴加浓硫酸。装置中存在一处缺陷是
您最近一年使用:0次
7 . CuCl是一种重要的化工原料和广泛应用的催化剂,它难溶于水,不溶于乙醇。现用低品位铜矿石(主要成分CuS、Cu2S、CuO,杂质为Fe2O3、FeO、SiO2等),制备CuCl的工业流程如下:
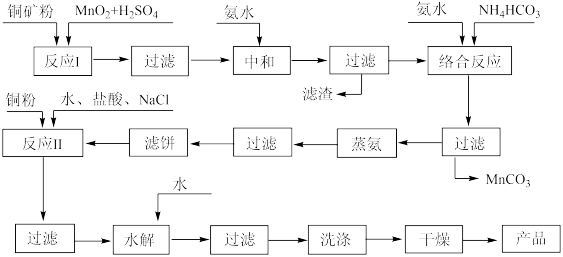
已知:
I.铜盐溶液中加入NH3·H2O和NH4HCO3,可形成配合物Cu(NH3)4CO3
II.在该工艺条件下,生成氢氧化物沉淀的pH范围如下表所示:
回答下列问题
(1)提高矿石浸取率的方法有___________ (任写两种)。
(2)反应I生成的滤渣中有S,写出其中Cu2S参与反应的离子方程式___________ 。
(3)加氨水中和溶液pH应为___________ 。滤饼为黑色固体,其成分含两种元素的质量比为4:1,通过反应II可生成[CuCl2]-,写出此过程的化学方程式___________ 。
(4)根据下图表中数据,加入盐酸与氯化钠适合的条件为___________ 。
NaCl加入量与CuCl产率的关系
HCl加入量与CuCl产率的关系
(5)水解后洗涤沉淀选用的试剂为___________ ,整个流程中能循环使用的物质是___________ 。
(6)100t含铜a%的铜矿石,经流程制备出bt的CuCl,生成CuCl的产率为___________ 。(用含有a、b的代数式表示)

已知:
I.铜盐溶液中加入NH3·H2O和NH4HCO3,可形成配合物Cu(NH3)4CO3
II.在该工艺条件下,生成氢氧化物沉淀的pH范围如下表所示:
| 氢氧化物 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀的pH | 7.7 | 6.5 | 1.1 | 4.2 |
| 沉淀完全的pH | 10.4 | 8.96 | 3.3 | 6.7 |
回答下列问题
(1)提高矿石浸取率的方法有
(2)反应I生成的滤渣中有S,写出其中Cu2S参与反应的离子方程式
(3)加氨水中和溶液pH应为
(4)根据下图表中数据,加入盐酸与氯化钠适合的条件为
NaCl加入量与CuCl产率的关系
| NaCl过量(%) | CuCl产率(%) | NaCl过量(%) | CuCl产率(%) |
| 0 | 78 | 10 | 95 |
| 5 | 86 | - | - |
HCl加入量与CuCl产率的关系
| HCl过量(%) | CuCl产率(%) | HCl过量(%) | CuCl产率(%) |
| 0 | 65 | 10 | 88 |
| 5 | 76 | 15 | 95 |
(5)水解后洗涤沉淀选用的试剂为
(6)100t含铜a%的铜矿石,经流程制备出bt的CuCl,生成CuCl的产率为
您最近一年使用:0次
8 . 胆矾( )易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的
)易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的 (杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:
(杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:
(1)制备胆矾时,用到的实验仪器除量筒、酒精灯、玻璃棒、漏斗外,还必须使用的仪器有_______ (填标号)。
A.烧杯 B.容量瓶 C.蒸发皿 D.移液管
(2)将 加入到适量的稀硫酸中,加热,其主要反应的化学方程式为
加入到适量的稀硫酸中,加热,其主要反应的化学方程式为_______ ,与直接用废铜和浓硫酸反应相比,该方法的优点是_______ 。
(3)待 完全反应后停止加热,边搅拌边加入适量
完全反应后停止加热,边搅拌边加入适量 ,冷却后用
,冷却后用 调
调 为3.5~4,再煮沸
为3.5~4,再煮沸 ,冷却后过滤。滤液经如下实验操作:加热蒸发、冷却结晶、
,冷却后过滤。滤液经如下实验操作:加热蒸发、冷却结晶、_______ 、乙醇洗涤、_______ ,得到胆矾。其中,控制溶液 为3.5~4的目的是
为3.5~4的目的是_______ ,煮沸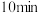 的作用是
的作用是_______ 。
(4)结晶水测定:称量干燥坩埚的质量为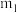 ,加入胆矾后总质量为
,加入胆矾后总质量为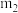 ,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为
,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为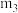 。根据实验数据,胆矾分子中结晶水的个数为
。根据实验数据,胆矾分子中结晶水的个数为_______ (写表达式)。
(5)下列操作中,会导致结晶水数目测定值偏高的是_______ (填标号)。
①胆矾未充分干燥 ②坩埚未置于干燥器中冷却 ③加热时有少量胆矾迸溅出来
 )易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的
)易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的 (杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:
(杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:(1)制备胆矾时,用到的实验仪器除量筒、酒精灯、玻璃棒、漏斗外,还必须使用的仪器有
A.烧杯 B.容量瓶 C.蒸发皿 D.移液管
(2)将
 加入到适量的稀硫酸中,加热,其主要反应的化学方程式为
加入到适量的稀硫酸中,加热,其主要反应的化学方程式为(3)待
 完全反应后停止加热,边搅拌边加入适量
完全反应后停止加热,边搅拌边加入适量 ,冷却后用
,冷却后用 调
调 为3.5~4,再煮沸
为3.5~4,再煮沸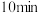 ,冷却后过滤。滤液经如下实验操作:加热蒸发、冷却结晶、
,冷却后过滤。滤液经如下实验操作:加热蒸发、冷却结晶、 为3.5~4的目的是
为3.5~4的目的是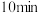 的作用是
的作用是(4)结晶水测定:称量干燥坩埚的质量为
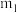 ,加入胆矾后总质量为
,加入胆矾后总质量为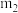 ,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为
,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为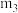 。根据实验数据,胆矾分子中结晶水的个数为
。根据实验数据,胆矾分子中结晶水的个数为(5)下列操作中,会导致结晶水数目测定值偏高的是
①胆矾未充分干燥 ②坩埚未置于干燥器中冷却 ③加热时有少量胆矾迸溅出来
您最近一年使用:0次
2021-06-11更新
|
18422次组卷
|
28卷引用:考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)
(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)第8讲 金属材料(不锈钢、铝合金、合金)(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)专题13 化学实验-备战2022年高考化学学霸纠错(全国通用)(已下线)2021年高考全国甲卷化学试题变式题(已下线)解密11 化学实验(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题10 化学实验综合—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押全国卷理综第26题 实验综合-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点10 实验方案的设计与评价-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题17化学实验综合题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题17化学实验综合题-五年(2018~2022)高考真题汇编(全国卷)(已下线)考点52 定量分析-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第08讲 金属材料(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第28讲 定性、定量实验(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)微专题45 定量测量类综合实验-备战2023年高考化学一轮复习考点微专题(已下线)专题26 定量测定类综合性实验题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 大题突破2 综合实验题题型研究(已下线)专题03 化学实验专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)(已下线)考点16 铜及其金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点12 金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点46 定量分析实验(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)2021年高考全国甲卷化学真题河南省三门峡市实验高中2020-2021学年高二下学期6月月考化学试题(已下线)考点33 物质的定性与定量分析-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)解密11 化学实验基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)河北省保定市唐县第一中学2021-2022学年高二下学期期中考试化学试题河南省驻马店市“逐梦计划”大联考2023-2024学年高二上学期12月期末考试化学试题江西省重点校2022-2023学年高三上学期第二次联考化学试题.
9 . 从含铜丰富的自然资源黄铜矿(CuFeS2)冶炼铜的工艺流程如下:
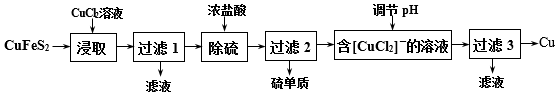
(1)“浸取”时,将黄铜矿进行粉碎的目的是___ 。
(2)“浸取”时,反应生成CuCl、FeCl2和S,该反应化学方程式为____ 。
(3)调节溶液的pH后,除生成Cu外,还能产生一种金属离子,此金属离子是____ 。
(4)“过滤3”所得滤液中可以循环使用的物质有___ 和____ ;为保持流程持续循环,每生成1molCu,理论上需补充CuCl2的物质的量为___ mol。
(5)冶炼工艺还可以将精选后的黄铜矿砂与空气在高温下煅烧,使其转变为铜,化学方程式为:6CuFeS2+13O2 3Cu2S+2Fe3O4+9SO2、Cu2S+O2
3Cu2S+2Fe3O4+9SO2、Cu2S+O2 2Cu+SO2,此工艺与上述工艺相比,主要缺点有
2Cu+SO2,此工艺与上述工艺相比,主要缺点有_____ 。

(1)“浸取”时,将黄铜矿进行粉碎的目的是
(2)“浸取”时,反应生成CuCl、FeCl2和S,该反应化学方程式为
(3)调节溶液的pH后,除生成Cu外,还能产生一种金属离子,此金属离子是
(4)“过滤3”所得滤液中可以循环使用的物质有
(5)冶炼工艺还可以将精选后的黄铜矿砂与空气在高温下煅烧,使其转变为铜,化学方程式为:6CuFeS2+13O2
 3Cu2S+2Fe3O4+9SO2、Cu2S+O2
3Cu2S+2Fe3O4+9SO2、Cu2S+O2 2Cu+SO2,此工艺与上述工艺相比,主要缺点有
2Cu+SO2,此工艺与上述工艺相比,主要缺点有
您最近一年使用:0次
名校
10 . 氯化亚铜(CuCl)可用作有机合成的催化剂,CuCl微溶于水,不溶于醇和稀酸,可溶于Cl-浓度较大的溶液(CuCl+Cl- CuCl
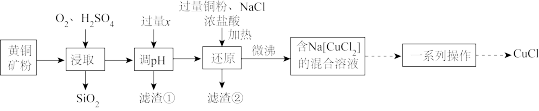
CuCl ),在潮湿空气中易水解、易氧化。工业上用黄铜矿(主要成分是CuFeS2,还含有少量的SiO2)制备CuCl的工艺流程如图:
),在潮湿空气中易水解、易氧化。工业上用黄铜矿(主要成分是CuFeS2,还含有少量的SiO2)制备CuCl的工艺流程如图:
25℃时,相关物质的Ksp见表。
回答下列问题:
(1)黄铜矿预先粉碎的目的是_______ 。
(2)调pH加入的过量x为_______ (填化学式),滤渣①的成分_______ (填化学式)。
(3)“还原”时,铜粉转化为Na[CuCl2]的离子反应方程式为_______ 。
(4)已知:温度、pH对CuCl产率的影响如图1、图2所示。则析出CuCl晶体的最佳条件为_______ 。
A.温度在60℃左右pH为2.0~2.5 B.温度在90℃左右pH为2.0~2.5
C.温度在60℃左右pH为5.0~6.0 D.温度在90℃左右pH为5.0~6.0
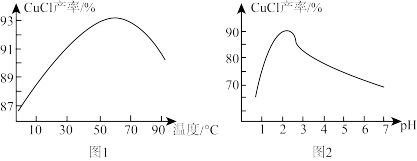
(5)析出的氯化亚铜晶体要立即用无水乙醇洗涤,“醇洗”可快速除去滤渣表面的水,防止滤渣被空气氧化为碱式氯化铜[Cu2(OH)3Cl]。写出氯化亚铜被氧化为碱式氯化铜的化学反应方程式_______ 。
(6)粗产品中氯化亚铜含量的测定:
①称取样品3.0 g于锥形瓶中,再加入过量的FeCl3溶液充分溶解,配制250 mL溶液。②从中取出25.00mL溶液,用0.1000 mol·L-1硫酸铈[Ce(SO4)2]标准溶液滴定。已知:CuCl+FeCl3=CuCl2+FeCl2 Fe2++Ce4+=Fe3++Ce3+。
三次平行实验,到达滴定终点时,消耗硫酸铈标准溶液的体积分别为26.05 mL、24.05 mL、23.95 mL。则样品中CuCl的纯度为_______ (结果保留三位有效数字)。
 CuCl
CuCl ),在潮湿空气中易水解、易氧化。工业上用黄铜矿(主要成分是CuFeS2,还含有少量的SiO2)制备CuCl的工艺流程如图:
),在潮湿空气中易水解、易氧化。工业上用黄铜矿(主要成分是CuFeS2,还含有少量的SiO2)制备CuCl的工艺流程如图:
25℃时,相关物质的Ksp见表。
| 物质 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | CuCl |
| Ksp | 1×10-16.3 | 1×10-38.6 | 1×10-19.7 | 1×10-5.9 |
(1)黄铜矿预先粉碎的目的是
(2)调pH加入的过量x为
(3)“还原”时,铜粉转化为Na[CuCl2]的离子反应方程式为
(4)已知:温度、pH对CuCl产率的影响如图1、图2所示。则析出CuCl晶体的最佳条件为
A.温度在60℃左右pH为2.0~2.5 B.温度在90℃左右pH为2.0~2.5
C.温度在60℃左右pH为5.0~6.0 D.温度在90℃左右pH为5.0~6.0
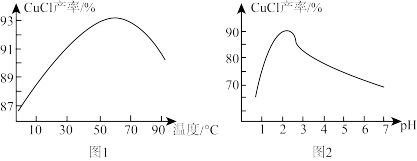
(5)析出的氯化亚铜晶体要立即用无水乙醇洗涤,“醇洗”可快速除去滤渣表面的水,防止滤渣被空气氧化为碱式氯化铜[Cu2(OH)3Cl]。写出氯化亚铜被氧化为碱式氯化铜的化学反应方程式
(6)粗产品中氯化亚铜含量的测定:
①称取样品3.0 g于锥形瓶中,再加入过量的FeCl3溶液充分溶解,配制250 mL溶液。②从中取出25.00mL溶液,用0.1000 mol·L-1硫酸铈[Ce(SO4)2]标准溶液滴定。已知:CuCl+FeCl3=CuCl2+FeCl2 Fe2++Ce4+=Fe3++Ce3+。
三次平行实验,到达滴定终点时,消耗硫酸铈标准溶液的体积分别为26.05 mL、24.05 mL、23.95 mL。则样品中CuCl的纯度为
您最近一年使用:0次
2021-05-08更新
|
696次组卷
|
7卷引用:考点16 铜及其金属材料-备战2022年高考化学一轮复习考点帮(全国通用)
(已下线)考点16 铜及其金属材料-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点16 铜及其金属材料-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点16 铜及其金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)江西省南昌市八一中学2021届高三第三次模拟考试理科综合化学试题(已下线)考点16 铜及其金属材料-备战2022年高考化学一轮复习考点帮(浙江专用)黑龙江省大庆市2021届高三下学期(4月)第二次教学质量监测(二模)化学试题宁夏石嘴山市第三中学2021届高三第四次模拟考试化学试题



