1 . 氨是动植物生长不可缺少的元素,氨在自然界中的循环对生命有重要意义。其循环示意图如下:

(1) 氨分子的电子式是__________ 。
(2) NH3是重要的化工原料,用途广泛,如合成尿素等。合成尿素原理分两步:
CO2(g)+ 2NH3(g)=NH2COONH4(s) △H1=- 159.5kJ/mol
NH2COONH4(s) = CO(NH2)2(s) + H2O(g) △H2=+28.5kJ/mol
则2NH3(g)+ CO2(g)=CO(NH2)2(s) + H2O(g) △H=_______ kJ/mol
(3) 氯化铵也是氨的重要化合物,现有25℃时某浓度的氯化铵溶液中NH3·H2O和NH4+的浓度随pH的变化示意图如图I所示,则图中曲线①代表的是__________ [填c(NH3·H2O)或c(NH4+)]该温度下NH3·H2O 电离平衡常数为___________ (用a 的代数式表示)。

(4) 在厌氧环境下,土壤中的某些微生物(细菌)可将硝酸盐还原成氮气而实现自然界中的氮循环。某研究性学习小组由“自然界中的氮循环”产生联想:利用微生物的作用将化学能转化为电能即设计成微生物电池来同时处理含硝酸钠和有机物的废水,装置原理如图II(图中有机物用C6H12O6表示).写出电极b上的电极反应式__________________ 。
(5) 将游离态的氮转化为化合态的氮叫做氮的固定,其中一种重要的人工固氮就是合成氨。现维持温度为T压强为P的条件下,向一容积可变的密闭容器中通入1molN2和3molH2发生N2(g) +3H2(g) 2NH3(g)的反应。容器容积与反应时间的数据关系如下表:
2NH3(g)的反应。容器容积与反应时间的数据关系如下表:
该条件下达平衡时H2的转化率α(H2)=______ ,平衡常数K=_________ (用V表示)

(1) 氨分子的电子式是
(2) NH3是重要的化工原料,用途广泛,如合成尿素等。合成尿素原理分两步:
CO2(g)+ 2NH3(g)=NH2COONH4(s) △H1=- 159.5kJ/mol
NH2COONH4(s) = CO(NH2)2(s) + H2O(g) △H2=+28.5kJ/mol
则2NH3(g)+ CO2(g)=CO(NH2)2(s) + H2O(g) △H=
(3) 氯化铵也是氨的重要化合物,现有25℃时某浓度的氯化铵溶液中NH3·H2O和NH4+的浓度随pH的变化示意图如图I所示,则图中曲线①代表的是

(4) 在厌氧环境下,土壤中的某些微生物(细菌)可将硝酸盐还原成氮气而实现自然界中的氮循环。某研究性学习小组由“自然界中的氮循环”产生联想:利用微生物的作用将化学能转化为电能即设计成微生物电池来同时处理含硝酸钠和有机物的废水,装置原理如图II(图中有机物用C6H12O6表示).写出电极b上的电极反应式
(5) 将游离态的氮转化为化合态的氮叫做氮的固定,其中一种重要的人工固氮就是合成氨。现维持温度为T压强为P的条件下,向一容积可变的密闭容器中通入1molN2和3molH2发生N2(g) +3H2(g)
 2NH3(g)的反应。容器容积与反应时间的数据关系如下表:
2NH3(g)的反应。容器容积与反应时间的数据关系如下表:| 时间/min | 0 | 5 | 10 | 20 | 40 | 80 |
| 容器 容积/L | 4.00V | 3.20V | 2.80V | 2.60V | 2.50V | 2.50V |
该条件下达平衡时H2的转化率α(H2)=
您最近一年使用:0次
2 . 根据有关知识回答下列问题
(1)25℃时,0.1 mol‧L-1的一元酸HA溶液中c(H+)=1.0×10-4 mol‧L-1,请回答下列问题:此时溶液的pH=_______ ,HA是________ 酸(填“强”或“弱”)。
(2)现有NaHCO3、NaHSO3、NaHSO4三种常见的酸式盐,它们在工业生产和日常生活中有着广泛的应用。请回答有关问题:
①25℃时,NaHCO3的水溶液显_____ 性(填“酸”或“碱”)。
②25℃时,物质的量浓度均为0.01 mol‧L-1的三种酸式盐溶液,pH最小是_________ 。
(3)向50ml 0.018mol‧L-1的AgNO3溶液中加入50m1 0.020mol‧L-1的盐酸生成AgCl沉淀。已知该温度下Ksp(AgCl)=1.0×10﹣10,忽略溶液的体积变化,完全沉淀后,溶液中c(Ag+)=__ mol‧L-1。
(4)用酸性KMnO4溶液滴定含杂质的Na2C2O4样品(杂质不参与反应)。
实验步骤:准确称取1g Na2C2O4固体样品,配制成100mL溶液,取出20.00mL于锥形瓶中。再向锥形瓶中加入足量稀H2SO4溶液,用0.016 mol‧L-1高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL。
(已知:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O)
①高锰酸钾溶液应装在_______ 滴定管中.(填“酸式”或“碱式”)。
②滴定至终点时的实验现象是:__________________________________________ 。
③下列操作可能使测量结果偏高的是__________ 。
A.盛装的Na2C2O4的滴定管没润洗
B.盛装高锰酸钾溶液的滴定管滴定前尖嘴处有气泡,滴定后气泡消失
C.读数时滴定前仰视,滴定后俯视
D.锥形瓶中残留少量水
④计算样品中Na2C2O4的纯度______________ 。
(1)25℃时,0.1 mol‧L-1的一元酸HA溶液中c(H+)=1.0×10-4 mol‧L-1,请回答下列问题:此时溶液的pH=
(2)现有NaHCO3、NaHSO3、NaHSO4三种常见的酸式盐,它们在工业生产和日常生活中有着广泛的应用。请回答有关问题:
①25℃时,NaHCO3的水溶液显
②25℃时,物质的量浓度均为0.01 mol‧L-1的三种酸式盐溶液,pH最小是
(3)向50ml 0.018mol‧L-1的AgNO3溶液中加入50m1 0.020mol‧L-1的盐酸生成AgCl沉淀。已知该温度下Ksp(AgCl)=1.0×10﹣10,忽略溶液的体积变化,完全沉淀后,溶液中c(Ag+)=
(4)用酸性KMnO4溶液滴定含杂质的Na2C2O4样品(杂质不参与反应)。
实验步骤:准确称取1g Na2C2O4固体样品,配制成100mL溶液,取出20.00mL于锥形瓶中。再向锥形瓶中加入足量稀H2SO4溶液,用0.016 mol‧L-1高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL。
(已知:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O)
①高锰酸钾溶液应装在
②滴定至终点时的实验现象是:
③下列操作可能使测量结果偏高的是
A.盛装的Na2C2O4的滴定管没润洗
B.盛装高锰酸钾溶液的滴定管滴定前尖嘴处有气泡,滴定后气泡消失
C.读数时滴定前仰视,滴定后俯视
D.锥形瓶中残留少量水
④计算样品中Na2C2O4的纯度
您最近一年使用:0次
3 . 关于下列四个图象的说法中不正确 的是


A.图①可表示可逆反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0 CO2(g)+H2(g) ΔH<0 |
| B.图②表示用惰性电极电解足量氯化钠溶液时,两极产生的气体物质的量相等 |
C.图③可表示可逆反应:A2(g)+3B2(g) 2AB3(g) ΔH>0 2AB3(g) ΔH>0 |
D.图④可表示压强对可逆反应:2A(g)+B(g) 3C(g)+D(s)的影响,且乙压强大 3C(g)+D(s)的影响,且乙压强大 |
您最近一年使用:0次
名校
4 . 判断正误
(1)明矾和高铁酸钠(Na2FeO4)都可用于水的消毒净化。___
(2)硫酸钡和碳酸钡都难溶于水,故都可用于钡餐透视。___
(3)液氨是纯净物,氨常用作制冷剂,是因为其沸点较高,很容易液化;氨水呈碱性,是因为氨溶于水生成一水合氨电离产生OH-,使溶液中c(OH-)>c(H+),故溶液呈碱性,同时也抑制了水的电离。___
(4)硅的提纯与应用,促进了半导体元件与集成芯片的发展,可以说“硅是信息技术革命的催化剂”; 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遭遇强碱会“断路”;SiCl4在战争中常用作烟雾弹,是因为它水解时生成白色烟雾。____
(5)在硫酸亚铁铵的制备实验中,为了得到硫酸亚铁铵晶体,应小火加热蒸发皿,直到有大量晶体析出时停止加热。____
(6)通电时,溶液中溶质离子分别向两极移动,胶体中胶粒向某一极移动。____
(7)可用稀盐酸、碳酸钠溶液、硅酸钠溶液设计实验来验证氯、碳、硅三种元素的非金属性。_____
(8)同主族元素的简单阴离子还原性越强,水解程度越大。___
(9)已知次磷酸(H3PO2)是一元弱(中强)酸,且Ka(H3PO2)>Kb(NH3.H2O)。则NH4H2PO2是正盐,且其水溶液呈酸性。____
(10)Al2O3在工业上用于制作耐高温材料,也用于电解法冶炼铝;工业上也常用电解钠、镁的氧化物来制备相应的金属单质。____
(1)明矾和高铁酸钠(Na2FeO4)都可用于水的消毒净化。
(2)硫酸钡和碳酸钡都难溶于水,故都可用于钡餐透视。
(3)液氨是纯净物,氨常用作制冷剂,是因为其沸点较高,很容易液化;氨水呈碱性,是因为氨溶于水生成一水合氨电离产生OH-,使溶液中c(OH-)>c(H+),故溶液呈碱性,同时也抑制了水的电离。
(4)硅的提纯与应用,促进了半导体元件与集成芯片的发展,可以说“硅是信息技术革命的催化剂”; 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遭遇强碱会“断路”;SiCl4在战争中常用作烟雾弹,是因为它水解时生成白色烟雾。
(5)在硫酸亚铁铵的制备实验中,为了得到硫酸亚铁铵晶体,应小火加热蒸发皿,直到有大量晶体析出时停止加热。
(6)通电时,溶液中溶质离子分别向两极移动,胶体中胶粒向某一极移动。
(7)可用稀盐酸、碳酸钠溶液、硅酸钠溶液设计实验来验证氯、碳、硅三种元素的非金属性。
(8)同主族元素的简单阴离子还原性越强,水解程度越大。
(9)已知次磷酸(H3PO2)是一元弱(中强)酸,且Ka(H3PO2)>Kb(NH3.H2O)。则NH4H2PO2是正盐,且其水溶液呈酸性。
(10)Al2O3在工业上用于制作耐高温材料,也用于电解法冶炼铝;工业上也常用电解钠、镁的氧化物来制备相应的金属单质。
您最近一年使用:0次
2018-01-21更新
|
90次组卷
|
2卷引用:贵州省思南中学2017-2018学年高二上学期期末考试化学试题
名校
解题方法
5 . (I)LiH可作飞船的燃料,已知下列反应:
①2Li(s)+H2(g)===2LiH(s) ΔH=-182 kJ·mol-1;
②2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1;
③4Li(s)+O2(g)===2Li2O(s) ΔH=-1196 kJ·mol-1。
试写出LiH在O2中燃烧的热化学方程式:__________________________________________ 。
(II)利用H2和CO2生产甲醇。某温度下,在容积为2L的密闭容器中充入1molCO2和3.25mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示。

(1)从反应开始到3min时,氢气的平均反应速率v(H2)=____________ 。
(2)下列措施中一定能使CO2的转化率增大的是_______________ (填序号)。
A.在原容器中再充入1mol CO2 B.在原容器中再充入1mol H2
C.在原容器中再充入1mol He D.使用更有效的催化剂
E. 缩小容器的容积 F. 将水蒸气从体系中分离出
(III)图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。

(1)甲中负极的电极反应式为_______________________________ 。
(2)乙中A极析出的气体在标准状况下的体积为_______________________ 。
(IV)已知常温下CN-的水解常数Kb=1.61×10-5。
(1)常温下,含等物质的量浓度的HCN与NaCN的混合溶液显_________ (填“酸”“碱”或“中”)性,c(CN-)_______ (填“>”“<”或“=”)c(HCN)。
(2)常温下,若将c mol•L-1盐酸与0.61 mol•L-1KCN溶液等体积混合后恰好得到中性溶液,则c=________ (小数点后保留4位数字)。
①2Li(s)+H2(g)===2LiH(s) ΔH=-182 kJ·mol-1;
②2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1;
③4Li(s)+O2(g)===2Li2O(s) ΔH=-1196 kJ·mol-1。
试写出LiH在O2中燃烧的热化学方程式:
(II)利用H2和CO2生产甲醇。某温度下,在容积为2L的密闭容器中充入1molCO2和3.25mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示。

(1)从反应开始到3min时,氢气的平均反应速率v(H2)=
(2)下列措施中一定能使CO2的转化率增大的是
A.在原容器中再充入1mol CO2 B.在原容器中再充入1mol H2
C.在原容器中再充入1mol He D.使用更有效的催化剂
E. 缩小容器的容积 F. 将水蒸气从体系中分离出
(III)图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。

(1)甲中负极的电极反应式为
(2)乙中A极析出的气体在标准状况下的体积为
(IV)已知常温下CN-的水解常数Kb=1.61×10-5。
(1)常温下,含等物质的量浓度的HCN与NaCN的混合溶液显
(2)常温下,若将c mol•L-1盐酸与0.61 mol•L-1KCN溶液等体积混合后恰好得到中性溶液,则c=
您最近一年使用:0次
名校
6 . 工业制备硫酸过程中存在如下反应: 2SO2+O2 2SO3,下列关于该反应的说法正确的是
2SO3,下列关于该反应的说法正确的是
 2SO3,下列关于该反应的说法正确的是
2SO3,下列关于该反应的说法正确的是| A.使用催化剂不影响反应速率 | B.降低体系温度能加快反应速率 |
| C.增大O2的浓度能加快反应速率 | D.一定条件下SO2能100%转化为SO3 |
您最近一年使用:0次
2017-11-29更新
|
350次组卷
|
8卷引用:2015-2016学年贵州省习水一中高一下学期期中考试化学试卷
名校
7 . 化学用语表示下列过程
(1)NaHSO4在熔融状态下的电离:___________ 。
(2)已知:C(s) + O2(g) CO2(g) ∆H1=a kJ/mol
CO2(g) ∆H1=a kJ/mol
2CO(g) + O2(g) 2CO2(g) ∆H2=b kJ/mol
2CO2(g) ∆H2=b kJ/mol
写出C(s) 和O2(g) 转化为CO(g) 的热化学方程式:______ 。
已知25 ℃时,两种弱酸的电离平衡常数HCN:Ka=4.9×10-10,H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11,向NaCN溶液中通入少量CO2反应的离子方程式:__________ 。
(1)NaHSO4在熔融状态下的电离:
(2)已知:C(s) + O2(g)
 CO2(g) ∆H1=a kJ/mol
CO2(g) ∆H1=a kJ/mol2CO(g) + O2(g)
 2CO2(g) ∆H2=b kJ/mol
2CO2(g) ∆H2=b kJ/mol写出C(s) 和O2(g) 转化为CO(g) 的热化学方程式:
已知25 ℃时,两种弱酸的电离平衡常数HCN:Ka=4.9×10-10,H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11,向NaCN溶液中通入少量CO2反应的离子方程式:
您最近一年使用:0次
名校
解题方法
8 . 化学反应原理对学习化学有重要的指导作用。某学习小组特邀你参与下列探究:
(1)影响化学平衡移动因素的探究:在NH4Cl 溶液中存在如下平衡:NH4Cl + H2O NH3.H2O + HCl,某同学以此为例探究外界条件对化学平衡的影响,实验结果记录如下:
NH3.H2O + HCl,某同学以此为例探究外界条件对化学平衡的影响,实验结果记录如下:
①写出该反应的平衡常数表达式:____________________________ 。
②有同学认为,上表中在“条件改变”一栏除列举的4种之外,还添加一种就更为完美,你认为最好添加哪一种“改变条件”?_____________ ;
③“学习之道在于悟”,结合NH4Cl与水反应的方程式和影响平衡移动的因素分析:加水稀释对上述平衡的影响类似于_____________ 。
A.使用催化剂对化学平衡的影响; B.减小生成物浓度对化学平衡的影响;
C.升高温度对化学平衡的影响; D.减小压强对化学平衡的影响
(2)复分解反应进行的方向的探究
【提出问题】为什么只要有难溶物质、弱电解质、易挥发的物质生成复分解反应型离子反应就可以发生?
【分析解决问题】小组同学进一步深入思考,发现上述问题其实质是化学反应进行的方向问题。请你结合化学反应原理的相关知识对上述问题作出合理解释:生成难溶物质、弱电解质、易挥发的物质时将会导致体系的_______________ 或者__________________ 。
(3)反应条件(介质环境)的探究
已知I- 能被O2氧化生成I2,为探究反应条件(介质环境)设计了如下方案:
①上述实验证明,该实验不能选择在中性或者碱性条件下进行,为什么?_____________ ;
②写出第三组实验中发生反应的离子方程式_____________ ;
(1)影响化学平衡移动因素的探究:在NH4Cl 溶液中存在如下平衡:NH4Cl + H2O
 NH3.H2O + HCl,某同学以此为例探究外界条件对化学平衡的影响,实验结果记录如下:
NH3.H2O + HCl,某同学以此为例探究外界条件对化学平衡的影响,实验结果记录如下:| 改变条件 | 适当升高温度 | 加水稀释 | 通入HCl(g) | 加少量NaOH固体 |
| 平衡移动方向 | 无需填写 | 正向 | 逆向 | 正向 |
①写出该反应的平衡常数表达式:
②有同学认为,上表中在“条件改变”一栏除列举的4种之外,还添加一种就更为完美,你认为最好添加哪一种“改变条件”?
③“学习之道在于悟”,结合NH4Cl与水反应的方程式和影响平衡移动的因素分析:加水稀释对上述平衡的影响类似于
A.使用催化剂对化学平衡的影响; B.减小生成物浓度对化学平衡的影响;
C.升高温度对化学平衡的影响; D.减小压强对化学平衡的影响
(2)复分解反应进行的方向的探究
【提出问题】为什么只要有难溶物质、弱电解质、易挥发的物质生成复分解反应型离子反应就可以发生?
【分析解决问题】小组同学进一步深入思考,发现上述问题其实质是化学反应进行的方向问题。请你结合化学反应原理的相关知识对上述问题作出合理解释:生成难溶物质、弱电解质、易挥发的物质时将会导致体系的
(3)反应条件(介质环境)的探究
已知I- 能被O2氧化生成I2,为探究反应条件(介质环境)设计了如下方案:
| 操作 | 现象 | |
| 第一组 | 向2mL1mol/LKI溶液中滴加几滴淀粉溶液 | 未出现蓝色 |
| 第二组 | 向2mL1mol/LKI溶液中滴加2mL1mol/LNaOH溶液再滴加几滴淀粉溶液 | 未出现蓝色 |
| 第三组 | 向2mL1mol/LKI溶液中滴加2mL1mol/LH2SO4溶液再滴加几滴淀粉溶液 | 溶液变蓝 |
①上述实验证明,该实验不能选择在中性或者碱性条件下进行,为什么?
②写出第三组实验中发生反应的离子方程式
您最近一年使用:0次
名校
9 . 等体积的氯化钠、氯化镁、氯化铝溶液可以使等体积、等物质的量浓度的硝
酸银溶液中的银离子完全沉淀,则此三种溶液的物质的量浓度之比为
酸银溶液中的银离子完全沉淀,则此三种溶液的物质的量浓度之比为
| A.1:2:3 | B.3:2:1 | C.1:1:1 | D.6:3:2 |
您最近一年使用:0次
名校
10 . 一篇名为《最终我坐着轮椅被推出了首都国际机场》的文章在网络上引发超过10万次点击。文中女留学在国外吸食笑气导致身体机能全面紊乱,坐轮椅回国。笑气成分是N2O,可作奶油发泡剂,但长期或大剂量滥用会导致神经及脊髓病变。一定条件下,N2O分解的部分实验数据如下表:
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
下图能正确表示该反应有关物理量变化规律的是
| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| c(N2O)/mol/L | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
下图能正确表示该反应有关物理量变化规律的是
A.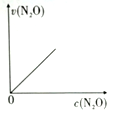 | B.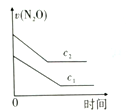 | C. | D.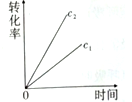 |
您最近一年使用:0次
2017-10-23更新
|
578次组卷
|
4卷引用:贵州省贵阳市第一中学2018届高三上学期适应性月考(二)理科综合化学试题
贵州省贵阳市第一中学2018届高三上学期适应性月考(二)理科综合化学试题河北省衡水市深州市中学2020届高三第一次月考化学试题湖南省长沙市雅礼中学2021届高三上学期第二次月考化学试题(已下线)第22讲 化学反应速率(精练)-2021年高考化学一轮复习讲练测



