名校
解题方法
1 . 下列说法中正确的是
A.若 2NO2(g) N2O4(g) ∆H =+56.9kJ·mol-1 ,则 N2O4(g) ∆H =+56.9kJ·mol-1 ,则 置于密闭容器中充分反应吸收的热量为56.9kJ 置于密闭容器中充分反应吸收的热量为56.9kJ |
B.表示中和热的热化学方程式: |
| C.在稀溶液中,强酸与强碱反应的中和热为ΔH=-57.3kJ·mol-1,若将含有0.5mol H2SO4的浓硫酸和含有1molNaOH的溶液混合,放出的热量大于57.3kJ |
| D.H2(g)的燃烧热是285.8kJ·mol-1,则2H2O(g)=2H2(g)+O2(g) ∆H =+571.6kJ·mol-1 |
您最近一年使用:0次
2022-11-02更新
|
167次组卷
|
2卷引用:江西省鄱阳县第一中学2023届高三一模化学试题
2 . 下列相关热化学方程式的说法正确的是
| A.甲烷的燃烧热是ΔH=-890kJ•mol-1,则表示甲烷燃烧热的热化学方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890kJ•mol-1 |
| B.浓硫酸的稀释是放热反应 |
| C.已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ•mol-1,则任何酸碱中和反应的热效应均为57.3kJ |
| D.已知C(s)+O2(g)=CO2(g) ΔH1,2C(s)+O2(g)=2CO(g) ΔH2,则2ΔH1<ΔH2 |
您最近一年使用:0次
2022-10-30更新
|
131次组卷
|
2卷引用:江西省南昌市第二中学2022-2023学年高二上学期第二次月考化学试题
名校
解题方法
3 . 下列说法或表示方法正确的是
A.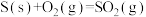 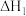 ; ;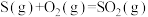 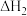 , ,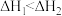 |
B.已知相同质量白磷的能量比红磷高,则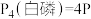 (红磷), (红磷),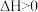 |
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为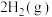  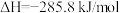 |
D.在稀溶液中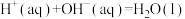  ,若将含1molH2SO4与含2mol NaOH的稀溶液混合,放出的热量等于114.6kJ ,若将含1molH2SO4与含2mol NaOH的稀溶液混合,放出的热量等于114.6kJ |
您最近一年使用:0次
名校
解题方法
4 . 已知充分燃烧a g乙炔气体时生成2mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是
A.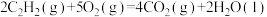  |
B.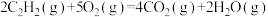  |
C. 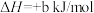 |
D. 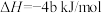 |
您最近一年使用:0次
2022-10-14更新
|
351次组卷
|
8卷引用:江西省南昌市知行中学2021-2022学年高二上学期期中化学试题
江西省南昌市知行中学2021-2022学年高二上学期期中化学试题江西省宜春市丰城市2022-2023学年高二上学期1月期末化学试题湖南省长沙市湖南师范大学附属中学2019-2020学年高二上学期期中考试化学试题(已下线)第01章 化学反应与能量转化(A卷基础强化篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材鲁科版)山东省滕州市第一中学2020-2021学年高二一部9月小测试化学试题山东省德州市夏津县第一中学2020-2021学年高二上学期第一次月考(10月)化学试题甘肃省镇原县第二中学2021-2022学年高二上学期第一次月考化学试题山东省实验中学2022-2023学年高二上学期10月月考化学试题
名校
解题方法
5 . 航天飞船可用肼(N2H4)和过氧化氢(H2O2)为动力源,已知1 g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05 kJ的热量。下列说法中错误的是
| A.该反应中肼作氧化剂 |
| B.液态肼的燃烧热ΔH为-641.6 kJ·mol-1 |
| C.该动力源的突出优点之一是生成物对环境污染小 |
| D.肼和过氧化氢反应的热化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-641.6 kJ·mol-1 |
您最近一年使用:0次
解题方法
6 . 下列能正确地表示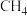 燃烧热的热化学方程式是
燃烧热的热化学方程式是
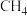 燃烧热的热化学方程式是
燃烧热的热化学方程式是A.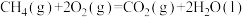 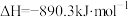 |
B.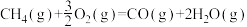 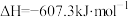 |
C.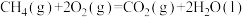 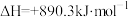 |
D.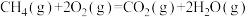 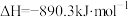 |
您最近一年使用:0次
名校
7 . 化学反应伴随能量变化。下列相关描述正确的是
| A.放热过程(△H<0)或熵增加(△S>0)的过程一定是自发的 |
| B.甲烷的标准燃烧热为890.3kJ·mol-1,则甲烷燃烧热的热化学方程式表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ·mol-1 |
C.已知N2(g)+3H2(g) 2NH3(g)△H=-92.2kJ·mol-1,在密闭容器中,过量的N2与3molH2反应时放出的能量小于92.2kJ 2NH3(g)△H=-92.2kJ·mol-1,在密闭容器中,过量的N2与3molH2反应时放出的能量小于92.2kJ |
| D.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
您最近一年使用:0次
2022-10-08更新
|
327次组卷
|
4卷引用:江西省宜春市上高二中2022-2023学年高二上学期第二次月考(期中) 化学试题
名校
8 . I.已知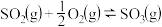 反应过程的能量变化如图所示:
反应过程的能量变化如图所示:
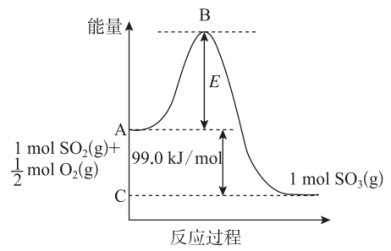
(1)图中C点表示_______ ,E所代表的能量是_______ ,E的大小对该反应的反应热_______ (填“有”或“无”)影响。
(2)请求出反应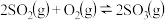

_______ 。
(3)又知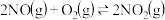
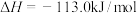 ,请根据题给条件求出反应
,请根据题给条件求出反应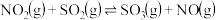 的焓变
的焓变
_______ 。
II.
(4)0.5mol (g)在
(g)在 中完全燃烧生成
中完全燃烧生成 和液态水,放出649.8kJ的热量,写出燃烧热的热反应方程式
和液态水,放出649.8kJ的热量,写出燃烧热的热反应方程式_______ 。
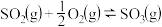 反应过程的能量变化如图所示:
反应过程的能量变化如图所示:
(1)图中C点表示
(2)请求出反应
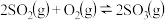

(3)又知
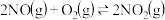
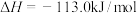 ,请根据题给条件求出反应
,请根据题给条件求出反应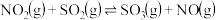 的焓变
的焓变
II.
(4)0.5mol
 (g)在
(g)在 中完全燃烧生成
中完全燃烧生成 和液态水,放出649.8kJ的热量,写出燃烧热的热反应方程式
和液态水,放出649.8kJ的热量,写出燃烧热的热反应方程式
您最近一年使用:0次
名校
9 . 下列热化学方程式中,正确的是
A.甲烷的摩尔燃烧焓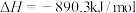 ,则甲烷燃烧的热化学方程式可表示为: ,则甲烷燃烧的热化学方程式可表示为: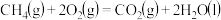 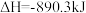 |
B.若31g白磷的能量比31g红磷多bkJ,则白磷转化为红磷的热化学方程式为 (白磷,s)=4P(红磷,s) (白磷,s)=4P(红磷,s)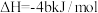 |
C.在101kPa时,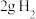 完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为: 完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为: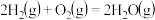 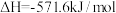 |
D.HCl和NaOH反应的中和热 ,则 ,则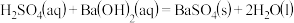 的反应热 的反应热 |
您最近一年使用:0次
2022-09-07更新
|
273次组卷
|
2卷引用:江西省南昌十九中2022-2023学年高二上学期第一次月考化学试卷
10 . 氢气是最清洁的能源,已知H-H键能为a kJ·mol-1,O=O键能为b kJ·mol-1,H-O键能为c kJ·mol-1,对于反应2H2(g)+O2(g) = 2H2O(g) 说法正确的是
| A.生成2 mol气态水释放的能量为(2a+b-2c) kJ | B.氢气的燃烧热的值与该反应的焓变相等 |
| C.该反应的ΔH=-(4c-2a-b)kJ·mol-1 | D.若燃烧生成液态水,释放的能量将会变少 |
您最近一年使用:0次
2022-09-05更新
|
354次组卷
|
3卷引用:江西省抚州市南城县第二中学2022-2023学年高二上学期第一次月考化学试题



