名校
1 . I.50mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
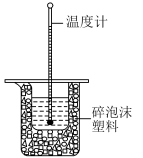
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________ 。
(2)实验中改用60mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量_______ (填“相等”、“不相等”),所求中和热______ 。(填“相等”、“不相等”)
(3)化学反应中的能量变化,通常主要表现为热量的变化。下列反应中,属于放热反应的是_____ (填序号)。
a.Ba(OH)2·8H2O与NH4Cl混合搅拌 b.高温煅烧石灰石 c.铝与盐酸反应
(4)已知N2(g)+2O2(g)=2 NO2(g) ΔH =+67.7 kJ·mol-1
N2H4(g)+O2(g)= N2(g)+2H2O (l) ΔH =-534 kJ·mol-1
根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式___________ 。
Ⅱ.CO、SO2、NO均为大气污染物,通过下列反应可以实现可持续发展。已知:
①2CO(g)+SO2(g)=S(g)+2CO2(g) ΔH=+8.0kJ/mol-1
②2H2(g)+SO2(g)=S(g)+2H2O(g) ΔH=+90.4kJ·mol -1
③2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-746.5kJ·mol -1
请回答:
(5)反应①属于______  填“吸热”或“放热”
填“吸热”或“放热” 反应。
反应。
(6)反应②生成0.5mol S(g)时,ΔH=________ 。
(7)反应③消耗30g NO(g)时,ΔH=________ 。

(1)从实验装置上看,图中尚缺少的一种玻璃用品是
(2)实验中改用60mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量
(3)化学反应中的能量变化,通常主要表现为热量的变化。下列反应中,属于放热反应的是
a.Ba(OH)2·8H2O与NH4Cl混合搅拌 b.高温煅烧石灰石 c.铝与盐酸反应
(4)已知N2(g)+2O2(g)=2 NO2(g) ΔH =+67.7 kJ·mol-1
N2H4(g)+O2(g)= N2(g)+2H2O (l) ΔH =-534 kJ·mol-1
根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式
Ⅱ.CO、SO2、NO均为大气污染物,通过下列反应可以实现可持续发展。已知:
①2CO(g)+SO2(g)=S(g)+2CO2(g) ΔH=+8.0kJ/mol-1
②2H2(g)+SO2(g)=S(g)+2H2O(g) ΔH=+90.4kJ·mol -1
③2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-746.5kJ·mol -1
请回答:
(5)反应①属于
 填“吸热”或“放热”
填“吸热”或“放热” 反应。
反应。(6)反应②生成0.5mol S(g)时,ΔH=
(7)反应③消耗30g NO(g)时,ΔH=
您最近一年使用:0次
2024-02-02更新
|
107次组卷
|
2卷引用:四川省泸州市泸县第一中学2023-2024学年高二上学期1月期末化学试题
名校
2 . 下列有关热化学方程式书写与对应表述均正确的是
A.稀硫酸与 溶液反应: 溶液反应: |
B.在 下 下 的燃烧热 的燃烧热 ,则水分解的热化学方程式为 ,则水分解的热化学方程式为 |
C.已知 的燃烧热 的燃烧热 则有 则有 |
D.已知 硫粉与 硫粉与 铁粉混合充分加热反应放出 铁粉混合充分加热反应放出 热量,则 热量,则 |
您最近一年使用:0次
2023-12-14更新
|
104次组卷
|
2卷引用:四川省泸州市泸县第四中学2023-2024学年高二上学期1月期末化学试题
3 . 化学燃料是现阶段火箭的主要动力来源,从能量密度(单位质量的燃料提供的能量)角度考虑,最适合做火箭推进剂的是
A.液氧-液态甲烷(甲烷燃烧热为893 ) ) |
B.液氧-液氢(氢气燃烧热为286 ) ) |
C.液氧-煤油(煤油热值为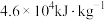 ) ) |
D.液氧-液氨(氨气燃烧热为316 ) ) |
您最近一年使用:0次
2023-11-28更新
|
94次组卷
|
4卷引用:四川省泸县第一中学2023-2024学年高二上学期12月月考化学试题
名校
解题方法
4 . 已知:
①
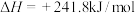
②
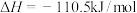
③
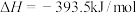
下列说法错误的是
①

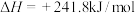
②

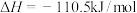
③

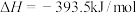
下列说法错误的是
| A.上述反应属于吸热反应的是① |
| B.表示C的燃烧热的热化学方程式是③ |
C.10g 完全燃烧生成水蒸气,放热2418kJ 完全燃烧生成水蒸气,放热2418kJ |
D.CO燃烧的热化学方程式为  |
您最近一年使用:0次
2023-11-14更新
|
147次组卷
|
5卷引用:四川省泸县第一中学2023-2024学年高二上学期12月月考化学试题
名校
解题方法
5 . 完成下列问题
(1)煤油的主要成分为C12H26,已知34g C12H26完全燃烧生成气态水时放出1386.2kJ热量;
 。则表示煤油燃烧热的热化学方程式为
。则表示煤油燃烧热的热化学方程式为___________ 。
(2)已知甲烷能催化还原NO2,得到氮气、二氧化碳和水蒸气,且知反应消耗1.6 g甲烷时,放出热量86.7 kJ,写出甲烷催化还原NO2的热化学方程式___________ 。
(3)已知:N2(g)+O2(g) 2NO(g) ΔH1=+180.5kJ•mol﹣1
2NO(g) ΔH1=+180.5kJ•mol﹣1
C(s)+O2(g) CO2(g) ΔH2=﹣393.5kJ•mol﹣1
CO2(g) ΔH2=﹣393.5kJ•mol﹣1
2C(s)+O2(g) 2CO(g) ΔH3=﹣221.0kJ•mol﹣1
2CO(g) ΔH3=﹣221.0kJ•mol﹣1
请写出NO和CO生成N2和CO2的热化学方程式___________ 。
(4)利用如图所示装置测定中和热的实验步骤如下,回答下列问题:

步骤一:用量筒量取100mL 0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
步骤二:用另一量筒量取100mL 0.55mol·L-1 NaOH溶液,并用同一温度计测出其温度;
步骤三:将NaOH和盐酸溶液一并倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
①仪器a的名称是___________ 。
②配制100mL 0.55mol/L的氢氧化钠溶液,需要用到的仪器有托盘天平(附砝码)、烧杯、药匙、镊子、玻璃棒、量筒、胶头滴管以及___________ 。
③倒入NaOH和盐酸溶液的正确操作是___________ (填字母)。
A.沿玻璃棒缓慢倒入 B.分三次倒入
C.一次迅速倒入 D.一边搅拌一边滴入
④假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:依据该学生的实验数据计算,该实验测得的中和热ΔH=___________ (结果保留一位小数)。
⑤该同学通过实验测出的中和热有误差,造成这一结果的原因不可能的是 ___________ 。
A.实验装置保温、隔热效果差
B.用量筒量取盐酸时仰视读数
C.分多次将NaOH溶液倒入小烧杯中
D.用测量盐酸的温度计直接测定NaOH溶液的温度
(1)煤油的主要成分为C12H26,已知34g C12H26完全燃烧生成气态水时放出1386.2kJ热量;

 。则表示煤油燃烧热的热化学方程式为
。则表示煤油燃烧热的热化学方程式为(2)已知甲烷能催化还原NO2,得到氮气、二氧化碳和水蒸气,且知反应消耗1.6 g甲烷时,放出热量86.7 kJ,写出甲烷催化还原NO2的热化学方程式
(3)已知:N2(g)+O2(g)
 2NO(g) ΔH1=+180.5kJ•mol﹣1
2NO(g) ΔH1=+180.5kJ•mol﹣1C(s)+O2(g)
 CO2(g) ΔH2=﹣393.5kJ•mol﹣1
CO2(g) ΔH2=﹣393.5kJ•mol﹣12C(s)+O2(g)
 2CO(g) ΔH3=﹣221.0kJ•mol﹣1
2CO(g) ΔH3=﹣221.0kJ•mol﹣1请写出NO和CO生成N2和CO2的热化学方程式
(4)利用如图所示装置测定中和热的实验步骤如下,回答下列问题:

步骤一:用量筒量取100mL 0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
步骤二:用另一量筒量取100mL 0.55mol·L-1 NaOH溶液,并用同一温度计测出其温度;
步骤三:将NaOH和盐酸溶液一并倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
①仪器a的名称是
②配制100mL 0.55mol/L的氢氧化钠溶液,需要用到的仪器有托盘天平(附砝码)、烧杯、药匙、镊子、玻璃棒、量筒、胶头滴管以及
③倒入NaOH和盐酸溶液的正确操作是
A.沿玻璃棒缓慢倒入 B.分三次倒入
C.一次迅速倒入 D.一边搅拌一边滴入
④假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:依据该学生的实验数据计算,该实验测得的中和热ΔH=
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.2 | 23.3 |
| 2 | 20.2 | 20.4 | 23.5 |
| 3 | 20.3 | 20.5 | 25.6 |
A.实验装置保温、隔热效果差
B.用量筒量取盐酸时仰视读数
C.分多次将NaOH溶液倒入小烧杯中
D.用测量盐酸的温度计直接测定NaOH溶液的温度
您最近一年使用:0次
2023-10-30更新
|
156次组卷
|
3卷引用:四川省泸州市四川省泸县第五中学2023-2024学年高二上学期1月期末化学试题
名校
解题方法
6 . 回答下列问题。
(1)用NH3可以消除氮氧化物的污染,已知:
反应Ⅰ:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔH1=a kJ·mol-1
2N2(g)+6H2O(g) ΔH1=a kJ·mol-1
反应Ⅱ:N2(g)+O2(g) 2NO(g) ΔH2=b kJ·mol-1
2NO(g) ΔH2=b kJ·mol-1
反应Ⅲ:4NH3(g)+6NO(g) 5N2(g)+6H2O(g) ΔH3=c kJ·mol-1
5N2(g)+6H2O(g) ΔH3=c kJ·mol-1
则反应Ⅱ中的b=___________ (用含a、c的代数式表示),反应Ⅲ中的ΔS___________ (填“>”“<”或“=”)0。
(2)已知:①2CO(g)+SO2(g) S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1
S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1
②2H2(g)+SO2(g) S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1
S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1
③CO的燃烧热ΔH3=-283 kJ·mol-1,
请回答:
表示液态硫(S)的燃烧热的热化学方程式为___________ ;反应②中,正反应活化能E1___________ (填“>”“<”或“=”)ΔH2。
(3)若某温度下,CH3COOH(aq)与NaOH(aq)反应的ΔH=-46.8 kJ·mol-1,H2SO4(aq)与NaOH(aq)的中和热为57.3 kJ·mol-1,则CH3COOH在水溶液中电离的反应热ΔH1=___________ 。
(4)已知:
则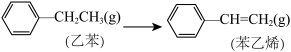 +H2(g) ΔH=
+H2(g) ΔH=___________ ;又知H2和苯乙烯的燃烧热ΔH分别为-290 kJ·mol-1和-4400 kJ·mol-1,则乙苯的燃烧热ΔH=___________ kJ·mol-1。
(1)用NH3可以消除氮氧化物的污染,已知:
反应Ⅰ:4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) ΔH1=a kJ·mol-1
2N2(g)+6H2O(g) ΔH1=a kJ·mol-1反应Ⅱ:N2(g)+O2(g)
 2NO(g) ΔH2=b kJ·mol-1
2NO(g) ΔH2=b kJ·mol-1反应Ⅲ:4NH3(g)+6NO(g)
 5N2(g)+6H2O(g) ΔH3=c kJ·mol-1
5N2(g)+6H2O(g) ΔH3=c kJ·mol-1则反应Ⅱ中的b=
(2)已知:①2CO(g)+SO2(g)
 S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1
S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1②2H2(g)+SO2(g)
 S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1
S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1③CO的燃烧热ΔH3=-283 kJ·mol-1,
请回答:
表示液态硫(S)的燃烧热的热化学方程式为
(3)若某温度下,CH3COOH(aq)与NaOH(aq)反应的ΔH=-46.8 kJ·mol-1,H2SO4(aq)与NaOH(aq)的中和热为57.3 kJ·mol-1,则CH3COOH在水溶液中电离的反应热ΔH1=
(4)已知:
| 化学键 | C—H | C—C | C=C | H—H |
| 键能/(kJ·mol-1) | 412 | 348 | 612 | 436 |
 +H2(g) ΔH=
+H2(g) ΔH=
您最近一年使用:0次
7 . 深刻理解概念的含义是学习的重要内容。下列有关概念的说法中正确的是
| A.焓是物理量反应热的单位 | B.物质燃烧放出的热量就是燃烧热 |
| C.煤的气化就是煤从固态变成气态 | D.分馏是利用组分沸点不同分离的过程 |
您最近一年使用:0次
8 . 完全燃烧5.6L标准状况下的 ,冷却至室温放出222.4kJ热量,下列热化学方程式正确的是
,冷却至室温放出222.4kJ热量,下列热化学方程式正确的是
 ,冷却至室温放出222.4kJ热量,下列热化学方程式正确的是
,冷却至室温放出222.4kJ热量,下列热化学方程式正确的是A.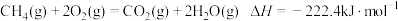 |
B.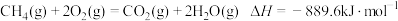 |
C.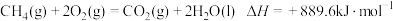 |
D. |
您最近一年使用:0次
名校
9 . 已知反应:①101kPa时,
 ;②稀溶液中,H+(aq)+OH-(aq)=H2O(l)
;②稀溶液中,H+(aq)+OH-(aq)=H2O(l)  ;下列结论正确的是
;下列结论正确的是

 ;②稀溶液中,H+(aq)+OH-(aq)=H2O(l)
;②稀溶液中,H+(aq)+OH-(aq)=H2O(l)  ;下列结论正确的是
;下列结论正确的是A.碳的燃烧热的数值大于 |
B.①的反应热为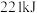 |
C.浓硫酸与稀 溶液反应生成 溶液反应生成 水,放出 水,放出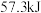 热量 热量 |
D.稀醋酸与稀 溶液反应生成 溶液反应生成 水,放出 水,放出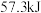 热量 热量 |
您最近一年使用:0次
2022-12-04更新
|
93次组卷
|
2卷引用:四川省泸县第五中学2022-2023学年高二上学期期末考试化学试题
10 . 下列说法或表示法正确的是
| A.H2(g)+Cl2(g)=2HCl(g)要在光照和点燃条件下才反应,所以△H>0,△S<0。 |
| B.由C(s,石墨)=C(s,金刚石);△H=+1.19kJ·mol-1可知,金刚石比石墨稳定 |
| C.在稀溶液中:H+(aq)+OH-(aq)=H2O(1);△H=-57.3kJ·mol-1,若将0.5mol/L的H2SO4溶液1mol/L的NaOH溶液等体积混合,放出的热量等于57.3kJ |
| D.乙醇的燃烧热△H=-1366.8kJ·mol-1,在25℃、101kPa时,92g乙醇充分燃烧后放出2733.6kJ热量 |
您最近一年使用:0次
2022-07-24更新
|
394次组卷
|
4卷引用:四川省泸县第四中学2022-2023学年高二上学期期中考试化学试题



