名校
解题方法
1 . 完成下列问题
(1)煤油的主要成分为C12H26,已知34g C12H26完全燃烧生成气态水时放出1386.2kJ热量;
 。则表示煤油燃烧热的热化学方程式为
。则表示煤油燃烧热的热化学方程式为___________ 。
(2)已知甲烷能催化还原NO2,得到氮气、二氧化碳和水蒸气,且知反应消耗1.6 g甲烷时,放出热量86.7 kJ,写出甲烷催化还原NO2的热化学方程式___________ 。
(3)已知:N2(g)+O2(g) 2NO(g) ΔH1=+180.5kJ•mol﹣1
2NO(g) ΔH1=+180.5kJ•mol﹣1
C(s)+O2(g) CO2(g) ΔH2=﹣393.5kJ•mol﹣1
CO2(g) ΔH2=﹣393.5kJ•mol﹣1
2C(s)+O2(g) 2CO(g) ΔH3=﹣221.0kJ•mol﹣1
2CO(g) ΔH3=﹣221.0kJ•mol﹣1
请写出NO和CO生成N2和CO2的热化学方程式___________ 。
(4)利用如图所示装置测定中和热的实验步骤如下,回答下列问题:

步骤一:用量筒量取100mL 0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
步骤二:用另一量筒量取100mL 0.55mol·L-1 NaOH溶液,并用同一温度计测出其温度;
步骤三:将NaOH和盐酸溶液一并倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
①仪器a的名称是___________ 。
②配制100mL 0.55mol/L的氢氧化钠溶液,需要用到的仪器有托盘天平(附砝码)、烧杯、药匙、镊子、玻璃棒、量筒、胶头滴管以及___________ 。
③倒入NaOH和盐酸溶液的正确操作是___________ (填字母)。
A.沿玻璃棒缓慢倒入 B.分三次倒入
C.一次迅速倒入 D.一边搅拌一边滴入
④假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:依据该学生的实验数据计算,该实验测得的中和热ΔH=___________ (结果保留一位小数)。
⑤该同学通过实验测出的中和热有误差,造成这一结果的原因不可能的是 ___________ 。
A.实验装置保温、隔热效果差
B.用量筒量取盐酸时仰视读数
C.分多次将NaOH溶液倒入小烧杯中
D.用测量盐酸的温度计直接测定NaOH溶液的温度
(1)煤油的主要成分为C12H26,已知34g C12H26完全燃烧生成气态水时放出1386.2kJ热量;

 。则表示煤油燃烧热的热化学方程式为
。则表示煤油燃烧热的热化学方程式为(2)已知甲烷能催化还原NO2,得到氮气、二氧化碳和水蒸气,且知反应消耗1.6 g甲烷时,放出热量86.7 kJ,写出甲烷催化还原NO2的热化学方程式
(3)已知:N2(g)+O2(g)
 2NO(g) ΔH1=+180.5kJ•mol﹣1
2NO(g) ΔH1=+180.5kJ•mol﹣1C(s)+O2(g)
 CO2(g) ΔH2=﹣393.5kJ•mol﹣1
CO2(g) ΔH2=﹣393.5kJ•mol﹣12C(s)+O2(g)
 2CO(g) ΔH3=﹣221.0kJ•mol﹣1
2CO(g) ΔH3=﹣221.0kJ•mol﹣1请写出NO和CO生成N2和CO2的热化学方程式
(4)利用如图所示装置测定中和热的实验步骤如下,回答下列问题:

步骤一:用量筒量取100mL 0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
步骤二:用另一量筒量取100mL 0.55mol·L-1 NaOH溶液,并用同一温度计测出其温度;
步骤三:将NaOH和盐酸溶液一并倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
①仪器a的名称是
②配制100mL 0.55mol/L的氢氧化钠溶液,需要用到的仪器有托盘天平(附砝码)、烧杯、药匙、镊子、玻璃棒、量筒、胶头滴管以及
③倒入NaOH和盐酸溶液的正确操作是
A.沿玻璃棒缓慢倒入 B.分三次倒入
C.一次迅速倒入 D.一边搅拌一边滴入
④假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:依据该学生的实验数据计算,该实验测得的中和热ΔH=
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.2 | 23.3 |
| 2 | 20.2 | 20.4 | 23.5 |
| 3 | 20.3 | 20.5 | 25.6 |
A.实验装置保温、隔热效果差
B.用量筒量取盐酸时仰视读数
C.分多次将NaOH溶液倒入小烧杯中
D.用测量盐酸的温度计直接测定NaOH溶液的温度
您最近一年使用:0次
2023-10-30更新
|
156次组卷
|
3卷引用:四川省内江市第二中学2023-2024学年高二上学期第一次月考化学试题
解题方法
2 . 化学反应中的能量变化通常表现为热量变化,研究热量变化具有重要的意义。化学反应的反应热可通过实验测定,也可通过计算间接获得。
(1)下列变化属于吸热反应的是___________ (填序号)。
①液态水气化 ②胆矾加热变成白色粉末 ③浓硫酸稀释 ④氢气还原氧化铜
⑤碳酸钙高温分解 ⑥氢氧化钾和稀硫酸反应 ⑦灼热的木炭与 的反应
的反应
⑧ 晶体与
晶体与 晶体的反应 ⑨甲烷在空气中燃烧的反应
晶体的反应 ⑨甲烷在空气中燃烧的反应
(2)在25℃、101kPa下,23g乙醇 完全燃烧生成
完全燃烧生成 和液态水时放热638.4kJ,则表示乙醇燃烧热的热化学方程式为
和液态水时放热638.4kJ,则表示乙醇燃烧热的热化学方程式为___________ 。
I.中和反应反应热的实验测定
设计实验测定反应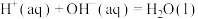 的
的
(3)实验室中盐酸和NaOH溶液已耗尽,请你为该兴趣小组推荐一种酸和一种碱___________ 。
(4)选用合理的试剂,用如图装置进行实验,其中仪器a的名称为___________ 。某次实验测得中和热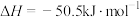 ,与理论值
,与理论值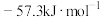 出现较大偏差,产生偏差的原因不可能是
出现较大偏差,产生偏差的原因不可能是___________ (填字母序号)
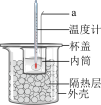
A.实验装置保温、隔热效果差
B.分多次把碱溶液倒入盛有酸的小烧杯中
C.用温度计测定碱溶液起始温度后直接测定酸溶液的温度
D.用量筒量取酸和碱溶液的体积时均仰视读数
II.通过计算间接获得反应热
(5)利用合成气(主要成分为CO、 和
和 )在催化剂作用下合成甲醇,发生的主要反应如下:
)在催化剂作用下合成甲醇,发生的主要反应如下:
①

②

③
 ,
,
已知反应①中相关的化学键键能数据如下:
(已知甲醇与CO的结构式分别如图: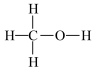
 )
)
由此计算
___________ ;已知 ,则
,则
___________ 。
(1)下列变化属于吸热反应的是
①液态水气化 ②胆矾加热变成白色粉末 ③浓硫酸稀释 ④氢气还原氧化铜
⑤碳酸钙高温分解 ⑥氢氧化钾和稀硫酸反应 ⑦灼热的木炭与
 的反应
的反应⑧
 晶体与
晶体与 晶体的反应 ⑨甲烷在空气中燃烧的反应
晶体的反应 ⑨甲烷在空气中燃烧的反应(2)在25℃、101kPa下,23g乙醇
 完全燃烧生成
完全燃烧生成 和液态水时放热638.4kJ,则表示乙醇燃烧热的热化学方程式为
和液态水时放热638.4kJ,则表示乙醇燃烧热的热化学方程式为I.中和反应反应热的实验测定
设计实验测定反应
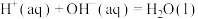 的
的
(3)实验室中盐酸和NaOH溶液已耗尽,请你为该兴趣小组推荐一种酸和一种碱
(4)选用合理的试剂,用如图装置进行实验,其中仪器a的名称为
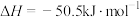 ,与理论值
,与理论值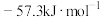 出现较大偏差,产生偏差的原因不可能是
出现较大偏差,产生偏差的原因不可能是
A.实验装置保温、隔热效果差
B.分多次把碱溶液倒入盛有酸的小烧杯中
C.用温度计测定碱溶液起始温度后直接测定酸溶液的温度
D.用量筒量取酸和碱溶液的体积时均仰视读数
II.通过计算间接获得反应热
(5)利用合成气(主要成分为CO、
 和
和 )在催化剂作用下合成甲醇,发生的主要反应如下:
)在催化剂作用下合成甲醇,发生的主要反应如下:①


②


③

 ,
,已知反应①中相关的化学键键能数据如下:
| 化学键 |  |  |  |  |  |
 | 436 | 343 | 1076 | 465 | 413 |

 )
)由此计算

 ,则
,则
您最近一年使用:0次
名校
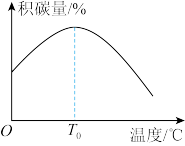
3 . I.作为国之重器,火箭的发射牵动了亿万人民的心。就像汽车、飞机需要添加汽油、航空煤油一样,火箭专用燃料被称为“推进剂”。在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式_______ 。
(2)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是______ 。
II.化学反应常伴随热效应。某些反应(如:中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式Q=cpV总•△T计算获得。某实验小组用0.50mol/LNaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。

(3)仪器a的名称为________ ,实验中除如图所示的仪器外还需要用到的玻璃仪器是_______ 。
(4)取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如表。
①请填写表中的空白:
②近似认为0.50mol/LNaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,反应后生成的溶液的比热容c=4.18J/(g•℃)。则中和热△H=______ (取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是______ (填字母)。
a.实验装置保温、隔热效果差
b.配制0.50mol/LNaOH溶液时俯视刻度线读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定硫酸溶液的温度
e.用量筒量取NaOH溶液的体积时仰视读数
(5)实验中改用30mL0.50mol/L的硫酸跟50mL0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量______ (填“相等”或“不相等”),所求中和热的数值会________ (填“相等”或“不相等”)。
(1)写出该反应的热化学方程式
(2)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是
II.化学反应常伴随热效应。某些反应(如:中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式Q=cpV总•△T计算获得。某实验小组用0.50mol/LNaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。

(3)仪器a的名称为
(4)取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如表。
①请填写表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是
a.实验装置保温、隔热效果差
b.配制0.50mol/LNaOH溶液时俯视刻度线读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定硫酸溶液的温度
e.用量筒量取NaOH溶液的体积时仰视读数
(5)实验中改用30mL0.50mol/L的硫酸跟50mL0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量
您最近一年使用:0次
解题方法
4 . 二甲醚(CH3OCH3)常用作溶剂、冷冻剂、喷雾剂等,易燃烧。 回答下列问题:
(1)25 ℃、101 kPa时,92g气态二甲醚完全燃烧生成CO2(g)、H2O(l)放出 2912 kJ热量,则表示气态二甲醚燃烧 热的热化学方程式为___________ 。当 CH3OCH3(g)完全燃烧生成 CO2(g)、H2O(l)放出 728 kJ热量时,转移的电子数为___________ (用NA 表示阿伏加德罗常数的值)。
(2)已知 H2(g)和CO(g)的燃烧热 △H 分别是
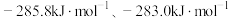
 则反应
则反应
 的反应热△H =
的反应热△H =___________
 。
。
(3)在 2 L 的恒容密闭容器中,充入 6 mol H2 和2 mol CO2合成二甲醚,其反应为
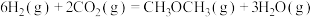 ,在不同温度下,5min时,水蒸气的体积分数如图所示。
,在不同温度下,5min时,水蒸气的体积分数如图所示。
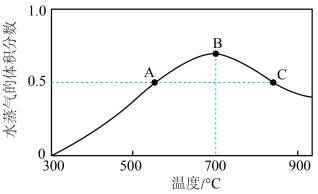
①该反应的 △H=___________ 0(填“>”“<”或“=”)。
②A 点 CO2的逆反应速率___________ (填“>”“<”或“=”)B点 CO2 的逆反应速率;A点对应温度下,0 ~ 5 min 内,平均反应速率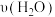 =
=____________ 。
③B点的平衡常数___________ (填“>”“<”或“=”)C点的平衡常数。
(1)25 ℃、101 kPa时,92g气态二甲醚完全燃烧生成CO2(g)、H2O(l)放出 2912 kJ热量,则表示气态二甲醚燃
(2)已知 H2(g)和CO(g)的燃烧热 △H 分别是
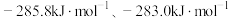
 则反应
则反应 的反应热△H =
的反应热△H = 。
。(3)在 2 L 的恒容密闭容器中,充入 6 mol H2 和2 mol CO2合成二甲醚,其反应为
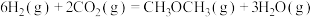 ,在不同温度下,5min时,水蒸气的体积分数如图所示。
,在不同温度下,5min时,水蒸气的体积分数如图所示。
①该反应的 △H=
②A 点 CO2的逆反应速率
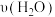 =
=③B点的平衡常数
您最近一年使用:0次
名校
解题方法
5 . 低碳经济成为人们一种新的生活理念,二氧化碳的捕捉和利用是能源领域的一个重要研究方向。结合下列有关图示和所学知识回答:

(1)用 催化加氢可以制取乙烯:
催化加氢可以制取乙烯: 。若该反应体系的能量随反应过程变化关系如上图所示,则该反应属于
。若该反应体系的能量随反应过程变化关系如上图所示,则该反应属于_______ 反应(填“吸热”或“放热”),该反应的
______ (用含a、b的式子表示)。又知:相关化学键的键能如下表所示,实验测得上述反应的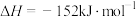 ,则表中的
,则表中的
______ 。
注:乙烯结构如图:
(2)在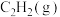 完全燃烧生成
完全燃烧生成 和液态水的反应中,每有5mol电子转移时,放出650kJ的热量,其燃烧热的热化学方程式为
和液态水的反应中,每有5mol电子转移时,放出650kJ的热量,其燃烧热的热化学方程式为_________________________________ 。
(3)工业上用 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知:

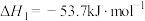 ,
,

 ,
,
则

______  。为提高该反应中
。为提高该反应中 的转化率,可采用的方式有
的转化率,可采用的方式有_______ 。
A加入合适的催化剂 B.升高温度 C.增大 浓度 D.减小压强
浓度 D.减小压强

(1)用
 催化加氢可以制取乙烯:
催化加氢可以制取乙烯: 。若该反应体系的能量随反应过程变化关系如上图所示,则该反应属于
。若该反应体系的能量随反应过程变化关系如上图所示,则该反应属于
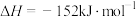 ,则表中的
,则表中的
化学键 |
| H-H |
| C-H | H-O |
健能 | 803 | 436 | x | 414 | 464 |

(2)在
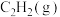 完全燃烧生成
完全燃烧生成 和液态水的反应中,每有5mol电子转移时,放出650kJ的热量,其燃烧热的热化学方程式为
和液态水的反应中,每有5mol电子转移时,放出650kJ的热量,其燃烧热的热化学方程式为(3)工业上用
 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知:
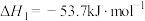 ,
,
 ,
,则


 。为提高该反应中
。为提高该反应中 的转化率,可采用的方式有
的转化率,可采用的方式有A加入合适的催化剂 B.升高温度 C.增大
 浓度 D.减小压强
浓度 D.减小压强
您最近一年使用:0次
名校
解题方法
6 . 碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质,请回答下列问题:
(1)知25℃和101KPa时,液态甲醇( )的燃烧热
)的燃烧热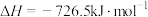 。请写出表示甲醇燃烧热的热化学方程式
。请写出表示甲醇燃烧热的热化学方程式___________ 。
(2) 资源化利用对缓解碳减排压力具有重要意义,使用镍氢催化剂可使
资源化利用对缓解碳减排压力具有重要意义,使用镍氢催化剂可使 转化为
转化为 。反应体系中主要反应的热化学方程式为:
。反应体系中主要反应的热化学方程式为:
反应Ⅰ: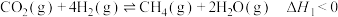
反应Ⅱ: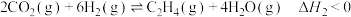
①将反应后气体通入___________ (填试剂名称),可证明反应Ⅱ发生。
②计算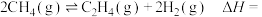
___________ (用 和
和 表示)
表示)
③相同投料比时,体系内 的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为
的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为___________ 。
(3)镍氢催化剂活性因为甲烷分解产生积碳而降低,同时二氧化碳可与碳发生消碳反应:
积碳反应:
消碳反应:
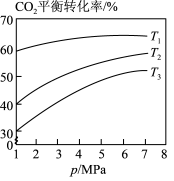
其他条件相同时,催化剂表面积碳量与温度的关系如图所示, ℃之后,温度升高积碳量减小的主要原因
℃之后,温度升高积碳量减小的主要原因___________ 。
(1)知25℃和101KPa时,液态甲醇(
 )的燃烧热
)的燃烧热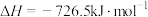 。请写出表示甲醇燃烧热的热化学方程式
。请写出表示甲醇燃烧热的热化学方程式(2)
 资源化利用对缓解碳减排压力具有重要意义,使用镍氢催化剂可使
资源化利用对缓解碳减排压力具有重要意义,使用镍氢催化剂可使 转化为
转化为 。反应体系中主要反应的热化学方程式为:
。反应体系中主要反应的热化学方程式为:反应Ⅰ:
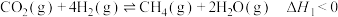
反应Ⅱ:
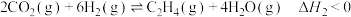
①将反应后气体通入
②计算
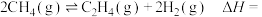
 和
和 表示)
表示)③相同投料比时,体系内
 的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为
的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为
(3)镍氢催化剂活性因为甲烷分解产生积碳而降低,同时二氧化碳可与碳发生消碳反应:

积碳反应:

消碳反应:

其他条件相同时,催化剂表面积碳量与温度的关系如图所示,
 ℃之后,温度升高积碳量减小的主要原因
℃之后,温度升高积碳量减小的主要原因
您最近一年使用:0次
名校
7 . 完成下列问题
(1)已知:①

 ②
②

则

___________ 。
(2)已知:①

 ②
②

则表示氨气燃烧热的热化学方程式为___________ ,该反应可设计为碱性条件下的燃料电池,负极电极反应式为___________ 。
(3)已知几种化学键的键能和热化学方程式如下:

 ,则a=
,则a=___________ 。
(4)4种不饱和烃分别与氢气发生加成反应生成1mol环己烷(
 )的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是
)的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是
___________ ;反应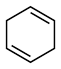 (l)=
(l)= 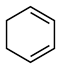 (l)的
(l)的

___________ 。
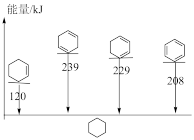
(5)用电解法处理有机废水是目前工业上一种常用手段,电解过程中阳极催化剂表面水被电解产生氧化性强的羟基自由基(
 ),羟基自由基再进一步把有机物氧化为无毒物质。下图为电解二氯乙烷废水的装置图,写出电解池阴极的电极反应式:
),羟基自由基再进一步把有机物氧化为无毒物质。下图为电解二氯乙烷废水的装置图,写出电解池阴极的电极反应式:
___________ ;羟基自由基与二氯乙烷反应的化学方程式为
___________ 。
(1)已知:①

 ②
②

则


(2)已知:①

 ②
②

则表示氨气燃烧热的热化学方程式为
(3)已知几种化学键的键能和热化学方程式如下:
| 化学键 |  |  |  |  |  |
键能/( ) ) | 391 | 193 | 243 | a | 432 |

 ,则a=
,则a=(4)4种不饱和烃分别与氢气发生加成反应生成1mol环己烷(
 )的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是
)的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是 (l)=
(l)=  (l)的
(l)的

(5)用电解法处理有机废水是目前工业上一种常用手段,电解过程中阳极催化剂表面水被电解产生氧化性强的羟基自由基(
 ),羟基自由基再进一步把有机物氧化为无毒物质。下图为电解二氯乙烷废水的装置图,写出电解池阴极的电极反应式:
),羟基自由基再进一步把有机物氧化为无毒物质。下图为电解二氯乙烷废水的装置图,写出电解池阴极的电极反应式:
您最近一年使用:0次
2023-10-26更新
|
541次组卷
|
6卷引用:河南省豫北名校2024届高三毕业班上学期一轮复习联考(二)化学试题
名校
解题方法
8 . 联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。火箭推进器中装有还原剂肼(N2H4)和强氧化剂过氧化氢(H2O2),当它们混合时,即产生大量氮气和水蒸气, 并放出大量热。已知0.5mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出320.8kJ的热量。
(1)肼的结构式为___________ ,其中氮的化合价为___________ 。
(2)写出反应的热化学方程式:___________ 。
(3)在25℃、101kPa时,已知18g水蒸气变成液态水放出44kJ的热量。其他相关数据如下:
①写出表示H2燃烧热的热化学方程式___________ ;
②则32g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是___________ ;
③联氨和H2O2可作为火箭推进剂的主要原因为___________ 。
(4)①2O2(g)+N2(g)=N2O4(l)
②N2(g)+2H2(g)=N2H4(l)
③O2(g)+2H2(g)=2H2O(g)
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)
上述反应热效应之间的关系式为 =
=___________ (用 、
、 、
、 表示)。
表示)。
(5)已知:N2(g)+2O2(g)=2NO2(g) =+66.4kJ/mol
=+66.4kJ/mol
N2H4(l)+O2(g)=N2(g)+2H2O(g) =-534kJ/mol
=-534kJ/mol
H2O(g)=H2O(l) =-44.0kJ/mol
=-44.0kJ/mol
则2N2H4(l)+2NO2(g)=3N2(g)+4H2O(l) =
=___________ 。
(1)肼的结构式为
(2)写出反应的热化学方程式:
(3)在25℃、101kPa时,已知18g水蒸气变成液态水放出44kJ的热量。其他相关数据如下:
| O=O | H-H | H-O(g) | |
| 1mol化学键断裂时需要吸收的能量/kJ | 496 | 436 | 463 |
②则32g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是
③联氨和H2O2可作为火箭推进剂的主要原因为
(4)①2O2(g)+N2(g)=N2O4(l)

②N2(g)+2H2(g)=N2H4(l)

③O2(g)+2H2(g)=2H2O(g)

④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)

上述反应热效应之间的关系式为
 =
= 、
、 、
、 表示)。
表示)。(5)已知:N2(g)+2O2(g)=2NO2(g)
 =+66.4kJ/mol
=+66.4kJ/molN2H4(l)+O2(g)=N2(g)+2H2O(g)
 =-534kJ/mol
=-534kJ/molH2O(g)=H2O(l)
 =-44.0kJ/mol
=-44.0kJ/mol则2N2H4(l)+2NO2(g)=3N2(g)+4H2O(l)
 =
=
您最近一年使用:0次
名校
解题方法
9 . 研究化学反应中的能量和速率变化对生产、生活有着重要意义。
Ⅰ.煤和石油燃烧生成的 为大气主要污染物之一、硫与硫的氧化物在转化过程中的能量变化如图1所示。
为大气主要污染物之一、硫与硫的氧化物在转化过程中的能量变化如图1所示。
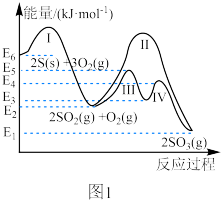
(1)写出表示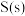 的燃烧热的热化学方程式:
的燃烧热的热化学方程式:_____ 。
Ⅱ.实验室模拟热气循环法合成尿素, 与
与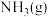 在一定条件下发生反应:
在一定条件下发生反应:
 。
。
为了验证反应温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示。
(2)控制变量是科学研究的重要方法,因此表中数据:a=_____ ,T1=_____ 。
(3)对比实验①③,目的是验证_____ (填“反应温度”或“催化剂的比表面积”)对化学反应速率的影响规律。
(4)一定温度下,向1L密闭容器中充入 和
和 发生反应:
发生反应: ,若起始压强为
,若起始压强为 ,反应
,反应 后该反应达到化学平衡状态,平衡时的压强是起始时的0.8倍,则
后该反应达到化学平衡状态,平衡时的压强是起始时的0.8倍,则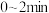 内,
内,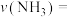
_____  ,
, 的平衡转化率为
的平衡转化率为_____  。
。
(5)下列情况中,一定能说明上述反应达到平衡的是_____(填标号)。
(6)“碳呼吸电池”是一种新型化学电源,其工作原理如图2.正极的电极反应式为_____ ;当得到 时,电路中转移的电子的物质的量为
时,电路中转移的电子的物质的量为_____  。
。

Ⅰ.煤和石油燃烧生成的
 为大气主要污染物之一、硫与硫的氧化物在转化过程中的能量变化如图1所示。
为大气主要污染物之一、硫与硫的氧化物在转化过程中的能量变化如图1所示。
(1)写出表示
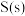 的燃烧热的热化学方程式:
的燃烧热的热化学方程式:Ⅱ.实验室模拟热气循环法合成尿素,
 与
与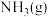 在一定条件下发生反应:
在一定条件下发生反应:
 。
。为了验证反应温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示。
| 实验编号 | T/℃ | CO2初始浓度/ (mol·L-1) | NH3初始浓度/ (mol·L-1) | 催化剂的比表面积/ (m2·g-1) |
| ① | 280 | 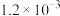 | 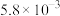 | 82 |
| ② | T1 | 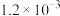 | 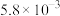 | 124 |
| ③ | 350 | a | 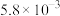 | 82 |
(3)对比实验①③,目的是验证
(4)一定温度下,向1L密闭容器中充入
 和
和 发生反应:
发生反应: ,若起始压强为
,若起始压强为 ,反应
,反应 后该反应达到化学平衡状态,平衡时的压强是起始时的0.8倍,则
后该反应达到化学平衡状态,平衡时的压强是起始时的0.8倍,则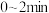 内,
内,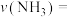
 ,
, 的平衡转化率为
的平衡转化率为 。
。(5)下列情况中,一定能说明上述反应达到平衡的是_____(填标号)。
A. 的体积分数保持不变 的体积分数保持不变 |
| B.反应体系中气体的密度保持不变 |
C.反应消耗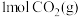 ,同时生成 ,同时生成  |
D. 的质量保持不变 的质量保持不变 |
 时,电路中转移的电子的物质的量为
时,电路中转移的电子的物质的量为 。
。
您最近一年使用:0次
2023-10-20更新
|
142次组卷
|
4卷引用:河北省部分学校2023-2024学年高三上学期9月月考化学试题
名校
解题方法
10 . 写出或完成下列热化学方程式。
(1)下列变化过程,属于放热反应的是_______ 。
①浓 稀释;②酸碱中和反应:③
稀释;②酸碱中和反应:③ 在
在 中燃烧;④
中燃烧;④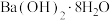 与
与 ;⑤铝热反应:⑧碳高温条件下还原
;⑤铝热反应:⑧碳高温条件下还原 ;⑦碳酸钙分解
;⑦碳酸钙分解
(2)已知:①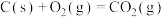
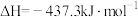
②
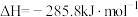
③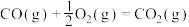
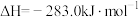
则固态碳和水蒸气反应生成CO和 的热化学方程式为
的热化学方程式为_______ 。
(3)通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。表中是一些化学键的键能。
根据键能数据估算下列反应: 的反应热
的反应热 为
为_______ 。
(4)已知稀溶液中,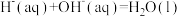
 。
。
①则稀醋酸与稀氢氧化钠溶液反应生成1mol水时放出的热量比57.3kJ_______ (填“大”“小”)。若选用硫酸和氢氧化钡的稀溶液做中和热测定实验(操作无误),测定结果
_______  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
②某化学兴趣小组用50mL 盐酸、50mL
盐酸、50mL  NaOH溶液进行中和热测定,计算结果
NaOH溶液进行中和热测定,计算结果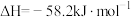 ,其原因可能是:
,其原因可能是:_______ 。
A.盐酸与NaOH溶液混合后立即记录温度
B.分三次将盐酸溶液缓慢倒入NaOH溶液中
C.用量筒量取NaOH溶液时仰视读数
D.使用环形玻璃棒搅拌
③标准状况下,3.36L 仅由C、H两种元素组成的某气体质量为4.5g,在25℃和101kPa下完全燃烧生成 和
和 时,放出233.97kJ的热量。该气体的分子式为
时,放出233.97kJ的热量。该气体的分子式为_______ ,表示该气体摩尔燃烧焓的热化学方程式为_______ 。
④2022年北京冬奥会将用绿氢( )作为火炬燃料,以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
)作为火炬燃料,以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
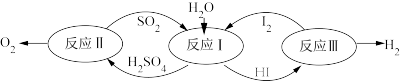
反应Ⅰ: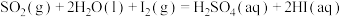

反应Ⅱ: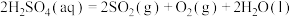
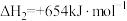
反应Ⅲ: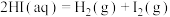
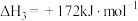
则反应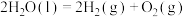

_______ 。
(1)下列变化过程,属于放热反应的是
①浓
 稀释;②酸碱中和反应:③
稀释;②酸碱中和反应:③ 在
在 中燃烧;④
中燃烧;④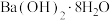 与
与 ;⑤铝热反应:⑧碳高温条件下还原
;⑤铝热反应:⑧碳高温条件下还原 ;⑦碳酸钙分解
;⑦碳酸钙分解(2)已知:①
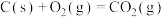
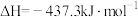
②

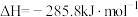
③
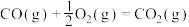
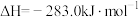
则固态碳和水蒸气反应生成CO和
 的热化学方程式为
的热化学方程式为(3)通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。表中是一些化学键的键能。
| 化学键 | C-H | C-F | H-F | F-F |
| 键能kJ/mol | 414 | 489 | 565 | 155 |
 的反应热
的反应热 为
为(4)已知稀溶液中,
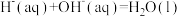
 。
。①则稀醋酸与稀氢氧化钠溶液反应生成1mol水时放出的热量比57.3kJ

 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。②某化学兴趣小组用50mL
 盐酸、50mL
盐酸、50mL  NaOH溶液进行中和热测定,计算结果
NaOH溶液进行中和热测定,计算结果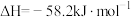 ,其原因可能是:
,其原因可能是:A.盐酸与NaOH溶液混合后立即记录温度
B.分三次将盐酸溶液缓慢倒入NaOH溶液中
C.用量筒量取NaOH溶液时仰视读数
D.使用环形玻璃棒搅拌
③标准状况下,3.36L 仅由C、H两种元素组成的某气体质量为4.5g,在25℃和101kPa下完全燃烧生成
 和
和 时,放出233.97kJ的热量。该气体的分子式为
时,放出233.97kJ的热量。该气体的分子式为④2022年北京冬奥会将用绿氢(
 )作为火炬燃料,以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
)作为火炬燃料,以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
反应Ⅰ:
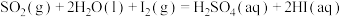

反应Ⅱ:
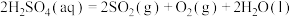
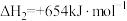
反应Ⅲ:
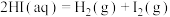
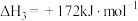
则反应
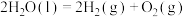

您最近一年使用:0次






