解题方法
1 .  在化学化工领域有诸多用途。回答下列问题:
在化学化工领域有诸多用途。回答下列问题:
(1) 、
、 条件下,
条件下, 的燃烧过程中,每消耗
的燃烧过程中,每消耗 放出
放出 热量,表示
热量,表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为_______ 。
(2)在 催化作用下合成
催化作用下合成 的反应为
的反应为 。
。
①下列有利于提高 的平衡转化率的是
的平衡转化率的是_______ (填字母,下同)。
A.低温高压 B.高温低压 C.高温高压 D.低温低压
②下列有关合成 的说法中正确的是
的说法中正确的是_______ 。

A.存在非极性共价键的断裂与形成
B.所有分子均为极性分子
C.如图为 的晶胞结构,图中
的晶胞结构,图中 表示
表示
D.催化剂可降低该反应的焓变
(3)工业上可利用 和
和 反应制备光气
反应制备光气 :
: 。在
。在 恒温恒容密闭容器中充入
恒温恒容密闭容器中充入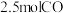 和
和 ,在催化剂作用下发生反应,测得
,在催化剂作用下发生反应,测得 及
及 的物质的量随时间变化如图所示:
的物质的量随时间变化如图所示:

①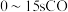 的平均反应速率为
的平均反应速率为_______  。
。
②第一次平衡时, 的平衡转化率为
的平衡转化率为_______ ;该温度下反应的平衡常数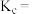
_______ (保留三位有效数字)。
③在第 时,改变的条件是
时,改变的条件是_______ 。
(4)一定条件下, 与
与 反应生成
反应生成 和
和 :
: 。已知
。已知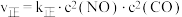 ,
,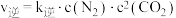 (
( 、
、 为速率常数,只与温度有关)。若在
为速率常数,只与温度有关)。若在 的密闭容器中充入
的密闭容器中充入 和
和 ,在一定温度下达到平衡时,
,在一定温度下达到平衡时, 的转化率为
的转化率为 ,则
,则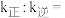
_______ 。
 在化学化工领域有诸多用途。回答下列问题:
在化学化工领域有诸多用途。回答下列问题:(1)
 、
、 条件下,
条件下, 的燃烧过程中,每消耗
的燃烧过程中,每消耗 放出
放出 热量,表示
热量,表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为(2)在
 催化作用下合成
催化作用下合成 的反应为
的反应为 。
。①下列有利于提高
 的平衡转化率的是
的平衡转化率的是A.低温高压 B.高温低压 C.高温高压 D.低温低压
②下列有关合成
 的说法中正确的是
的说法中正确的是
A.存在非极性共价键的断裂与形成
B.所有分子均为极性分子
C.如图为
 的晶胞结构,图中
的晶胞结构,图中 表示
表示
D.催化剂可降低该反应的焓变

(3)工业上可利用
 和
和 反应制备光气
反应制备光气 :
: 。在
。在 恒温恒容密闭容器中充入
恒温恒容密闭容器中充入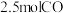 和
和 ,在催化剂作用下发生反应,测得
,在催化剂作用下发生反应,测得 及
及 的物质的量随时间变化如图所示:
的物质的量随时间变化如图所示:
①
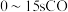 的平均反应速率为
的平均反应速率为 。
。②第一次平衡时,
 的平衡转化率为
的平衡转化率为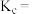
③在第
 时,改变的条件是
时,改变的条件是(4)一定条件下,
 与
与 反应生成
反应生成 和
和 :
: 。已知
。已知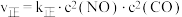 ,
,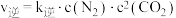 (
( 、
、 为速率常数,只与温度有关)。若在
为速率常数,只与温度有关)。若在 的密闭容器中充入
的密闭容器中充入 和
和 ,在一定温度下达到平衡时,
,在一定温度下达到平衡时, 的转化率为
的转化率为 ,则
,则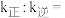
您最近一年使用:0次
2023-07-12更新
|
62次组卷
|
2卷引用:辽宁省朝阳市2022-2023学年高二下学期期末联考化学试题
名校
解题方法
2 . 为了提高煤的利用率,人们先把煤转化为CO和H2,再将它们转化为甲醇。某实验人员在一定温度下的密闭容器中,充入一定量的H2和CO,在催化剂的作用下发生反应:2H2(g)+CO(g)⇌CH3OH(g),测定的部分实验数据如下:
(1)在500s内用H2表示的化学反应速率是___________
(2)在1000s时CO的转化率是___________ ,此时___________ 化学平衡状态(填选项)。
a.一定处于 b.一定不处于 c.可能处于
(3)在500s时生成的甲醇的浓度是___________ 。
(4)已知在101kPa,甲醇的熔点为-97.8℃,沸点为64.7℃。在25℃时,甲醇的燃烧热为726.5kJ/mol。则表示甲醇的燃烧热的热化学方程式为___________ 。
(5)以甲醇为燃料、空气为氧化剂、KOH溶液为电解质溶液设计而成的燃料电池,在工作时负极反应式为___________ 。
| t/s | 0 | 500 | 1000 | 1500 |
| c(H2)/mol•L-1 | 5.00 | 3.52 | 2.48 | 2.20 |
| c(CO)/mol•L-1 | 2.50 |
(2)在1000s时CO的转化率是
a.一定处于 b.一定不处于 c.可能处于
(3)在500s时生成的甲醇的浓度是
(4)已知在101kPa,甲醇的熔点为-97.8℃,沸点为64.7℃。在25℃时,甲醇的燃烧热为726.5kJ/mol。则表示甲醇的燃烧热的热化学方程式为
(5)以甲醇为燃料、空气为氧化剂、KOH溶液为电解质溶液设计而成的燃料电池,在工作时负极反应式为
您最近一年使用:0次
3 . 化学反应与能量变化是化学家研究的永恒话题。回答下列问题:
(1)氢气是理想的绿色能源。在101 kPa下,1 g氢气完全燃烧生成液态水放出142.9 kJ的热量,则表示氢气燃烧热的热化学方程式为___________ 。
(2)一定温度、催化剂条件下,向容积为2 L的恒容密闭容器中充入4 molCO和6 mol NO,发生反应 ,起始压强为p0 kPa。10 m in末反应达到平衡,此时容器内压强变为起始时的
,起始压强为p0 kPa。10 m in末反应达到平衡,此时容器内压强变为起始时的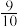 。
。
①判断该反应达到平衡状态的标志是___________ (填标号)。
a.CO、NO、CO2、N2浓度之比为2:2:2:1
b.容器内气体的压强不变
c.容器内混合气体的密度保持不变
d.容器内混合气体的平均摩尔质量保持不变
e.CO2的生成速率和CO的生成速率相等
② 时间内,CO的平均反应速率为
时间内,CO的平均反应速率为___________ mol/(L·min)。该反应的压强平衡常数Kp=___________ kPa-1(用分压代替浓度计算,分压=总压×物质的量分数。用含 的代数式表示)。
的代数式表示)。
③若在相同时间内测得NO的转化率随温度的变化曲线如图甲所示,NO的转化率在650℃~900℃之间急剧下降的原因是___________ 。

(3)有机物的电化学合成是目前研究的热点之一,我国学者利用双膜三室电解法合成了ClCH2CH2Cl,该方法的优点是能耗低、原料利用率高,同时能得到高利用价值的副产品,其工作原理如图乙所示。

①气体X为___________ ,膜Ⅰ适合选用___________ (填“阳离子”或“阴离子”)交换膜。
②稳定工作时CuCl2溶液的浓度___________ (填“增大”“减小”“不变”“无法判断”)。
③若制得2 mol ClCH2CH2Cl,饱和食盐水质量减小___________ g。
(1)氢气是理想的绿色能源。在101 kPa下,1 g氢气完全燃烧生成液态水放出142.9 kJ的热量,则表示氢气燃烧热的热化学方程式为
(2)一定温度、催化剂条件下,向容积为2 L的恒容密闭容器中充入4 molCO和6 mol NO,发生反应
 ,起始压强为p0 kPa。10 m in末反应达到平衡,此时容器内压强变为起始时的
,起始压强为p0 kPa。10 m in末反应达到平衡,此时容器内压强变为起始时的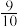 。
。①判断该反应达到平衡状态的标志是
a.CO、NO、CO2、N2浓度之比为2:2:2:1
b.容器内气体的压强不变
c.容器内混合气体的密度保持不变
d.容器内混合气体的平均摩尔质量保持不变
e.CO2的生成速率和CO的生成速率相等
②
 时间内,CO的平均反应速率为
时间内,CO的平均反应速率为 的代数式表示)。
的代数式表示)。③若在相同时间内测得NO的转化率随温度的变化曲线如图甲所示,NO的转化率在650℃~900℃之间急剧下降的原因是

(3)有机物的电化学合成是目前研究的热点之一,我国学者利用双膜三室电解法合成了ClCH2CH2Cl,该方法的优点是能耗低、原料利用率高,同时能得到高利用价值的副产品,其工作原理如图乙所示。

①气体X为
②稳定工作时CuCl2溶液的浓度
③若制得2 mol ClCH2CH2Cl,饱和食盐水质量减小
您最近一年使用:0次
解题方法
4 . 某空间站的生命保障系统功能之一是实现氧循环,其中涉及反应: ,回答问题:
,回答问题:
(1)已知:电解液态水制备1mol ,电解反应的
,电解反应的 。由此计算
。由此计算 的燃烧热(焓)
的燃烧热(焓)
___________  。
。
(2)已知: 的平衡常数(K)与反应温度(t)之间的关系如图1所示。
的平衡常数(K)与反应温度(t)之间的关系如图1所示。

①若反应为基元反应,且反应的 与活化能(
与活化能( )的关系为
)的关系为 。补充完成该反应过程的能量变化示意图(图2)
。补充完成该反应过程的能量变化示意图(图2)___________ 。
②某研究小组模拟该反应,温度t下,向容积为10L的抽空的密闭容器中通入0.1mol 和0.4mol
和0.4mol ,反应平衡后测得容器中
,反应平衡后测得容器中 。则
。则 的转化率为
的转化率为___________ ,反应温度t约为___________ ℃。
(3)在相同条件下, 与
与 还会发生不利于氧循环的副反应:
还会发生不利于氧循环的副反应: ,在反应器中按
,在反应器中按 通入反应物,在不同温度、不同催化剂条件下,反应进行到2min时,测得反应器中
通入反应物,在不同温度、不同催化剂条件下,反应进行到2min时,测得反应器中 、
、 浓度(
浓度( )如下表所示。
)如下表所示。
若某空间站的生命保障系统实际选择使用催化剂II和400℃的反应条件,原因是___________ 。
(4)某温度下,反应 在密闭容器中达到平衡,下列说法正确的是___________。
在密闭容器中达到平衡,下列说法正确的是___________。
 ,回答问题:
,回答问题:(1)已知:电解液态水制备1mol
 ,电解反应的
,电解反应的 。由此计算
。由此计算 的燃烧热(焓)
的燃烧热(焓)
 。
。(2)已知:
 的平衡常数(K)与反应温度(t)之间的关系如图1所示。
的平衡常数(K)与反应温度(t)之间的关系如图1所示。
①若反应为基元反应,且反应的
 与活化能(
与活化能( )的关系为
)的关系为 。补充完成该反应过程的能量变化示意图(图2)
。补充完成该反应过程的能量变化示意图(图2)②某研究小组模拟该反应,温度t下,向容积为10L的抽空的密闭容器中通入0.1mol
 和0.4mol
和0.4mol ,反应平衡后测得容器中
,反应平衡后测得容器中 。则
。则 的转化率为
的转化率为(3)在相同条件下,
 与
与 还会发生不利于氧循环的副反应:
还会发生不利于氧循环的副反应: ,在反应器中按
,在反应器中按 通入反应物,在不同温度、不同催化剂条件下,反应进行到2min时,测得反应器中
通入反应物,在不同温度、不同催化剂条件下,反应进行到2min时,测得反应器中 、
、 浓度(
浓度( )如下表所示。
)如下表所示。| 催化剂 | t=350℃ | t=400℃ | ||
 |  |  |  | |
| 催化剂I | 10.8 | 12722 | 345.2 | 42780 |
| 催化剂II | 9.2 | 10775 | 34 | 38932 |
(4)某温度下,反应
 在密闭容器中达到平衡,下列说法正确的是___________。
在密闭容器中达到平衡,下列说法正确的是___________。A.增大压强, ,平衡常数不变 ,平衡常数不变 |
B.加入催化剂,平衡时 的浓度增大 的浓度增大 |
| C.恒容下,充入一定量的稀有气体,平衡向正反应方向移动 |
| D.催化剂II选择性地提高该反应的速率 |
您最近一年使用:0次
名校
解题方法
5 . 研究化学反应中的能量变化具有重要意义:
Ⅰ.写出下列反应的热化学方程式
(1)1mol (g)在
(g)在 中完全燃烧生成
中完全燃烧生成 和液态水,放出1299.6kJ的热量
和液态水,放出1299.6kJ的热量___________ 。
(2)23g (l)在
(l)在 中完全燃烧生成
中完全燃烧生成 和液态水,放出683.4kJ的热量
和液态水,放出683.4kJ的热量________ 。
Ⅱ.50 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热。回答下列问题:

(3)从实验装置上看,图中尚缺少的一种玻璃仪器是___________ 。
(4)隔热层的作用是___________ 。
(5)倒入NaOH溶液的正确操作是___________ (填字母)。
a.沿玻璃棒缓慢倒入 b.分三次少量倒入 c.一次迅速倒入
Ⅲ.学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。
(6)键能也可以用于估算化学反应的反应热(ΔH),下表是部分化学键的键能数据:
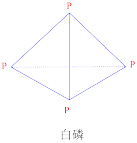
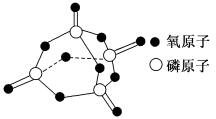
已知白磷的燃烧热为2378.0kJ/mol,白磷(白磷的结构如图)完全燃烧的产物结构如图所示,则上表中X=___________ 。
(7)1840年,俄国化学家盖斯在分析了许多化学反应热效应的基础上,总结出一条规律:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。”这个规律被称为盖斯定律。有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。
已知3.6g碳在6.4g的氧气中燃烧,至反应物耗尽,放出xkJ热量。已知单质碳的燃烧热为ykJ/mol,则1molC与O2反应生成CO的反应热△H为___________ kJ/mol(用x、y表示)。
Ⅰ.写出下列反应的热化学方程式
(1)1mol
 (g)在
(g)在 中完全燃烧生成
中完全燃烧生成 和液态水,放出1299.6kJ的热量
和液态水,放出1299.6kJ的热量(2)23g
 (l)在
(l)在 中完全燃烧生成
中完全燃烧生成 和液态水,放出683.4kJ的热量
和液态水,放出683.4kJ的热量Ⅱ.50 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热。回答下列问题:

(3)从实验装置上看,图中尚缺少的一种玻璃仪器是
(4)隔热层的作用是
(5)倒入NaOH溶液的正确操作是
a.沿玻璃棒缓慢倒入 b.分三次少量倒入 c.一次迅速倒入
Ⅲ.学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。
(6)键能也可以用于估算化学反应的反应热(ΔH),下表是部分化学键的键能数据:
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/(kJ·mol-1) | 172 | 335 | 498 | X |


(7)1840年,俄国化学家盖斯在分析了许多化学反应热效应的基础上,总结出一条规律:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。”这个规律被称为盖斯定律。有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。
已知3.6g碳在6.4g的氧气中燃烧,至反应物耗尽,放出xkJ热量。已知单质碳的燃烧热为ykJ/mol,则1molC与O2反应生成CO的反应热△H为
您最近一年使用:0次
名校
解题方法
6 . 碳是人类跨入文明史的第一步,也是现今环境问题的关键步,更出现在深化化学学习的每一步。人类进化过程中,先后利用木炭中的碳作为能源和还原剂。然而碳循环在工业社会遭到了严重破坏,气候异常和环境恶化迫使我们不断提高对碳的认识。
(1)化学与生产、生活密切相关。下列事实与化学反应速率无关的是_____。
(2)下列叙述不正确的是_____。
(3)已知:①25℃、101kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221kJ•mol-1
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ•mol-1
下列结论正确的是_____。
(4)开发氢能是降碳的关键。实验计算机模拟在催化剂表面水煤气变换低温产氢反应过程中能量的变化如图所示,下列说法正确的是_____。

(5)已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-50kJ•mol-1;
CO(g)+2H2(g)=CH3OH(g) ΔH=-91kJ•mol-1
则1molCO断键吸收的能量为_____。
(6)在碳循环中,以NH3、CO2为原料生产尿素的反应历程与能量变化示意图如下。第二步反应的△H_____ 0(填“>”、“<”或“=”)。从图像分析决定生产尿素的总反应的反应速率的步骤是第_____ 步反应。

(1)化学与生产、生活密切相关。下列事实与化学反应速率无关的是_____。
| A.工业燃煤时加入石灰石 |
| B.冶炼矿石前先将矿石粉碎 |
| C.运输疫苗需用冷藏箱 |
| D.用锌片制取氢气时滴入几滴硫酸铜溶液 |
| A.植物燃料燃烧时放出的能量来源于太阳能 |
| B.Na与H2O的反应是熵增的放热反应,该反应能自发进行 |
| C.测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小 |
| D.1molH2燃烧放出的热量为H2的燃烧热 |
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ•mol-1
下列结论正确的是_____。
| A.C的燃烧热大于110.5kJ•mol-1 |
| B.①的反应热为221kJ•mol-1 |
| C.稀硫酸与稀NaOH溶液反应的中和热为57.3kJ•mol-1 |
| D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 |

| A.水煤气变换产氢反应是吸热反应 |
| B.过程Ⅰ、Ⅱ、Ⅲ均需要吸收能量 |
| C.状态4中物质状态最稳定 |
| D.每生成1molH2转移1mole- |
CO(g)+2H2(g)=CH3OH(g) ΔH=-91kJ•mol-1
| C=O | H-H | H-O | |
| 键能/(kJ⋅mol﹣1) | 803 | 436 | 463 |
| A.1075kJ | B.1157kJ | C.735kJ | D.817kJ |

您最近一年使用:0次
解题方法
7 . 现代社会生活离不开能量。
(1)天然气的主要成分是甲烷,它是一种清洁能源。1g甲烷气体完全燃烧生成二氧化碳气体和液态水,放出55.6kJ的热量,写出该反应的热化学方程式___________ 。
(2)Fe-Cu原电池的装置如图所示,请按要求填空。
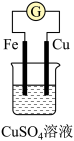
①正极材料是___________ ,溶液中的 向
向___________ (填“铁”或“铜”)电极方向移动。
②负极的现象___________ ,负极的电极反应式___________ 。
③电路中每转移0.2mol电子,析出铜___________ g。
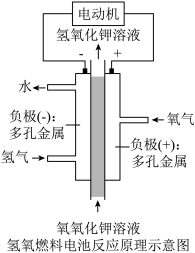
(3)氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图。该电池负极的电极反应式为___________ ,正极附近溶液碱性___________ (填“增强”或“减弱”)。
(1)天然气的主要成分是甲烷,它是一种清洁能源。1g甲烷气体完全燃烧生成二氧化碳气体和液态水,放出55.6kJ的热量,写出该反应的热化学方程式
(2)Fe-Cu原电池的装置如图所示,请按要求填空。

①正极材料是
 向
向②负极的现象
③电路中每转移0.2mol电子,析出铜
(3)氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图。该电池负极的电极反应式为

您最近一年使用:0次
名校
解题方法
8 . 在第75届联合国大会我国提出要实现2030年前碳达峰、2060年前碳中和的目标, 的捕集、利用与封存成为科学家研究的重要课题。回答下列问题:
的捕集、利用与封存成为科学家研究的重要课题。回答下列问题:
(1)化石燃料的燃烧是 的主要来源。1g
的主要来源。1g 完全燃烧生成
完全燃烧生成 和液态
和液态 放出热量为55.64kJ,表示
放出热量为55.64kJ,表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为________________ 。
(2)在载人航天器中,利用反应
 可将航天员呼出的
可将航天员呼出的 转化为
转化为 和
和 ,然后用惰性电极电解
,然后用惰性电极电解 再生氧气。则
再生氧气。则
 的
的
_____  ;电解水时,阳极的电极反应式为
;电解水时,阳极的电极反应式为____________________________ 。
(3)用如图装置电解 制取
制取 ,温度控制在10℃左右,持续通入
,温度控制在10℃左右,持续通入 ,电解前后
,电解前后 物质的量基本不变。
物质的量基本不变。

①铂电极为_____________ 极,电解过程中 的移动方向是
的移动方向是_____________ 。
②阴极电极反应为____________________ 。
③当阳极产生的气体体积为112L时(标准状况下),外电路转移电子数为_____________ 。
 的捕集、利用与封存成为科学家研究的重要课题。回答下列问题:
的捕集、利用与封存成为科学家研究的重要课题。回答下列问题:(1)化石燃料的燃烧是
 的主要来源。1g
的主要来源。1g 完全燃烧生成
完全燃烧生成 和液态
和液态 放出热量为55.64kJ,表示
放出热量为55.64kJ,表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为(2)在载人航天器中,利用反应

 可将航天员呼出的
可将航天员呼出的 转化为
转化为 和
和 ,然后用惰性电极电解
,然后用惰性电极电解 再生氧气。则
再生氧气。则
 的
的
 ;电解水时,阳极的电极反应式为
;电解水时,阳极的电极反应式为(3)用如图装置电解
 制取
制取 ,温度控制在10℃左右,持续通入
,温度控制在10℃左右,持续通入 ,电解前后
,电解前后 物质的量基本不变。
物质的量基本不变。
①铂电极为
 的移动方向是
的移动方向是②阴极电极反应为
③当阳极产生的气体体积为112L时(标准状况下),外电路转移电子数为
您最近一年使用:0次
解题方法
9 . 汽车等交通工具为出行、物流带来方便。然而燃油车排放的尾气中含有大量有害物质,对人体和环境造成危害。
(1)汽油在不同空燃比(空气与燃油气的体积比)时尾气的主要成分不同,空燃比较小的时候有毒气体主要是___________ 。
(2)辛烷(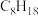 )是汽油的主要成分之一,已知辛烷的燃烧热
)是汽油的主要成分之一,已知辛烷的燃烧热 ,请写出表示辛烷燃烧热的热化学方程式
,请写出表示辛烷燃烧热的热化学方程式___________ 。
(3)空气中的氮气和氧气在气缸内高温环境下,通过电火花放电生成有毒气体NO,反应的热化学方程式为: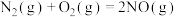
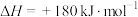 。已知:
。已知: 、
、 分子中化学键的键能分别为946kJ/mol、497 kJ/mol,则NO分子中化学键的键能为
分子中化学键的键能分别为946kJ/mol、497 kJ/mol,则NO分子中化学键的键能为___________ 。
(4)为减轻污染,现在汽车上都安装三元催化转化器,可实现反应: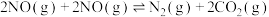
 ,该反应在
,该反应在___________ (填“高温”、“低温”或“任意温度”)下能自发进行。
(1)汽油在不同空燃比(空气与燃油气的体积比)时尾气的主要成分不同,空燃比较小的时候有毒气体主要是
(2)辛烷(
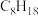 )是汽油的主要成分之一,已知辛烷的燃烧热
)是汽油的主要成分之一,已知辛烷的燃烧热 ,请写出表示辛烷燃烧热的热化学方程式
,请写出表示辛烷燃烧热的热化学方程式(3)空气中的氮气和氧气在气缸内高温环境下,通过电火花放电生成有毒气体NO,反应的热化学方程式为:
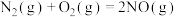
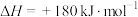 。已知:
。已知: 、
、 分子中化学键的键能分别为946kJ/mol、497 kJ/mol,则NO分子中化学键的键能为
分子中化学键的键能分别为946kJ/mol、497 kJ/mol,则NO分子中化学键的键能为(4)为减轻污染,现在汽车上都安装三元催化转化器,可实现反应:
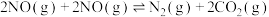
 ,该反应在
,该反应在
您最近一年使用:0次
名校
解题方法
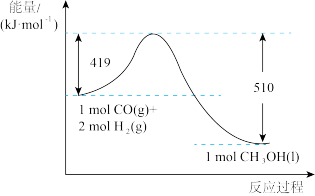
10 . 能源是国民经济发展的重要基础,如何合理利用现有能源以及开发新能源一直是研究的重点课题。
(1)根据如图所示的转化关系判断, 和
和 反应生成
反应生成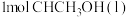 的反应为
的反应为___________ (填“吸热”或“放热”)反应,
___________ 。
(2)已知反应
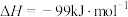 ,此反应中相关的化学键键能(“
,此反应中相关的化学键键能(“ ”表示
”表示 的化学键)数据如下:
的化学键)数据如下:
则X=___________  。
。
(3)如果将燃料燃烧设计成燃料电池就可使化学能转化为电能,某种燃料电池的工作原理示意如图所示,a、b均为惰性电极。
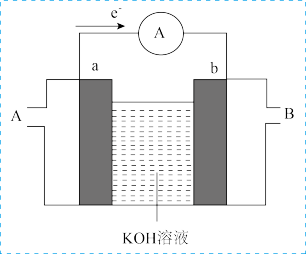
①使用时,空气从___________ 口通入(填“A”或“B”);正极的电极反应式为___________ 。
②假设使用的“燃料”是甲烷 ,a极的电极反应式为
,a极的电极反应式为___________ 。放电一段时间后,电解质溶液的碱性___________ (填“增强”、“减弱”或“不变”)。
(4)在25℃、 时,
时,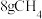 完全燃烧生成液态水时放出的热量是
完全燃烧生成液态水时放出的热量是 。写出
。写出 燃烧的热化学反应方程式
燃烧的热化学反应方程式___________ 。理想状态下,甲烷燃料电池消耗 所能产生的最大电能为
所能产生的最大电能为 ,则该燃料电池的理论效率(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)为
,则该燃料电池的理论效率(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)为___________ %。
(1)根据如图所示的转化关系判断,
 和
和 反应生成
反应生成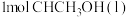 的反应为
的反应为

(2)已知反应

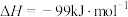 ,此反应中相关的化学键键能(“
,此反应中相关的化学键键能(“ ”表示
”表示 的化学键)数据如下:
的化学键)数据如下:| 化学键 |  |  |  |  |  |
 | 436 | 343 | 1076 | 465 |  |
 。
。(3)如果将燃料燃烧设计成燃料电池就可使化学能转化为电能,某种燃料电池的工作原理示意如图所示,a、b均为惰性电极。

①使用时,空气从
②假设使用的“燃料”是甲烷
 ,a极的电极反应式为
,a极的电极反应式为(4)在25℃、
 时,
时,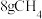 完全燃烧生成液态水时放出的热量是
完全燃烧生成液态水时放出的热量是 。写出
。写出 燃烧的热化学反应方程式
燃烧的热化学反应方程式 所能产生的最大电能为
所能产生的最大电能为 ,则该燃料电池的理论效率(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)为
,则该燃料电池的理论效率(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)为
您最近一年使用:0次



