1 . 已知:氧化锂(Li2O)晶体形成过程中的能量变化如图所示。
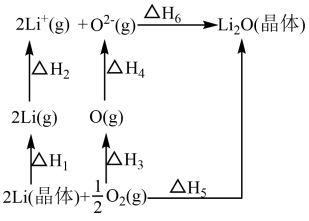
下列说法正确的是

下列说法正确的是
| A.ΔH1>0,ΔH2<0 |
| B.ΔH1+ΔH2+ΔH3+ΔH4+ΔH6-ΔH5=0 |
| C.ΔH3<0,ΔH4<0 |
| D.ΔH1+ΔH2+ΔH3+ΔH4=ΔH5+ΔH6 |
您最近一年使用:0次
2022-03-17更新
|
1719次组卷
|
7卷引用:福建省华安县第一中学2023-2024学年高二上学期10月月考化学试题
2 . 依据图示关系, 等于
等于
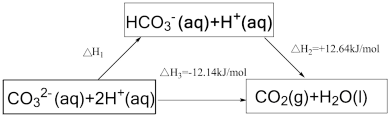
 等于
等于
A.+0.5 | B.-0.5 | C.+24.78 | D.-24.78 |
您最近一年使用:0次
2022-01-23更新
|
312次组卷
|
4卷引用:福建省福清市高中联合体2023-2024学年高二上学期期中考试化学试题
3 . 氮的氧化物在生产、生活中有广泛应用。
Ⅰ.已知汽车气缸中氮及其化合物发生如下反应:
 (常温下平衡常数为K1)
(常温下平衡常数为K1)
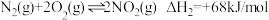 (常温下平衡常数为K2)
(常温下平衡常数为K2)
(1)则
_______  ;常温下平衡常数K=
;常温下平衡常数K=_______ (用K1、K2来表示)
Ⅱ.四氧化二氮(N2O4)可作为运载火箭的推进剂,将4 mol N2O4放入2 L恒容密闭容器中发生反应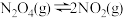 ,平衡体系中N2O4的体积分数(
,平衡体系中N2O4的体积分数( )随温度的变化如图所示:
)随温度的变化如图所示:
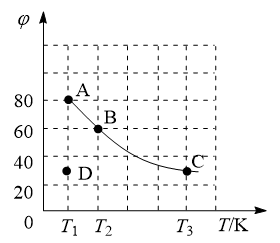
(2)D点v(正)_______ v(逆)(填“>”“=”或“<”)。
(3)A、B、C点中平衡常数K的值最大的是_______ 点。T2时,N2O4的平衡转化率为_______ ;若达平衡时间为5 s,则此时间内的N2O4平均反应速率为_______ 。
(4)若其条件不变,在 原平衡基础上,再加入一定量NO2,达到新平衡时,与原平衡相比,NO2的体积分数
原平衡基础上,再加入一定量NO2,达到新平衡时,与原平衡相比,NO2的体积分数_______ (填“增大”“不变”或“减小”)。
Ⅲ.碳的很多化合物在生产、生活中有广泛应用,对其进行综合利用是目前研究的热点之一。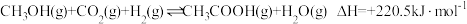 ;中科院化学所研究了该反应的反应历程,如图所示:
;中科院化学所研究了该反应的反应历程,如图所示:
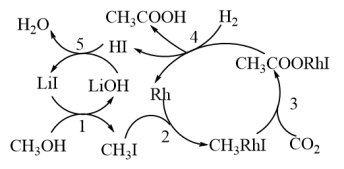
(5)反应历程中,能降低反应活化能的物质有_______ (填化学式);中间产物有_______ 种。
(6)第4步反应的化学方程式为_______ 。
Ⅰ.已知汽车气缸中氮及其化合物发生如下反应:
 (常温下平衡常数为K1)
(常温下平衡常数为K1)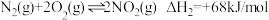 (常温下平衡常数为K2)
(常温下平衡常数为K2)(1)则
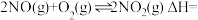
 ;常温下平衡常数K=
;常温下平衡常数K=Ⅱ.四氧化二氮(N2O4)可作为运载火箭的推进剂,将4 mol N2O4放入2 L恒容密闭容器中发生反应
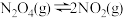 ,平衡体系中N2O4的体积分数(
,平衡体系中N2O4的体积分数( )随温度的变化如图所示:
)随温度的变化如图所示:
(2)D点v(正)
(3)A、B、C点中平衡常数K的值最大的是
(4)若其条件不变,在
 原平衡基础上,再加入一定量NO2,达到新平衡时,与原平衡相比,NO2的体积分数
原平衡基础上,再加入一定量NO2,达到新平衡时,与原平衡相比,NO2的体积分数Ⅲ.碳的很多化合物在生产、生活中有广泛应用,对其进行综合利用是目前研究的热点之一。
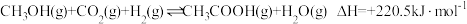 ;中科院化学所研究了该反应的反应历程,如图所示:
;中科院化学所研究了该反应的反应历程,如图所示:
(5)反应历程中,能降低反应活化能的物质有
(6)第4步反应的化学方程式为
您最近一年使用:0次
2022-01-15更新
|
190次组卷
|
4卷引用:福建省龙岩第一中学2021-2022学年高二下学期开学考化学试题
福建省龙岩第一中学2021-2022学年高二下学期开学考化学试题天津市和平区2021-2022学年高二上学期线上期末质量检测化学试题(已下线)专题03 化学反应的方向与化学反应的调控-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(天津专用)(已下线)专项02 化学反应速率与化学平衡-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(天津专用)
4 . 温室气体的利用是当前环境和能源领域的研究热点,合理利用燃料废气中的CO2,也是实现“碳中和”的途径之一、回答下列问题:
(1)CO2与CH4重整可以同时利用两种温室气体,过程中涉及如下反应:
I.CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH1=+247.41kJ·mol-1
2CO(g)+2H2(g) ΔH1=+247.41kJ·mol-1
Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
Ⅲ.CH4(g)+ O2(g)
O2(g)  CO(g)+2H2(g) ΔH3=-35.6kJ·mol-1
CO(g)+2H2(g) ΔH3=-35.6kJ·mol-1
①已知: O2(g)+H2(g)=H2O(g) ΔH=-241.8kJ·mol-1,则ΔH2=
O2(g)+H2(g)=H2O(g) ΔH=-241.8kJ·mol-1,则ΔH2=___________ kJ·mol-1。
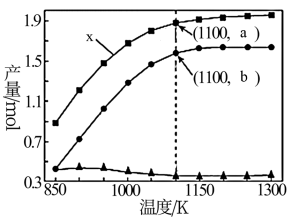
②一定条件下,向体积为V L的密闭容器中通入CH4、CO2各1.0mol及少量O2,测得不同温度下反应平衡时各产物产量如图所示,x曲线代表___________ (填化学式)产量变化,1100K时,CH4与CO2的转化率分别为95%和90%,反应I的平衡常数K=___________ (mol·L-1)2(写出计算式,用含a、b、V的代数式表示)。
I.CO2(g)+H2(g) HCOOH(g) ΔH1<0
HCOOH(g) ΔH1<0
II.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
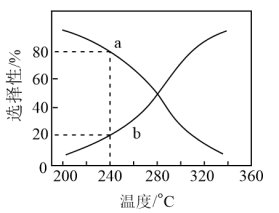
刚性容器中CO2(g)和H2(g)按物质的量1:1投料,平衡时HCOOH和CO的选择性随温度变化如图所示。___________ ,为同时提高CO2的平衡转化率和平衡时HCOOH的选择性,应选择的反应条件为___________ (填标号)。
A.低温、低压 B.高温、高压
C.高温、低压 D.低温、高压
②240℃时,容器内压强随温度的变化如下表:
反应I的速率可表示为v=k·p(CO2)·p(H2)(k为常数),则反应在60min时v=___________ (用含p0、k的式子表示)。
(1)CO2与CH4重整可以同时利用两种温室气体,过程中涉及如下反应:
I.CH4(g)+CO2(g)
 2CO(g)+2H2(g) ΔH1=+247.41kJ·mol-1
2CO(g)+2H2(g) ΔH1=+247.41kJ·mol-1Ⅱ.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2Ⅲ.CH4(g)+
 O2(g)
O2(g)  CO(g)+2H2(g) ΔH3=-35.6kJ·mol-1
CO(g)+2H2(g) ΔH3=-35.6kJ·mol-1①已知:
 O2(g)+H2(g)=H2O(g) ΔH=-241.8kJ·mol-1,则ΔH2=
O2(g)+H2(g)=H2O(g) ΔH=-241.8kJ·mol-1,则ΔH2=②一定条件下,向体积为V L的密闭容器中通入CH4、CO2各1.0mol及少量O2,测得不同温度下反应平衡时各产物产量如图所示,x曲线代表
I.CO2(g)+H2(g)
 HCOOH(g) ΔH1<0
HCOOH(g) ΔH1<0II.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2刚性容器中CO2(g)和H2(g)按物质的量1:1投料,平衡时HCOOH和CO的选择性随温度变化如图所示。
A.低温、低压 B.高温、高压
C.高温、低压 D.低温、高压
②240℃时,容器内压强随温度的变化如下表:
| 时间/ min | 0 | 20 | 40 | 60 | 80 |
| 压强/ MPa | P0 | 0.91 P0 | 0.85 P0 | 0.80 P0 | 0.80 P0 |
您最近一年使用:0次
2021-12-21更新
|
363次组卷
|
3卷引用:福建省厦门外国语学校石狮分校2022-2023学年高二下学期3月月考化学试题
福建省厦门外国语学校石狮分校2022-2023学年高二下学期3月月考化学试题山东省潍坊市2021-2022学年高三上学期学科核心素养测评化学试题(已下线)2022年新高考化学时事热点情境化考题---原理综合题
名校
解题方法
5 . 向 溶液中滴加盐酸,反应过程中能量变化如下图所示,下列说法正确的是
溶液中滴加盐酸,反应过程中能量变化如下图所示,下列说法正确的是

 溶液中滴加盐酸,反应过程中能量变化如下图所示,下列说法正确的是
溶液中滴加盐酸,反应过程中能量变化如下图所示,下列说法正确的是
A.反应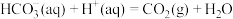 (1)为放热反应 (1)为放热反应 |
B. |
C.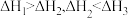 |
D. (1),若使用催化剂,则 (1),若使用催化剂,则 变小 变小 |
您最近一年使用:0次
2021-12-21更新
|
856次组卷
|
26卷引用:福建省泉州市第七中学 2020-2021学年高二上学期期中考试化学试题
福建省泉州市第七中学 2020-2021学年高二上学期期中考试化学试题宁夏银川一中2017-2018学年高二上学期第二次月考理综化学试题河北安平中学2018-2019学年高二下学期期末考试化学试题江西省南昌市新建县第一中学2019-2020学年高二上学期第一次月考化学试题(共建部)安徽省滁州市定远县炉桥中学2019-2020学年高二上学期第一次检测化学试题安徽省芜湖市2019-2020学年高二上学期期末考试化学(理)试题湖南省衡阳市第八中学2019-2020学年高二下学期期中考试化学试题鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第1章 综合检测陕西省西安市第八十九中学2018-2019学年高二上学期期中考试化学试题江西省彭泽县第一中学2020-2021学年高二上学期第一次月考化学试题江西省吉安县立中学2020-2021学年高二上学期期中考试化学试题辽宁省庄河市高级中学2021-2022学年高二上学期开学考试化学试题浙江省温州市2021-2022学年高二上学期12月普通高中学考适应性测试化学试题新疆乌鲁木齐第四中学2021-2022学年高二上学期期中考试化学试题内蒙古乌兰察布市2021-2022学年高二上学期期末考试化学试题山东省实验中学2022-2023学年高二上学期10月月考化学试题浙江省北斗星盟2023-2024学年高二上学期12月月考化学试题2017届天津市五区县高三上学期期末考试化学试卷天津市五区县2017届高三上学期期末考试化学试卷天津市2018届高三第二学期高考模拟化学试题山东省潍坊市2019-2020学年高一下学期4月阶段考试化学试题安徽省淮南市第一中学2019-2020学年高一下学期期末考试化学试题黑龙江省八校2021届高三摸底考试化学试题新疆维吾尔自治区巴州二中2021届高三第六次月考化学试题黑龙江省佳木斯市第一中学2022-2023学年高三上学期第三次调研化学试题湖南省常德市鼎城一中2022-2023学年高三第五次月考化学试题
6 . 向Na2CO3溶液中滴加盐酸,反应过程中能量变化如图所示,下列说法正确的是
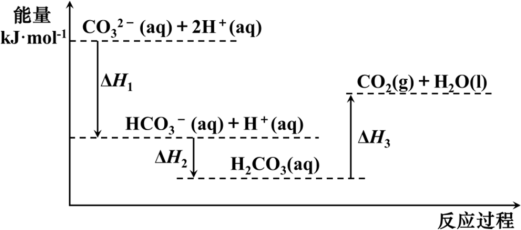

A.反应 (aq)+2H+(aq) = CO2(g)+H2O(l)为放热反应 (aq)+2H+(aq) = CO2(g)+H2O(l)为放热反应 |
| B.ΔH1>ΔH3>ΔH2 |
C. (aq)+H+(aq)=CO2(g)+H2O(l) ΔH = ΔH2—ΔH3 (aq)+H+(aq)=CO2(g)+H2O(l) ΔH = ΔH2—ΔH3 |
| D.H2CO3(aq)=CO2(g)+H2O(l) ΔH3 <0 |
您最近一年使用:0次
2021-12-06更新
|
361次组卷
|
4卷引用:福建省宁德市同心顺联盟校2021—2022学年高二上学期期中联考化学试题
名校
解题方法
7 . CO2催化加氢合成CH4的反应为CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH
已知:①CH4(g)+2O2(g)⇌CO2(g)+2H2O(g) ΔH1=-802.0kJ·mol-1
②CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
③2CO(g)+O2(g)⇌2CO2(g) ΔH3=-566.0kJ·mol-1
下列有关说法正确的是
已知:①CH4(g)+2O2(g)⇌CO2(g)+2H2O(g) ΔH1=-802.0kJ·mol-1
②CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
③2CO(g)+O2(g)⇌2CO2(g) ΔH3=-566.0kJ·mol-1
下列有关说法正确的是
| A.CH4的摩尔燃烧焓为802.0kJ·mol-1 |
| B.ΔH=+165.2kJ·mol-1 |
| C.使用催化剂是为了提高CO2加氢时原料的平衡转化率 |
| D.反应②能自发进行,其原因是ΔS>0 |
您最近一年使用:0次
2021-11-20更新
|
475次组卷
|
8卷引用:福建省三明市教研联盟校2021-2022学年高二上学期期中联考化学试题
福建省三明市教研联盟校2021-2022学年高二上学期期中联考化学试题江苏省南通市如皋中学2020-2021学年高二下学期第二次阶段考试化学试题(已下线)作业06 化学反应的调控-2021年高二化学暑假作业(人教版2019)(已下线)第二章 第四节 化学反应进行的方向(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)河南省洛阳市豫西名校2021-2022学年高二上学期第一次联考化学试题河北深州市长江中学2021-2022学年高二上学期10月月考化学(理)试题重庆育才中学2021-2022学年高二上学期第二次定时练习化学试题上海市行知中学2022-2023学年高二上学期期中考试化学(加试)试题
10-11高三上·北京石景山·期末
名校
8 . 已知下列热化学方程式:
①CH3COOH(l)+2O2(g)=2CO2(g) +2H2O(l) ΔH1=﹣870.3 kJ·mol-1
②C(s) +O2(g) =CO2(g) ΔH2=﹣393.5 kJ·mol-1
③H2(g) + O2(g) =H2O(l) ΔH3=﹣285.8 kJ·mol-1
O2(g) =H2O(l) ΔH3=﹣285.8 kJ·mol-1
则反应2C(s) +2H2(g) +O2(g)=CH3COOH(l)的焓变ΔH为
①CH3COOH(l)+2O2(g)=2CO2(g) +2H2O(l) ΔH1=﹣870.3 kJ·mol-1
②C(s) +O2(g) =CO2(g) ΔH2=﹣393.5 kJ·mol-1
③H2(g) +
 O2(g) =H2O(l) ΔH3=﹣285.8 kJ·mol-1
O2(g) =H2O(l) ΔH3=﹣285.8 kJ·mol-1则反应2C(s) +2H2(g) +O2(g)=CH3COOH(l)的焓变ΔH为
| A.﹣488.3 kJ·mol-1 | B.﹣224.15 kJ·mol-1 |
| C.488.3 kJ·mol-1 | D.244.15 kJ·mol-1 |
您最近一年使用:0次
2021-11-17更新
|
1511次组卷
|
90卷引用:【校级联考】福建省长汀、连城一中等六校2018-2019学年高二年上学期期中考联考化学试题
【校级联考】福建省长汀、连城一中等六校2018-2019学年高二年上学期期中考联考化学试题(已下线)2010年长春外国语学校高二第一学期期末考试化学试卷(已下线)2010-2011学年云南省昆明一中高二下学期期中考试化学试卷(已下线)2011-2012学年山东省济南外国语学校高二上学期期中考试化学(理)试卷(已下线)2011-2012学年湖南省凤凰县华鑫中学高二上12月月考化学试卷(已下线)2010-2011学年安徽省怀宁县高河中学高二下学期第二次月考化学试卷(已下线)2012-2013学年辽宁省盘锦市第二高级中学高二9月月考化学试卷(已下线)2012-2013学年江西省九江一中高二第一次月考化学试卷(已下线)2012-2013学年重庆市重庆一中高二上学期期中考试理科化学试卷(已下线)2012-2013学年广东省汕头市金山中学高二上学期期末考试化学试卷(已下线)2012-2013学年江苏省新马高级中学高二下学期期末考试化学试卷(已下线)2014年高二化学人教版选修四 4化学反应热的计算练习卷(已下线)2013-2014吉林省长春市十一中高二下学期期末考试化学试卷(已下线)2015届安徽望江中学同步课时练(人教选修4)1.3化学反应热的计算(已下线)2014-2015学年吉林省汪清县第六中学高二上学期期中考试化学试卷(已下线)2014秋安徽省黄山市屯溪一中高二上学期期中考试化学试卷2014-2015黑龙江省鸡西市龙东南四校高二上学期期末联考化学试卷2015-2016学年四川省雅安中学高二上期中考试化学试卷2015-2016学年宁夏育才中学高二上期末考试化学试卷2016-2017学年内蒙古集宁一中高二上期中化学试卷2016-2017学年广西宾阳中学高二上9月月考化学试卷2016-2017学年江西省宜春市奉新一中高二上月考一化学试卷甘肃省兰州第一中学2017-2018学年高二上学期第一次月考(9月)化学试题河南省南阳市七校2017-2018学年高二上学期第一次联考化学试题山东省济南市第一中学2017-2018学年高二10月阶段测试化学试题山东省济南第一中学2017-2018学年高二上学期期中考试化学试题陕西省西安市长安区第一中学2017-2018学年高二上学期第二次月考化学试题黑龙江省哈尔滨三中2017-2018学年高二上学期11月第一次验收考试化学试题安徽省凤阳县二中2018-2019学年高二下学期开学摸底考试化学试题(已下线)2019年8月30日 《每日一题》人教选修4——盖斯定律的应用河南省林州市第一中学2019-2020学年高二9月月考化学试题河南林州一中2019-2020学年高二上9月化学测试题湖北省黄冈市2019-2020学年高二10月月考化学试题海南省东方市八所中学2019-2020学年高二上学期第一次月考化学试题宁夏育才中学2019-2020学年高二上学期第一次月考化学试题安徽省肥东县第二中学2019-2020学年高二上学期期中考试化学试题吉林省油田第十一中学2019-2020学年高二上学期第一次月考化学试题辽宁省葫芦岛市第八高级中学2019-2020学年高二上学期期中考试化学试题山东省新泰市第二中学2019-2020学年高二上学期期中考试化学试题甘肃省临夏中学2019-2020学年高二上学期期中考试化学(理)试题山西省祁县第二中学校2019-2020学年高二上学期期中考试化学试题河南省开封市五县联考2019-2020学年高二上学期期末考试化学试题湖北省咸宁市崇阳一中2019-2020学年高二3月月考化学试题河南省安阳市林州市第一中学2020-2021学年高二上学期开学考试(实验班)化学试题(已下线)1.3.1+盖斯定律-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)【南昌新东方】9.湾里一中 梁莎河南省南阳市第十中学2020-2021学年高二上学期第一次月考化学试题青海省海西蒙古族藏族自治州德令哈市海西州高级中学2020-2021学年高二上学期期中考试化学试题江西宜春市第九中学2020-2021学年高二上学期第一次月考化学试题辽宁省营口市2020-2021学年高二上学期期末考试化学试题江西省抚州市崇仁第二中学2021-2022学年高二上学期第一次月考化学试题广东省深圳市宝安第一外国语学校2021-2022学年高二10月月考化学试题江西省南城第二中学2021-2022学年高二上学期第一次月考化学试题甘肃省庆阳市第六中学2021-2022学年高二上学期第一次月考化学(理)试题广东省清远市第一中学2021-2022学年高二上学期期中调研考试化学试题山东省泰安肥城市2021-2022学年高二上学期期中考试化学试题山西省太原市第五十六中学2021-2022学年高二上学期10月月考化学试题辽宁省本溪市第二高级中学2021-2022学年高二上学期期末考试化学试题陕西省渭南市咸林中学2021-2022学年高二上学期第三阶段检测化学试题内蒙古包头市第四中学2021-2022学年高二上学期期中考试化学试题陕西省渭南市富平县蓝光中学2021-2022学年高二上学期期末质量检测化学(理)试题山西省太原市第五十六中学2022-2023学年高二上学期10月联考化学试题广东省江门广雅中学2022-2023学年高二上学期期中考试化学试题新疆乌鲁木齐市第八中学2022-2023学年高二下学期第一次质量检测(开学摸底)化学试题广西南宁市2022-2023学年高二下学期开学考试化学试题四川省华蓥中学2023-2024学年高二上学期9月月考化学试题陕西省西安市周至县第四中学2023-2024学年高二上学期1月期末化学试题(已下线)北京市石景山区2010学年第一学期期末考试试卷(已下线)2011届浙江金华一中高三上学期期中考试化学试卷(已下线)2011届江西省吉安市高三第三次模拟考试(理综)化学部分(已下线)2012届山东省枣庄十八中高三10月份质量检测化学试卷(已下线)2012届北京市密云二中高三10月月考化学试卷(已下线)2011-2012学年陕西省宝鸡中学高一下学期期中考试化学试卷2015-2016学年辽宁省五校协作体高一下学期期中考试化学试卷2017届湖北省松滋市第一中学高三上学期9月月考化学试卷苏教版2017届高三单元精练检测六化学试题苏教版2017届高三单元精练检测六化学试题人教版2017届高三单元精练检测六化学试题(已下线)2018年9月12日 《每日一题》一轮复习-反应热的计算(已下线)考点08 化学反应中的热效应——备战2019年浙江新高考化学考点(已下线)2019年4月14日《每日一题》三轮复习—— 每周一测【全国百强校】河北省张家口市第一中学2018-2019学年高一下学期4月月考化学试题【全国百强校】广东省中山市第一中学2018-2019学年高一下学期第二次(5月)段考化学试题黑龙江省伊春市第二中学2018届高三上学期期中考试化学试题辽宁省葫芦岛市第八高级中学2020届高三10月月考化学试题陕西省榆林市第二中学2020届高三第四次模拟考试化学试题2019年秋高三化学复习强化练习—— 盖斯定律及其应用山西省实验中学2020届高三化学复习针对性试题集(四)内蒙古自治区呼和浩特市土默特左旗第一中学2019-2020学年高一下学期期末考试化学试题山东省海阳第一中学2023-2024学年高一下学期3月份月考化学试题
11-12高二上·河南许昌·阶段练习
名校
解题方法
9 . 已知热化学方程式:
H2O(g)=H2(g) + 1/2O2(g) △H = +241.8kJ/mol
H2(g)+ 1/2O2(g) = H2O(l) △H = -285.8kJ/mol
当1mol液态水变为水蒸气时,其热量变化是
H2O(g)=H2(g) + 1/2O2(g) △H = +241.8kJ/mol
H2(g)+ 1/2O2(g) = H2O(l) △H = -285.8kJ/mol
当1mol液态水变为水蒸气时,其热量变化是
| A.吸热88kJ | B.吸热2.44KJ | C.放热44kJ | D.吸热44KJ |
您最近一年使用:0次
2021-11-12更新
|
47次组卷
|
22卷引用:福建省福州格致鼓山中学、教院二附中、铜盘中学、十五中、十中2023-2024学年高二上学期期末联考化学试题
福建省福州格致鼓山中学、教院二附中、铜盘中学、十五中、十中2023-2024学年高二上学期期末联考化学试题(已下线)2011-2012年河南省长葛市第三实验高中高二上学期第一次月考化学试卷(已下线)2011-2012学年四川省雅安中学高二下学期3月月考化学试卷(已下线)2012-2013学年海南省农垦加来中学高二第一次月考化学试卷(已下线)2012-2013学年湖南省益阳市一中高二上学期期末考试理科化学试卷(已下线)2014-2015学年北京市第六十六中学高二上第一次质量检测化学试卷2014-2015四川省雅安中学高二下学期开学考试化学试卷2015-2016学年宁夏银川第九中学高二上学期期中测试化学试卷江西省南昌市第二中学2017-2018学年高二上学期第一次月考化学试题陕西省西安市电子科技中学2017-2018学年高二上学期第一次月考化学试题天津市杨柳青一中2017-2018第一学期高二第一次化学月考江西省九江市第一中学2017-2018学年高二上学期第二次月考化学试题(已下线)【南昌新东方】江西省九江第一中学2017-2018学年高二上学期第二次月考化学试题河北省邢台市第二中学2019-2020学年高二下学期开学考试化学试题江西省赣州市赣县区第三中学2020-2021学年高二(实验重点班)9月月考化学试题西藏拉萨市第二高级中学2019-2020学年高二上学期期中考试化学试题广西壮族自治区贺州市平桂高级中学(贺州市第五高级中学)2020-2021学年高二上学期第一次月考化学试题河南省长垣市第十中学2020-2021学年高二上学期第二次月考化学试题甘肃省庆阳市第六中学2021-2022学年高二上学期期中考试化学(理)试题四川省广安代市中学校2021-2022学年高二上学期第一次月考化学试题(已下线)2011-2012学年陕西省宝鸡中学高一下学期期中考试化学试卷2017届河北省石家庄辛集中学高三上期中化学试卷
10 . 化学链燃烧( )是利用载氧体将空气中的氧传输至燃料的新技术,与传统燃烧方式相比,避免了空气和燃料的直接接触,有利于高效捕集
)是利用载氧体将空气中的氧传输至燃料的新技术,与传统燃烧方式相比,避免了空气和燃料的直接接触,有利于高效捕集 。基于
。基于 载氧体的甲烷化学链燃烧技术示意图如下。
载氧体的甲烷化学链燃烧技术示意图如下。
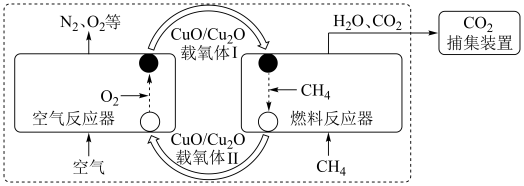
空气反应器与燃料反应器中发生的反应分别为:
①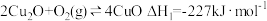
②
(1)反应

_______  。
。
(2)反应②的平衡常数表达式
_______ 。
(3)氧的质量分数:载氧体Ⅰ_______ (填“>”“=”或“<”)载氧体Ⅱ。
(4)往盛有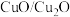 载氧体的刚性密闭容器中充入空气【氧气的物质的量分数
载氧体的刚性密闭容器中充入空气【氧气的物质的量分数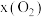 为21%】,发生反应①。平衡时
为21%】,发生反应①。平衡时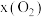 随反应温度T变化的曲线如图所示。
随反应温度T变化的曲线如图所示。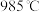 时
时 的平衡转化率
的平衡转化率
_______ (保留2位有效数字)。
(5)根据下图,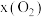 随温度升高而增大的原因是
随温度升高而增大的原因是_______ 。反应温度必须控制在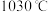 以下,原因是
以下,原因是_______ 。

(6)载氧体掺杂改性,可加快化学链燃烧速率。使用不同掺杂的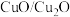 载氧体,反应②活化能如下表所示。
载氧体,反应②活化能如下表所示。
由表中数据判断:使用_______ (填“氧化铝”或“膨润土”)掺杂的载氧体反应较快;使用氧化铝或者膨润土掺杂的载氧体,单位时间内燃料反应器释放的热量分别为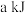 、
、 ,则a
,则a_______ b(填“>”“=”或“<”)。
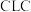 )是利用载氧体将空气中的氧传输至燃料的新技术,与传统燃烧方式相比,避免了空气和燃料的直接接触,有利于高效捕集
)是利用载氧体将空气中的氧传输至燃料的新技术,与传统燃烧方式相比,避免了空气和燃料的直接接触,有利于高效捕集 。基于
。基于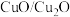 载氧体的甲烷化学链燃烧技术示意图如下。
载氧体的甲烷化学链燃烧技术示意图如下。
空气反应器与燃料反应器中发生的反应分别为:
①
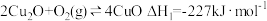
②

(1)反应


 。
。(2)反应②的平衡常数表达式

(3)氧的质量分数:载氧体Ⅰ
(4)往盛有
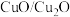 载氧体的刚性密闭容器中充入空气【氧气的物质的量分数
载氧体的刚性密闭容器中充入空气【氧气的物质的量分数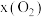 为21%】,发生反应①。平衡时
为21%】,发生反应①。平衡时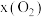 随反应温度T变化的曲线如图所示。
随反应温度T变化的曲线如图所示。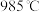 时
时 的平衡转化率
的平衡转化率
(5)根据下图,
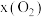 随温度升高而增大的原因是
随温度升高而增大的原因是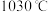 以下,原因是
以下,原因是
(6)载氧体掺杂改性,可加快化学链燃烧速率。使用不同掺杂的
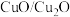 载氧体,反应②活化能如下表所示。
载氧体,反应②活化能如下表所示。| 载氧体掺杂物质 | 氧化铝 | 膨润土 |
活化能/ |  | 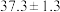 |
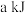 、
、 ,则a
,则a
您最近一年使用:0次
2021-11-09更新
|
5639次组卷
|
7卷引用:福建省龙岩第一中学2021-2022学年高二下学期开学考试(实验班)化学试题
福建省龙岩第一中学2021-2022学年高二下学期开学考试(实验班)化学试题福建省福州市福建师范大学附属中学2022-2023学年高二下学期期末化学试题2021年新高考福建化学高考真题北京市铁路第二中学2022-2023学年高二上学期期中检测化学试题(已下线)专题15 化学反应原理综合题-三年(2020-2022)高考真题分项汇编(已下线)专题17 原理综合题(已下线)专题17 原理综合题



