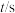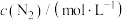1 . 完成下列小题
(1)已知:30g一氧化氮完全被氧气氧化放出57kJ的热量,且:

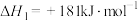


写出固体碳完全燃烧的热化学方程式_____ 。
(2)已知:
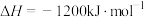 。一定温度下在体积为2L恒容密闭容器中,投入8molCO和4mol
。一定温度下在体积为2L恒容密闭容器中,投入8molCO和4mol ,经过一段时间后达到平衡状态,测得CO的转化率为50%,体系压强为P,则该温度下,该反应的
,经过一段时间后达到平衡状态,测得CO的转化率为50%,体系压强为P,则该温度下,该反应的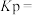
_____ (用平衡分压代替浓度计算,分压=总压×物质的量分数)。
(3)原煤经热解、冷却得到的煤焦可用于NO的脱除。热解温度为500℃、900℃得到的煤焦分别用S-500、S-900表示,相关信息如右表所示。将NO浓度恒定的废气以固定流速通过反应器(图1)。不同温度下,进行多组平行实验,测定相同时间内NO的出口浓度,可得NO的脱除率与温度的关系如图2所示。[已知:NO的脱除主要包含吸附和化学还原( )两个过程]
)两个过程]
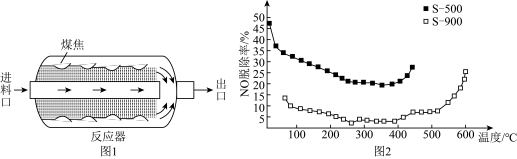
①已知煤焦表面存在的官能团有利于吸附NO,其数量与煤焦中氢碳质量比的值密切相关,比值小,表面官能团少。由图2可知,相同温度下,单位时间内S-500对NO的脱除率比S-900的高,可能原因是_____ 。(答两条)。
②350℃后,随着温度升高,单位时间内NO的脱除率增大的原因是_____ 。
(4)电解氧化吸收法:其原理如图3所示:
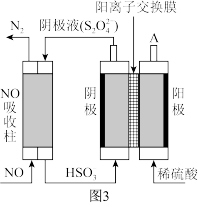
①从A口中出来的物质的是_____ 。
②写出电解池阴极的电极反应式_____ 。
(1)已知:30g一氧化氮完全被氧气氧化放出57kJ的热量,且:

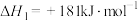


写出固体碳完全燃烧的热化学方程式
(2)已知:

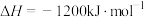 。一定温度下在体积为2L恒容密闭容器中,投入8molCO和4mol
。一定温度下在体积为2L恒容密闭容器中,投入8molCO和4mol ,经过一段时间后达到平衡状态,测得CO的转化率为50%,体系压强为P,则该温度下,该反应的
,经过一段时间后达到平衡状态,测得CO的转化率为50%,体系压强为P,则该温度下,该反应的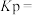
(3)原煤经热解、冷却得到的煤焦可用于NO的脱除。热解温度为500℃、900℃得到的煤焦分别用S-500、S-900表示,相关信息如右表所示。将NO浓度恒定的废气以固定流速通过反应器(图1)。不同温度下,进行多组平行实验,测定相同时间内NO的出口浓度,可得NO的脱除率与温度的关系如图2所示。[已知:NO的脱除主要包含吸附和化学还原(
 )两个过程]
)两个过程]| 煤焦 | 元素分析/% | 比表面积/(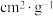 ) ) | |
| C | H | ||
| S-500 | 80.79 | 2.76 | 105.69 |
| S-900 | 84.26 | 0.82 | 8.98 |

①已知煤焦表面存在的官能团有利于吸附NO,其数量与煤焦中氢碳质量比的值密切相关,比值小,表面官能团少。由图2可知,相同温度下,单位时间内S-500对NO的脱除率比S-900的高,可能原因是
②350℃后,随着温度升高,单位时间内NO的脱除率增大的原因是
(4)电解氧化吸收法:其原理如图3所示:

①从A口中出来的物质的是
②写出电解池阴极的电极反应式
您最近一年使用:0次
名校
解题方法
2 . I.直接将CO2转化为有机物并非植物的“专利”,科学家通过多种途径实现了CO2合成甲醛,总反应为CO2(g)+2H2(g) HCHO(g)+H2O(g) ∆H。转化步骤如图1所示:
HCHO(g)+H2O(g) ∆H。转化步骤如图1所示:
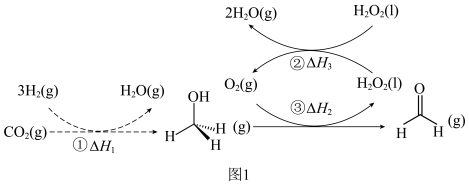
(1)已知2H2(g)+O2(g)=2H2O(g) ∆H4,则总反应的∆H=_______ (用图1中焓变以及∆H4表示)。
II.利用工业尾气(含硫氧化物与氮氧化物)制备Na2S2O4和NH4NO3,实现了“变废为宝”并保护了自然环境。如图是相关的工艺流程(Ce为铈元素,有Ce4+与Ce3+):
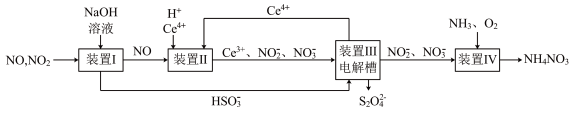
请回答下列问题:
(2)装置III中发生反应的离子方程式是:_______ 。
(3)日常生活中,常用硝酸铵和水,硝酸铵和水合碳酸钠作冷敷袋,试写出硝酸铵和水合碳酸钠(Na2CO3•10H2O)反应的化学方程式_______ (该反应中产生了两种气体)。
(4)已知,装置III中电解时,使用的电源为室温钠-硫电池,其结构如图所示。
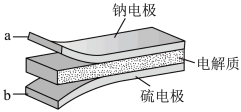
将钠箔置于聚苯并咪唑膜上作为一个电极,表面喷涂有硫黄粉末(S8)的炭化纤维素纸作为另一电极。工作时,在硫电极发生反应: S8+e-→
S8+e-→ S
S ,
, S
S +e-→S
+e-→S ,2Na++
,2Na++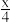 S
S +2(1-
+2(1-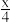 )e-→Na2Sx。该电池放电时正极反应式为
)e-→Na2Sx。该电池放电时正极反应式为_______ 。有人提出用常温下的液体甲醇一空气燃料电池(ZrO2作为固体电解质)替代钠-硫电池。当有0.5mol甲醇消耗时,负极消耗O2-为_______ mol;在O2不足时原电池会发生负极区固体电解质堵塞,导致堵塞的物质是_______ 。
 HCHO(g)+H2O(g) ∆H。转化步骤如图1所示:
HCHO(g)+H2O(g) ∆H。转化步骤如图1所示:
(1)已知2H2(g)+O2(g)=2H2O(g) ∆H4,则总反应的∆H=
II.利用工业尾气(含硫氧化物与氮氧化物)制备Na2S2O4和NH4NO3,实现了“变废为宝”并保护了自然环境。如图是相关的工艺流程(Ce为铈元素,有Ce4+与Ce3+):

请回答下列问题:
(2)装置III中发生反应的离子方程式是:
(3)日常生活中,常用硝酸铵和水,硝酸铵和水合碳酸钠作冷敷袋,试写出硝酸铵和水合碳酸钠(Na2CO3•10H2O)反应的化学方程式
(4)已知,装置III中电解时,使用的电源为室温钠-硫电池,其结构如图所示。

将钠箔置于聚苯并咪唑膜上作为一个电极,表面喷涂有硫黄粉末(S8)的炭化纤维素纸作为另一电极。工作时,在硫电极发生反应:
 S8+e-→
S8+e-→ S
S ,
, S
S +e-→S
+e-→S ,2Na++
,2Na++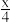 S
S +2(1-
+2(1-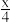 )e-→Na2Sx。该电池放电时正极反应式为
)e-→Na2Sx。该电池放电时正极反应式为
您最近一年使用:0次
3 . 研究氮氧化物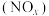 还原处理方法是环保领域的主要方向之一。上海复兴路的“生态马路”运用了“光触媒”技术,即在路面上涂了一层光催化剂涂料,可将汽车尾气中部分NO和
还原处理方法是环保领域的主要方向之一。上海复兴路的“生态马路”运用了“光触媒”技术,即在路面上涂了一层光催化剂涂料,可将汽车尾气中部分NO和 转化为
转化为 和
和 。
。
(1)在密闭容器中发生该反应,氮气浓度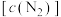 随温度
随温度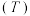 、时间
、时间 的变化关系如下表。
的变化关系如下表。
据此判断:
①
___________  (填“>”或“<”)。
(填“>”或“<”)。
② 时,
时, 内的
内的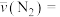
___________  。
。
(2)在绝热、恒容的密闭体系中充入一定量的 和
和 气体,反应达到平衡的标志是_______。
气体,反应达到平衡的标志是_______。
(3)计算机模拟 还原
还原 的反应经历以下3个步骤:
的反应经历以下3个步骤:
I: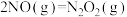
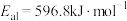
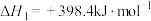
II:
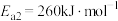
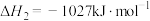
III :
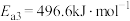
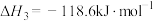
①反应过程的决速步骤是___________ (填“I”“II”或“III”)。
②总反应的热化学方程式为___________ 。
(4)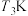 时,在刚性密闭容器中充入物质的量之比为
时,在刚性密闭容器中充入物质的量之比为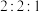 的
的 、
、 和
和 的混合气体,起始气体总压强为
的混合气体,起始气体总压强为 ,达到平衡时气体总压强为
,达到平衡时气体总压强为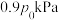 。实验测得:
。实验测得: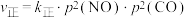 ,
,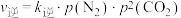 ,其中
,其中 、
、 分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=总压×物质的量分数)。
分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=总压×物质的量分数)。
①平衡后升高温度, 增大的倍数比
增大的倍数比 的
的___________ (填“大”或“小”)。
② 的平衡转化率为
的平衡转化率为___________ 。
③
___________ (用含 的代数式表示)。
的代数式表示)。
(5)该反应的某种催化剂的催化效率与NO的消耗速率随温度的变化关系如图所示。300~350℃之间,NO的消耗速率加快的原因是___________ 。

 还原处理方法是环保领域的主要方向之一。上海复兴路的“生态马路”运用了“光触媒”技术,即在路面上涂了一层光催化剂涂料,可将汽车尾气中部分NO和
还原处理方法是环保领域的主要方向之一。上海复兴路的“生态马路”运用了“光触媒”技术,即在路面上涂了一层光催化剂涂料,可将汽车尾气中部分NO和 转化为
转化为 和
和 。
。(1)在密闭容器中发生该反应,氮气浓度
 随温度
随温度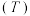 、时间
、时间 的变化关系如下表。
的变化关系如下表。
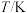 | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
 | 0 | 0.10 | 0.18 | 0.25 | 0.25 | 0.25 | 0.25 |
 | 0 | 0.08 | 0.15 | 0.21 | 0.26 | 0.29 | 0.29 |
①

 (填“>”或“<”)。
(填“>”或“<”)。②
 时,
时, 内的
内的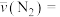
 。
。(2)在绝热、恒容的密闭体系中充入一定量的
 和
和 气体,反应达到平衡的标志是_______。
气体,反应达到平衡的标志是_______。| A.体系温度不变 | B. |
C. 的体积分数不变 的体积分数不变 | D. |
 还原
还原 的反应经历以下3个步骤:
的反应经历以下3个步骤:I:
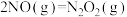
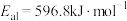
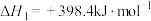
II:

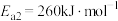
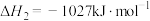
III :

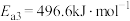
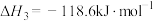
①反应过程的决速步骤是
②总反应的热化学方程式为
(4)
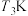 时,在刚性密闭容器中充入物质的量之比为
时,在刚性密闭容器中充入物质的量之比为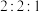 的
的 、
、 和
和 的混合气体,起始气体总压强为
的混合气体,起始气体总压强为 ,达到平衡时气体总压强为
,达到平衡时气体总压强为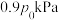 。实验测得:
。实验测得: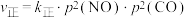 ,
,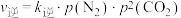 ,其中
,其中 、
、 分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=总压×物质的量分数)。
分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=总压×物质的量分数)。①平衡后升高温度,
 增大的倍数比
增大的倍数比 的
的②
 的平衡转化率为
的平衡转化率为③

 的代数式表示)。
的代数式表示)。(5)该反应的某种催化剂的催化效率与NO的消耗速率随温度的变化关系如图所示。300~350℃之间,NO的消耗速率加快的原因是

您最近一年使用:0次
名校
4 .  是主要的温室气体。利用
是主要的温室气体。利用 制甲烷(
制甲烷( )、甲醇(
)、甲醇( )、CO等燃料,可实现能源再生和
)、CO等燃料,可实现能源再生和 的资源化利用。
的资源化利用。
Ⅰ.利用太阳能分解水获得氢气,再通过 加氢制甲醇,反应如下:
加氢制甲醇,反应如下:
①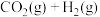



②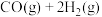


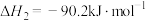
(1)反应①的平衡常数表达式
_______ ;
(2) 催化加氢制取
催化加氢制取 和
和 的热化学方程式是
的热化学方程式是_______ 。
Ⅱ.利用 与氢气反应制取甲烷。对于反应
与氢气反应制取甲烷。对于反应 ,不同温度下经过相同反应时间
,不同温度下经过相同反应时间 转化率的变化曲线如图所示。
转化率的变化曲线如图所示。

(3)请描述曲线( 转化率随着温度)变化趋势:
转化率随着温度)变化趋势:_______ ,该反应是_______ 反应(填“吸热”或“放热”)。
Ⅲ.甲烷的温室效应约为 的25倍,利用
的25倍,利用 重整技术能将二者同时转化为合成气CO和
重整技术能将二者同时转化为合成气CO和 而广受关注。该重整技术涉及的主要反应为:
而广受关注。该重整技术涉及的主要反应为:
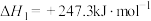 。
。
(4)为提高 的平衡转化率,可采取的措施为
的平衡转化率,可采取的措施为_______ (写出一条即可)。
(5)某温度下,向恒容容器中通入等物质的量的 和
和 ,初始总压强为p,反应达到平衡后,总压强变为1.6p,则该条件下的平衡常数
,初始总压强为p,反应达到平衡后,总压强变为1.6p,则该条件下的平衡常数
_______ (以分压表示,分压=总压×物质的量分数)。
 是主要的温室气体。利用
是主要的温室气体。利用 制甲烷(
制甲烷( )、甲醇(
)、甲醇( )、CO等燃料,可实现能源再生和
)、CO等燃料,可实现能源再生和 的资源化利用。
的资源化利用。Ⅰ.利用太阳能分解水获得氢气,再通过
 加氢制甲醇,反应如下:
加氢制甲醇,反应如下:①
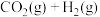



②
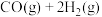


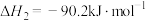
(1)反应①的平衡常数表达式

(2)
 催化加氢制取
催化加氢制取 和
和 的热化学方程式是
的热化学方程式是Ⅱ.利用
 与氢气反应制取甲烷。对于反应
与氢气反应制取甲烷。对于反应 ,不同温度下经过相同反应时间
,不同温度下经过相同反应时间 转化率的变化曲线如图所示。
转化率的变化曲线如图所示。
(3)请描述曲线(
 转化率随着温度)变化趋势:
转化率随着温度)变化趋势:Ⅲ.甲烷的温室效应约为
 的25倍,利用
的25倍,利用 重整技术能将二者同时转化为合成气CO和
重整技术能将二者同时转化为合成气CO和 而广受关注。该重整技术涉及的主要反应为:
而广受关注。该重整技术涉及的主要反应为:
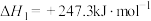 。
。(4)为提高
 的平衡转化率,可采取的措施为
的平衡转化率,可采取的措施为(5)某温度下,向恒容容器中通入等物质的量的
 和
和 ,初始总压强为p,反应达到平衡后,总压强变为1.6p,则该条件下的平衡常数
,初始总压强为p,反应达到平衡后,总压强变为1.6p,则该条件下的平衡常数
您最近一年使用:0次
2023-07-16更新
|
129次组卷
|
2卷引用:福建省宁德市区域性学业质量检测2022-2023学年高二上学期2月期末考试化学试题
名校
解题方法
5 . 火箭发射时可以用液态肼作燃料, 作氧化剂。相关物质的能量转化关系如下。已知
作氧化剂。相关物质的能量转化关系如下。已知
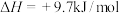 ,则
,则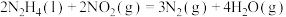 的反应热
的反应热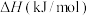 为
为
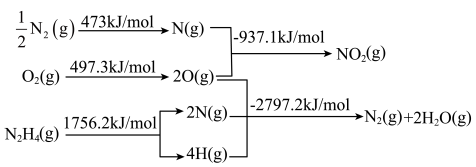
 作氧化剂。相关物质的能量转化关系如下。已知
作氧化剂。相关物质的能量转化关系如下。已知
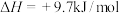 ,则
,则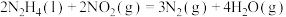 的反应热
的反应热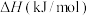 为
为
A.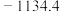 | B.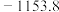 | C. | D.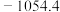 |
您最近一年使用:0次
2023-04-16更新
|
1809次组卷
|
9卷引用:福建省宁德第一中学2023-2024学年高二上学期9月月考化学试题
福建省宁德第一中学2023-2024学年高二上学期9月月考化学试题(已下线)第12练 有关反应热的综合考查 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)【知识图鉴】单元讲练测选择性必修1第1单元02基础练重庆市九龙坡区2022-2023学年高三学业质量调研抽测(第二次)化学试题(已下线)专题08 化学反应中的能量变化(已下线)专题09 化学反应中的热效应与反应机理-2023年高考化学真题题源解密(全国通用)新疆疏附县第一中学2023-2024学年高三上学期开学摸底测试化学试题(已下线)考点1 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)化学反应的热效应
名校
6 . 温室气体让地球发烧,倡导低碳生活,是一种可持续发展的环保责任,将CO2应用于生产中实现其综合利用是目前的研究热点。
I.在催化作用下由CO2和CH4转化为CH3COOH的反应历程示意图如图。
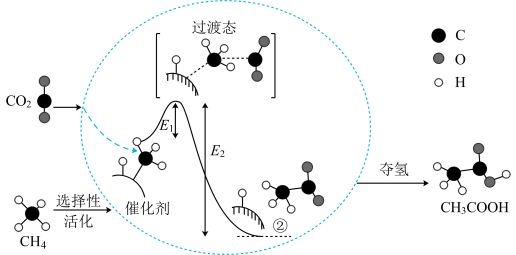
(1)在合成CH3COOH的反应历程中,下列有关说法正确的是_____ (填字母)。
II.以CO2、H2为原料制备“21世纪的清洁燃料”二甲醚(CH3OCH3)涉及的主要反应如下:
①2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H1=-122.5kJ/mol
CH3OCH3(g)+3H2O(g) △H1=-122.5kJ/mol
②CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.1kJ/mol
CO(g)+H2O(g) △H2=+41.1kJ/mol
(2)反应2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)的△H=
CH3OCH3(g)+H2O(g)的△H=_____ 。
(3)在压强、CO2和H2的起始投料一定的条件下,发生反应①、②,实验测得CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图所示。
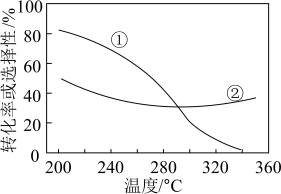
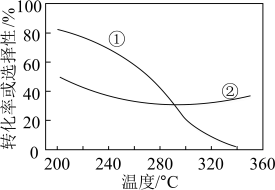
已知:CH3OCH3的选择性 ×100%,其中表示平衡时CH3OCH3的选择性的是‘曲线
×100%,其中表示平衡时CH3OCH3的选择性的是‘曲线______ (填“①”或“②”);温度高于300℃时,曲线②随温度升高而升高的原因是_____ ﹔为同时提高CO2的平衡转化率和平衡时CH3OCH3的选择性,应选择的反应条件为_____ (填标号)。
a.低温、低压 b.高温、高压 c.高温、低压 d.低温、高压
(4)以CO2、C2H6为原料合成C2H4的主要反应为:CO2(g)+C2H6(g) C2H4(g)+H2O(g)+CO(g) △H=+177kJ/mol。某温度下,在0.1MPa恒压密闭容器中充入等物质的量的CO2和C2H6,达到平衡时C2H4的物质的量分数为20%,该温度下反应的平衡常数Kp=
C2H4(g)+H2O(g)+CO(g) △H=+177kJ/mol。某温度下,在0.1MPa恒压密闭容器中充入等物质的量的CO2和C2H6,达到平衡时C2H4的物质的量分数为20%,该温度下反应的平衡常数Kp=_____ MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)写出铅蓄电池充电过程阳极的电极反应式为:_____ 。
(6)某熔融盐燃料电池是以熔融碳酸盐为电解质、乙醇为燃料、空气为氧化剂、稀土金属材料为电极的新型电池。该熔融盐电池负极的电极反应式为_____ 。
I.在催化作用下由CO2和CH4转化为CH3COOH的反应历程示意图如图。

(1)在合成CH3COOH的反应历程中,下列有关说法正确的是
| A.该催化剂使反应的平衡常数增大 |
| B.CH4→CH3COOH过程中,有C-H键断裂和C-C键形成 |
| C.生成乙酸的反应原子利用率100% |
| D.△H=E2-E1 |
II.以CO2、H2为原料制备“21世纪的清洁燃料”二甲醚(CH3OCH3)涉及的主要反应如下:
①2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) △H1=-122.5kJ/mol
CH3OCH3(g)+3H2O(g) △H1=-122.5kJ/mol②CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41.1kJ/mol
CO(g)+H2O(g) △H2=+41.1kJ/mol(2)反应2CO(g)+4H2(g)
 CH3OCH3(g)+H2O(g)的△H=
CH3OCH3(g)+H2O(g)的△H=(3)在压强、CO2和H2的起始投料一定的条件下,发生反应①、②,实验测得CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图所示。

已知:CH3OCH3的选择性
 ×100%,其中表示平衡时CH3OCH3的选择性的是‘曲线
×100%,其中表示平衡时CH3OCH3的选择性的是‘曲线a.低温、低压 b.高温、高压 c.高温、低压 d.低温、高压
(4)以CO2、C2H6为原料合成C2H4的主要反应为:CO2(g)+C2H6(g)
 C2H4(g)+H2O(g)+CO(g) △H=+177kJ/mol。某温度下,在0.1MPa恒压密闭容器中充入等物质的量的CO2和C2H6,达到平衡时C2H4的物质的量分数为20%,该温度下反应的平衡常数Kp=
C2H4(g)+H2O(g)+CO(g) △H=+177kJ/mol。某温度下,在0.1MPa恒压密闭容器中充入等物质的量的CO2和C2H6,达到平衡时C2H4的物质的量分数为20%,该温度下反应的平衡常数Kp=(5)写出铅蓄电池充电过程阳极的电极反应式为:
(6)某熔融盐燃料电池是以熔融碳酸盐为电解质、乙醇为燃料、空气为氧化剂、稀土金属材料为电极的新型电池。该熔融盐电池负极的电极反应式为
您最近一年使用:0次
解题方法
7 . 回答下列问题
(1)一定温度下,在0.5L密闭容器中充入 1molN2和 3molH2 发生反应:N2(g)+3H2(g) 2NH3(g) ΔH<0
2NH3(g) ΔH<0
①判断该反应的ΔS_____ 0 (填“>”、“<”或“=”);
②若容器容积恒定,达到平衡状态时,N2的物质的量为0.5mol,计算N2的转化率为__________ ,该反应的化学平衡常数K=________ 。
(2)对于反应 2NO(g)+O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
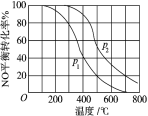
比较 P1、P2 的大小关系:P1________ P2(填“>”、“<”或“=”)。
②该反应的平衡常数 K 的表达式 为________ ,随温度升高,该反应平衡常数变化的趋势是________ 。(填“增大”、
“减小”或“不变”)。
③下列措施中能够同时满足增大反应速率和提高 NO 转化率的是________ 。(填写相应字母)
A.使用高效催化剂 B.保持容器体积不变加入惰性气体 C.保持容器体积不变加入 O2 D.降低温度 E.压缩容器体积
(3)已知同温同压下,下列反应的焓变和平衡常数分别表示为
式1:2SO2(g)+O2(g) 2SO3(g) ΔH1= - 197 kJ·mol-1 K1=a
2SO3(g) ΔH1= - 197 kJ·mol-1 K1=a
式2:2NO(g)+O2(g) 2NO2(g) ΔH2= -144 kJ·mol-1 K2=b
2NO2(g) ΔH2= -144 kJ·mol-1 K2=b
式3:NO2(g)+SO2(g) SO3(g)+NO(g) ΔH3=m kJ·mol-1 K3=c
SO3(g)+NO(g) ΔH3=m kJ·mol-1 K3=c
则m的数值为________ ,c与a、b之间的关系为__________ 。
(4)目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
在体积为2L的密闭容器中,充入1molCO2和3molH2,在相同温度、容积不变的条件下,能说明该反应已达平衡状态的是__________ (填序号)。
A.CO2、H2、CH3OH、H2O的浓度均不再变化 B.v生成(CH3OH)=v消耗(CO2)
C.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶1∶1∶1 D.容器中混合气体的密度保持不变
E.H2的消耗速率与CH3OH的消耗速率之比为3∶1
(1)一定温度下,在0.5L密闭容器中充入 1molN2和 3molH2 发生反应:N2(g)+3H2(g)
 2NH3(g) ΔH<0
2NH3(g) ΔH<0 ①判断该反应的ΔS
②若容器容积恒定,达到平衡状态时,N2的物质的量为0.5mol,计算N2的转化率为
(2)对于反应 2NO(g)+O2(g)
 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
比较 P1、P2 的大小关系:P1
②该反应的平衡常数 K 的
“减小”或“不变”)。
③下列措施中能够同时满足增大反应速率和提高 NO 转化率的是
A.使用高效催化剂 B.保持容器体积不变加入惰性气体 C.保持容器体积不变加入 O2 D.降低温度 E.压缩容器体积
(3)已知同温同压下,下列反应的焓变和平衡常数分别表示为
式1:2SO2(g)+O2(g)
 2SO3(g) ΔH1= - 197 kJ·mol-1 K1=a
2SO3(g) ΔH1= - 197 kJ·mol-1 K1=a式2:2NO(g)+O2(g)
 2NO2(g) ΔH2= -144 kJ·mol-1 K2=b
2NO2(g) ΔH2= -144 kJ·mol-1 K2=b式3:NO2(g)+SO2(g)
 SO3(g)+NO(g) ΔH3=m kJ·mol-1 K3=c
SO3(g)+NO(g) ΔH3=m kJ·mol-1 K3=c则m的数值为
(4)目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。在体积为2L的密闭容器中,充入1molCO2和3molH2,在相同温度、容积不变的条件下,能说明该反应已达平衡状态的是
A.CO2、H2、CH3OH、H2O的浓度均不再变化 B.v生成(CH3OH)=v消耗(CO2)
C.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶1∶1∶1 D.容器中混合气体的密度保持不变
E.H2的消耗速率与CH3OH的消耗速率之比为3∶1
您最近一年使用:0次
8 . 温室气体让地球发烧,倡导低碳生活,是一种可持续发展的环保责任,将 应用于生产中实现其综合利用是目前的研究热点。
应用于生产中实现其综合利用是目前的研究热点。
Ⅰ.在催化作用下由 和
和 转化为
转化为 的反应历程示意图如图。
的反应历程示意图如图。
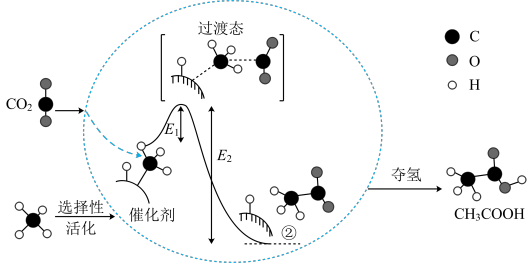
(1)在合成 的反应历程中,下列有关说法正确的是_______(填字母)。
的反应历程中,下列有关说法正确的是_______(填字母)。
II.以 为原料制备“21世纪的清洁燃料”二甲醚
为原料制备“21世纪的清洁燃料”二甲醚 涉及的主要反应如下:
涉及的主要反应如下:
①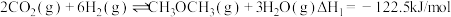
②
(2)反应 的
的
_______
(3)在压强、 和
和 的起始投料一定的条件下,发生反应①、②,实验测得
的起始投料一定的条件下,发生反应①、②,实验测得 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如图所示。
的选择性随温度的变化如图所示。
i.已知: 的选择性
的选择性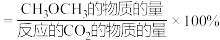 ,其中表示平衡时
,其中表示平衡时 的选择性的是曲线
的选择性的是曲线_______ (填“①”或“②”);温度高于300℃时,曲线②随温度升高而升高的原因是_______ ﹔
ii.为同时提高 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性,应选择的反应条件为
的选择性,应选择的反应条件为_______ (填标号)。
a.低温、低压 b.高温、高压 c.高温、低压 d.低温、高压
Ⅲ.以 为原料合成的主要反应为:
为原料合成的主要反应为: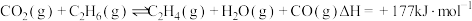
(4)某温度下,在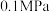 恒压密闭容器中充入等物质的量的
恒压密闭容器中充入等物质的量的 和
和 ,达到平衡时
,达到平衡时 的物质的量分数为20%,该温度下反应的平衡常数
的物质的量分数为20%,该温度下反应的平衡常数
_______  (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
Ⅳ.以稀硫酸为电解质,由甲醇 构成的原电池作电解饱和食盐水(电解池中左右两室均为
构成的原电池作电解饱和食盐水(电解池中左右两室均为 的
的 溶液)的电源。
溶液)的电源。
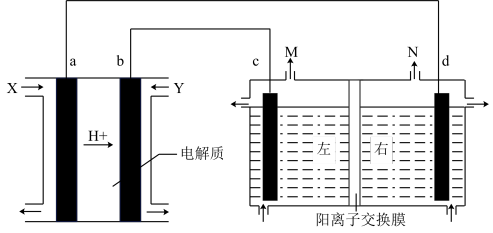
(5)电解饱和食盐水装置中溶液中的阳离子由_______ (填“左向右”或“右向左”)移动,a电极的电极反应式为_______ 。
(6)室温下,当电解池中共产生 (已折算成标况下)气体时,右室溶液(体积变化忽略不计)的
(已折算成标况下)气体时,右室溶液(体积变化忽略不计)的 为
为_______ 。
 应用于生产中实现其综合利用是目前的研究热点。
应用于生产中实现其综合利用是目前的研究热点。Ⅰ.在催化作用下由
 和
和 转化为
转化为 的反应历程示意图如图。
的反应历程示意图如图。
(1)在合成
 的反应历程中,下列有关说法正确的是_______(填字母)。
的反应历程中,下列有关说法正确的是_______(填字母)。| A.该催化剂使反应的平衡常数增大 |
B. 过程中,有C-H键断裂和C-C键形成 过程中,有C-H键断裂和C-C键形成 |
| C.生成乙酸的反应原子利用率100% |
D.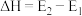 |
II.以
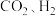 为原料制备“21世纪的清洁燃料”二甲醚
为原料制备“21世纪的清洁燃料”二甲醚 涉及的主要反应如下:
涉及的主要反应如下:①
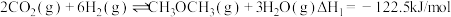
②

(2)反应
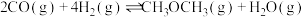 的
的
(3)在压强、
 和
和 的起始投料一定的条件下,发生反应①、②,实验测得
的起始投料一定的条件下,发生反应①、②,实验测得 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如图所示。
的选择性随温度的变化如图所示。
i.已知:
 的选择性
的选择性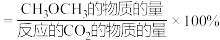 ,其中表示平衡时
,其中表示平衡时 的选择性的是曲线
的选择性的是曲线ii.为同时提高
 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性,应选择的反应条件为
的选择性,应选择的反应条件为a.低温、低压 b.高温、高压 c.高温、低压 d.低温、高压
Ⅲ.以
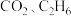 为原料合成的主要反应为:
为原料合成的主要反应为: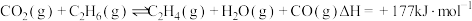
(4)某温度下,在
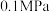 恒压密闭容器中充入等物质的量的
恒压密闭容器中充入等物质的量的 和
和 ,达到平衡时
,达到平衡时 的物质的量分数为20%,该温度下反应的平衡常数
的物质的量分数为20%,该温度下反应的平衡常数
 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数) Ⅳ.以稀硫酸为电解质,由甲醇
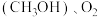 构成的原电池作电解饱和食盐水(电解池中左右两室均为
构成的原电池作电解饱和食盐水(电解池中左右两室均为 的
的 溶液)的电源。
溶液)的电源。
(5)电解饱和食盐水装置中溶液中的阳离子由
(6)室温下,当电解池中共产生
 (已折算成标况下)气体时,右室溶液(体积变化忽略不计)的
(已折算成标况下)气体时,右室溶液(体积变化忽略不计)的 为
为
您最近一年使用:0次
名校
解题方法
9 . 回答下列问题:
(1)25℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
则该温度下,
_______  ;
;
_______ (用 和
和 表示)。
表示)。
(2)25℃时,在体积为 的恒容密闭容器中通入
的恒容密闭容器中通入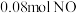 和
和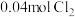 发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强
发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强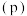 随时间
随时间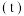 的变化如图Ⅰ实线所示,则
的变化如图Ⅰ实线所示,则
_______ (填“>”“<”或“=”)0;若其他条件相同,仅改变某一条件,测得其压强随时间的变化如图Ⅰ虚线所示,则改变的条件是_______ ;在 时,再充入
时,再充入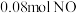 和
和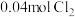 ,则混合气体的平均相对分子质量将
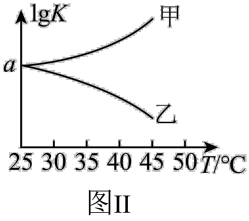
,则混合气体的平均相对分子质量将_______ (填“增大”、“减小”或“不变”)。图Ⅱ是甲、乙两同学描绘上述反应③的平衡常数的对数值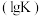 与温度的变化关系图,其中正确的曲线是
与温度的变化关系图,其中正确的曲线是_______ (填“甲”或“乙”),a值为_______ 。25℃时测得反应③在某时刻, 、
、 、
、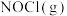 的浓度分别为0.7、0.1、0.3,则此时
的浓度分别为0.7、0.1、0.3,则此时
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
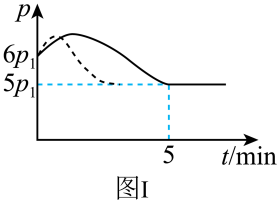
(3)在300℃、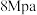 下,将
下,将 和
和 按物质的量之比
按物质的量之比 通入一密闭容器中发生
通入一密闭容器中发生 中反应,达到平衡时,测得
中反应,达到平衡时,测得 的平衡转化率为50%,则该反应条件下的平衡常数为
的平衡转化率为50%,则该反应条件下的平衡常数为
_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(1)25℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
| 热化学方程式 | 平衡常数 | |
| ① | 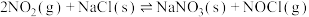  |  |
| ② | 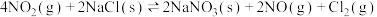 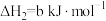 |  |
| ③ |   |  |

 ;
;
 和
和 表示)。
表示)。(2)25℃时,在体积为
 的恒容密闭容器中通入
的恒容密闭容器中通入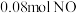 和
和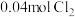 发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强
发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强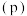 随时间
随时间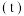 的变化如图Ⅰ实线所示,则
的变化如图Ⅰ实线所示,则
 时,再充入
时,再充入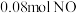 和
和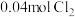 ,则混合气体的平均相对分子质量将
,则混合气体的平均相对分子质量将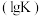 与温度的变化关系图,其中正确的曲线是
与温度的变化关系图,其中正确的曲线是 、
、 、
、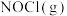 的浓度分别为0.7、0.1、0.3,则此时
的浓度分别为0.7、0.1、0.3,则此时
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。

(3)在300℃、
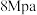 下,将
下,将 和
和 按物质的量之比
按物质的量之比 通入一密闭容器中发生
通入一密闭容器中发生 中反应,达到平衡时,测得
中反应,达到平衡时,测得 的平衡转化率为50%,则该反应条件下的平衡常数为
的平衡转化率为50%,则该反应条件下的平衡常数为
您最近一年使用:0次
2022-11-10更新
|
141次组卷
|
9卷引用:【全国百强校】福建省师范大学附属中学2018-2019学年高二(理)上学期期中考试化学试题
【全国百强校】福建省师范大学附属中学2018-2019学年高二(理)上学期期中考试化学试题【全国百强校】福建省师范大学附属中学2018-2019学年高二(实验班)上学期期中考试化学试题安徽省皖北名校2020-2021学年高二上学期第一次联考化学试题江西省赣州市南康中学2020-2021学年高二上学期第二次大考化学试题河北省邯郸市联盟校2020-2021学年高二上学期期中考试化学试题陕西省汉中市洋县中学2022-2023学年高二上学期期中考试化学试题内蒙古赤峰市第四中学分校2021-2022学年高二上学期9月月考化学试题安徽省滁州市定远县育才学校2021-2022学年高二(实验班)下学期开学摸底考试化学试题河北省石家庄市第二中学2019-2020学年高一下学期期末考试化学试题
名校
10 . 二甲醚( )是重要的化工原料,也是一种清洁的能源,可用
)是重要的化工原料,也是一种清洁的能源,可用 和
和 制得,由合成气制备二甲醚的主要原理如下:
制得,由合成气制备二甲醚的主要原理如下:
①
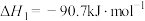

②
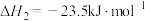

③
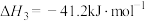

(1)反应 的
的
_______  ;该反应的平衡常数
;该反应的平衡常数
_______ (用 、
、 、
、 表示)。
表示)。
(2)下列措施中,能提高①中 产率的有_______。
产率的有_______。
(3)将合成气以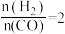 通入
通入 的反应器中,一定条件下发生反应:
的反应器中,一定条件下发生反应:
 ,其中
,其中 的平衡转化率随温度、压强的变化关系如图所示,下列说法正确的是
的平衡转化率随温度、压强的变化关系如图所示,下列说法正确的是_______ (填字母)。

A.
B.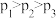
C. 若在 和316℃时,起始时
和316℃时,起始时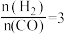 ,则平衡时,
,则平衡时,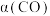 小于50%
小于50%
(4)采用一种新型的催化剂(主要成分是 的合金),利用
的合金),利用 和
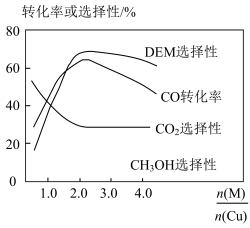
和 制备二甲醚(DME)。观察图,当
制备二甲醚(DME)。观察图,当 约为
约为_______ 时最有利于二甲醚的合成。
(5)下图为绿色电源“二甲醚燃料电池”的工作原理示意图,a极生成的气体是_______ ,b电极的电极反应式为_______ 。

(6)甲醇液相脱水法制二甲醚的原理是: ,
, 。与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是
。与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是_______ 。
 )是重要的化工原料,也是一种清洁的能源,可用
)是重要的化工原料,也是一种清洁的能源,可用 和
和 制得,由合成气制备二甲醚的主要原理如下:
制得,由合成气制备二甲醚的主要原理如下:①

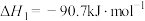

②

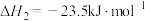

③

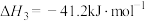

(1)反应
 的
的
 ;该反应的平衡常数
;该反应的平衡常数
 、
、 、
、 表示)。
表示)。(2)下列措施中,能提高①中
 产率的有_______。
产率的有_______。A.使用过量的 | B.升高温度 | C.增大压强 | D.使用催化剂 |
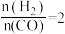 通入
通入 的反应器中,一定条件下发生反应:
的反应器中,一定条件下发生反应:
 ,其中
,其中 的平衡转化率随温度、压强的变化关系如图所示,下列说法正确的是
的平衡转化率随温度、压强的变化关系如图所示,下列说法正确的是
A.

B.
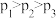
C. 若在
 和316℃时,起始时
和316℃时,起始时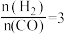 ,则平衡时,
,则平衡时,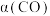 小于50%
小于50%(4)采用一种新型的催化剂(主要成分是
 的合金),利用
的合金),利用 和
和 制备二甲醚(DME)。观察图,当
制备二甲醚(DME)。观察图,当 约为
约为
(5)下图为绿色电源“二甲醚燃料电池”的工作原理示意图,a极生成的气体是

(6)甲醇液相脱水法制二甲醚的原理是:
 ,
, 。与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是
。与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是
您最近一年使用:0次
2022-10-27更新
|
226次组卷
|
2卷引用:福建省厦门第一中学2022-2023学年高二上学期第一次月考化学试题