1 . 纳米级Cu2O由于具有优良的催化性能而受关注,表中为制取Cu2O的两种方法:
(1)工业上常用方法b制取Cu2O而很少用方法a,其原因是反应条件不易控制,若控温不当易生成____ 而使Cu2O产率降低。
(2)已知:①2Cu(s)+ O2(g)=Cu2O(s) △H1=-169kJ·mol-1
O2(g)=Cu2O(s) △H1=-169kJ·mol-1
②C(s)+ O2(g)=CO(g) △H2=-110.5kJ·mol-1
O2(g)=CO(g) △H2=-110.5kJ·mol-1
③Cu(s)+ O2(g)=CuO(s) △H3=-157kJ·mol-1
O2(g)=CuO(s) △H3=-157kJ·mol-1
则方法a中发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g) △H=____ 。
(3)方法b是用液态肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH—的浓度来制备纳米Cu2O,装置如图所示:
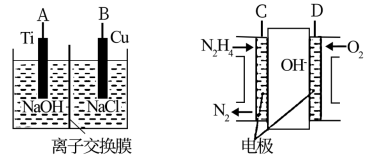
①上述装置中B电极应连____ (填“C”或“D”)电极。
②该离子交换膜为____ (填“阴”或“阳”)离子交换膜,该电解池的阴极反应式____ 。
③原电池中负极反应式为____ 。
| 方法a | 用炭粉在高温条件下还原CuO |
| 方法b | 电解法,反应为2Cu+H2O Cu2O+H2↑ Cu2O+H2↑ |
(1)工业上常用方法b制取Cu2O而很少用方法a,其原因是反应条件不易控制,若控温不当易生成
(2)已知:①2Cu(s)+
 O2(g)=Cu2O(s) △H1=-169kJ·mol-1
O2(g)=Cu2O(s) △H1=-169kJ·mol-1②C(s)+
 O2(g)=CO(g) △H2=-110.5kJ·mol-1
O2(g)=CO(g) △H2=-110.5kJ·mol-1③Cu(s)+
 O2(g)=CuO(s) △H3=-157kJ·mol-1
O2(g)=CuO(s) △H3=-157kJ·mol-1则方法a中发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g) △H=
(3)方法b是用液态肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH—的浓度来制备纳米Cu2O,装置如图所示:

①上述装置中B电极应连
②该离子交换膜为
③原电池中负极反应式为
您最近一年使用:0次
名校
2 . 氮及其化合物在科研及生产中均有者重要的应用。根据学知识回答下列问题:
(1)氨气与氧气在一定压强和800℃条件下发生催化氧化反应时,可发生不同反应,
反应i:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905kJ·mol-1 产率98%
4NO(g)+6H2O(g) △H=-905kJ·mol-1 产率98%
反应ii:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H=-1268kJ·mol-1产率2%
2N2(g)+6H2O(g) △H=-1268kJ·mol-1产率2%
①该条件下氮气被氧气氧化为NO的热化学方程式为_______ 。
②在一定压强和800℃条件下发生催化氧化反应时,反应i的产率大于反应ii产率的原因可能是催化剂对反应i的_______ 比反应ii大。
③反应i与反应ii有关物质产率与温度的关系如图。下列说法正确的是_______ (填序号)。
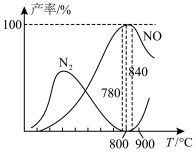
A.氨催化氧化生成NO时,温度应控制在780~840℃之间
B.提高物料比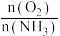 的值,主要目的的是提高反应速率
的值,主要目的的是提高反应速率
C.对反应加压可提高反应物转化率
D.高于900℃时NO的产率降低的原因可能与高温下催化剂的活性降低有关
(2)某科研小组向一密闭容器中通入4molN2、2molO2(g),控制适当条件使其发生如下反应:2N2(g)+O2(g) 2N2O(g) △H>0,测出O2的某种平衡物理量X(体积百分数或转化率)随着温度、压强变化而变化的情况如图所示。
2N2O(g) △H>0,测出O2的某种平衡物理量X(体积百分数或转化率)随着温度、压强变化而变化的情况如图所示。
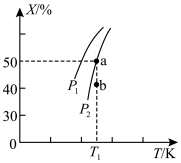
X_______ (填“能”或“不能”)表示平衡体系中O2的体积百分数;b点浓度商Qc与对应温度下的K比较:Qc_______ K(填“>”“=”或“<”)。
(3)为了研究反应的热效应,我国的科研人员计算了在一定范围内下列反应的平衡常数Kp。
i.N2H4(1) N2(g)+2H2(g) △H0 Kp0
N2(g)+2H2(g) △H0 Kp0
ii.N2H4(1)
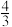 NH3(g)+
NH3(g)+ N2(g) △H1 Kp1
N2(g) △H1 Kp1
iii.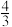 NH3(g)
NH3(g) 
 N2(g)+2H2(g) △H2Kp2
N2(g)+2H2(g) △H2Kp2
①t℃时,在恒容容器中,加入足量N2H4(1)发生反应i和ii。平衡时,测得容器内压强为22kPa,p(H2)=p(NH3),反应i的平衡常数Kp0=_______ kPa3。
②若①中反应平衡后,保持温度不变,将反应容器容积扩大2倍,反应再次平衡后,c(N2)相比原平衡时_______ (填“增大”“减小”或“不变”)。
③1gKp1-T和lgKp2-T的线性关系图如下图所示,据此分析:
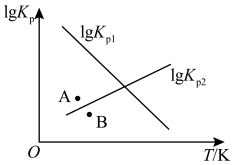
△H0_______ (填“大于”或“小于”)0;对于反应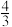 NH3(g)
NH3(g) 
 N2(g)+2H2(g),图中v正(A)
N2(g)+2H2(g),图中v正(A)_______ v正(B)(填“大于”“小于”或“等于”)。
(1)氨气与氧气在一定压强和800℃条件下发生催化氧化反应时,可发生不同反应,
反应i:4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) △H=-905kJ·mol-1 产率98%
4NO(g)+6H2O(g) △H=-905kJ·mol-1 产率98%反应ii:4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) △H=-1268kJ·mol-1产率2%
2N2(g)+6H2O(g) △H=-1268kJ·mol-1产率2%①该条件下氮气被氧气氧化为NO的热化学方程式为
②在一定压强和800℃条件下发生催化氧化反应时,反应i的产率大于反应ii产率的原因可能是催化剂对反应i的
③反应i与反应ii有关物质产率与温度的关系如图。下列说法正确的是

A.氨催化氧化生成NO时,温度应控制在780~840℃之间
B.提高物料比
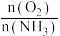 的值,主要目的的是提高反应速率
的值,主要目的的是提高反应速率C.对反应加压可提高反应物转化率
D.高于900℃时NO的产率降低的原因可能与高温下催化剂的活性降低有关
(2)某科研小组向一密闭容器中通入4molN2、2molO2(g),控制适当条件使其发生如下反应:2N2(g)+O2(g)
 2N2O(g) △H>0,测出O2的某种平衡物理量X(体积百分数或转化率)随着温度、压强变化而变化的情况如图所示。
2N2O(g) △H>0,测出O2的某种平衡物理量X(体积百分数或转化率)随着温度、压强变化而变化的情况如图所示。
X
(3)为了研究反应的热效应,我国的科研人员计算了在一定范围内下列反应的平衡常数Kp。
i.N2H4(1)
 N2(g)+2H2(g) △H0 Kp0
N2(g)+2H2(g) △H0 Kp0ii.N2H4(1)

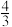 NH3(g)+
NH3(g)+ N2(g) △H1 Kp1
N2(g) △H1 Kp1iii.
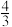 NH3(g)
NH3(g) 
 N2(g)+2H2(g) △H2Kp2
N2(g)+2H2(g) △H2Kp2①t℃时,在恒容容器中,加入足量N2H4(1)发生反应i和ii。平衡时,测得容器内压强为22kPa,p(H2)=p(NH3),反应i的平衡常数Kp0=
②若①中反应平衡后,保持温度不变,将反应容器容积扩大2倍,反应再次平衡后,c(N2)相比原平衡时
③1gKp1-T和lgKp2-T的线性关系图如下图所示,据此分析:

△H0
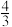 NH3(g)
NH3(g) 
 N2(g)+2H2(g),图中v正(A)
N2(g)+2H2(g),图中v正(A)
您最近一年使用:0次
2022-06-02更新
|
641次组卷
|
2卷引用:福建省质优生“筑梦”联考2022-2023学年高二下学期化学试题
名校
3 . CH3OH是一种重要的化工原料,可由CO或CO2与H2反应合成,在密闭容器内发生的主要反应如下,其平衡常数的自然对数lnKp(Kp是以分压表示的平衡常数,分压=总压×物质的量分数)随温度的变化如下图所示:
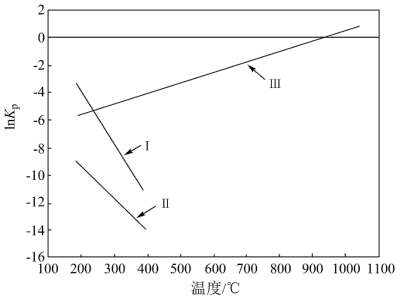
I.CO(g)+ 2H2(g) CH3OH(g) Kp(I)
CH3OH(g) Kp(I)
II.CO2(g)+ 3H2(g) CH3OH(g)+H2O(g) Kp(II)
CH3OH(g)+H2O(g) Kp(II)
III.CO2(g)+H2(g) CO(g)+H2O(g) Kp(III)
CO(g)+H2O(g) Kp(III)
(1)△H>0的反应是_______ (填标号)。
(2)反应III的Kp(III)_______ [用含 Kp(I)、Kp(II)的代数式表示]。
(3)若图中A点时发生反应CH3OH(g)+CO2(g) 2CO(g)+H2(g)+H2O(g),则其lnKp=
2CO(g)+H2(g)+H2O(g),则其lnKp=_______ (填数值)。
(4)在某催化剂催化和3.6×104kPa下,由CO2和H2在密闭容器内合成甲醇,反应相同时间时,甲醇的选择性([S(CH3OH)]、CO2的转化率[X(CO2)]及CO的选择性[S(CO)]与温度的关系如图所示:

①实际生产中选择260°C的原因,除X(CO2)最大外,还有_______ 。
②温度高于260°C时,升高温度X(CO2)减小的原因是_______ (从反应II、III 的平衡移动角度分析)。
(5)某合成气只含CO、H2 且n(CO):n(H2)=1: m,在温度t、压强p条件下在密闭容器内进行反应I,若CO平衡转化率为α,则平衡常数Kp(I)=_______ (用含m、α、 p的代数式表示)。
(6)某实验室采用真空封管法制备磷化硼纳米颗粒,成功的实现了高选择性电催化还原CO2制备甲醇,该反应历程如图所示。

容易得到的副产物有CO和CH2O,其中相对较少的副产物为_______ ;上述合成甲醇的反应速率较慢,要使反应速率加快,需要降低某步骤的能量变化,写出该基元反应的化学方程式:_______ 。

I.CO(g)+ 2H2(g)
 CH3OH(g) Kp(I)
CH3OH(g) Kp(I)II.CO2(g)+ 3H2(g)
 CH3OH(g)+H2O(g) Kp(II)
CH3OH(g)+H2O(g) Kp(II)III.CO2(g)+H2(g)
 CO(g)+H2O(g) Kp(III)
CO(g)+H2O(g) Kp(III)(1)△H>0的反应是
(2)反应III的Kp(III)
(3)若图中A点时发生反应CH3OH(g)+CO2(g)
 2CO(g)+H2(g)+H2O(g),则其lnKp=
2CO(g)+H2(g)+H2O(g),则其lnKp=(4)在某催化剂催化和3.6×104kPa下,由CO2和H2在密闭容器内合成甲醇,反应相同时间时,甲醇的选择性([S(CH3OH)]、CO2的转化率[X(CO2)]及CO的选择性[S(CO)]与温度的关系如图所示:

①实际生产中选择260°C的原因,除X(CO2)最大外,还有
②温度高于260°C时,升高温度X(CO2)减小的原因是
(5)某合成气只含CO、H2 且n(CO):n(H2)=1: m,在温度t、压强p条件下在密闭容器内进行反应I,若CO平衡转化率为α,则平衡常数Kp(I)=
(6)某实验室采用真空封管法制备磷化硼纳米颗粒,成功的实现了高选择性电催化还原CO2制备甲醇,该反应历程如图所示。

容易得到的副产物有CO和CH2O,其中相对较少的副产物为
您最近一年使用:0次
名校
4 . 回答下列问题:
(1)肼(N2H4)常用于火箭或原电池的燃料。
已知:I.N2(g)+2O2(g) 2NO2(g) ΔH = + 67.7 kJ·mol-1
2NO2(g) ΔH = + 67.7 kJ·mol-1
II.2N2H4(g)+2O2(g) 2N2(g)+4H2O(g) △H = -1068 kJ·mol-1
2N2(g)+4H2O(g) △H = -1068 kJ·mol-1
①请写出N2H4和NO2反应的热化学方程式_______ ;
②一定温度下,将N2H4与NO2以体积比1:1 置于10L密闭容器中发生上述①中的反应,下列选项不能说明反应达到平衡状态的是_______ 。
a.混合气体密度保持不变
b.混合气体颜色保持不变
c.N2H4与NO2体积之比保持不变
d.体系压强保持不变
(2)肼为二元弱碱,其在水中的电离方程式与氨气类似
①肼的水溶液呈碱性的原因_______ (请用肼在水中的一级电离方程式表示)
②已知在相同条件下肼的电离程度大于N2H 的水解程度。常温下,若0.2 mol·L-1N2H4溶液与0.1 mol·L-1HCl溶液等体积混合,则溶液中N2H
的水解程度。常温下,若0.2 mol·L-1N2H4溶液与0.1 mol·L-1HCl溶液等体积混合,则溶液中N2H 、N2H4·H2O、Cl-、OH-、 H+粒子浓度由大到小的顺序为
、N2H4·H2O、Cl-、OH-、 H+粒子浓度由大到小的顺序为_______ 。
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,水溶液呈酸性,水解原理与NH4Cl类似。已知盐酸肼第一步水解反应的离子方程式为N2H +H2O
+H2O  [N2H5·H2O]++H+ 。盐酸肼水溶液中离子浓度的排列顺序正确的是
[N2H5·H2O]++H+ 。盐酸肼水溶液中离子浓度的排列顺序正确的是_______ (填序号)。
a.c (Cl-) >c (N2H ) >c (H+) >c (OH-)
) >c (H+) >c (OH-)
b.c (Cl-) >c ([N2H5·H2O]+)>c (H+) >c (OH-)
c.2c (N2H ) +c ([N2H5·H2O]+) +c (H+) =c (Cl-) +c (OH-)
) +c ([N2H5·H2O]+) +c (H+) =c (Cl-) +c (OH-)
d.2c (N2H ) + 2c ([N2H5·H2O]+) + 2c ([N2H4·2H2O]=c (Cl-)
) + 2c ([N2H5·H2O]+) + 2c ([N2H4·2H2O]=c (Cl-)
(1)肼(N2H4)常用于火箭或原电池的燃料。
已知:I.N2(g)+2O2(g)
 2NO2(g) ΔH = + 67.7 kJ·mol-1
2NO2(g) ΔH = + 67.7 kJ·mol-1II.2N2H4(g)+2O2(g)
 2N2(g)+4H2O(g) △H = -1068 kJ·mol-1
2N2(g)+4H2O(g) △H = -1068 kJ·mol-1①请写出N2H4和NO2反应的热化学方程式
②一定温度下,将N2H4与NO2以体积比1:1 置于10L密闭容器中发生上述①中的反应,下列选项不能说明反应达到平衡状态的是
a.混合气体密度保持不变
b.混合气体颜色保持不变
c.N2H4与NO2体积之比保持不变
d.体系压强保持不变
(2)肼为二元弱碱,其在水中的电离方程式与氨气类似
①肼的水溶液呈碱性的原因
②已知在相同条件下肼的电离程度大于N2H
 的水解程度。常温下,若0.2 mol·L-1N2H4溶液与0.1 mol·L-1HCl溶液等体积混合,则溶液中N2H
的水解程度。常温下,若0.2 mol·L-1N2H4溶液与0.1 mol·L-1HCl溶液等体积混合,则溶液中N2H 、N2H4·H2O、Cl-、OH-、 H+粒子浓度由大到小的顺序为
、N2H4·H2O、Cl-、OH-、 H+粒子浓度由大到小的顺序为(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,水溶液呈酸性,水解原理与NH4Cl类似。已知盐酸肼第一步水解反应的离子方程式为N2H
 +H2O
+H2O  [N2H5·H2O]++H+ 。盐酸肼水溶液中离子浓度的排列顺序正确的是
[N2H5·H2O]++H+ 。盐酸肼水溶液中离子浓度的排列顺序正确的是a.c (Cl-) >c (N2H
 ) >c (H+) >c (OH-)
) >c (H+) >c (OH-)b.c (Cl-) >c ([N2H5·H2O]+)>c (H+) >c (OH-)
c.2c (N2H
 ) +c ([N2H5·H2O]+) +c (H+) =c (Cl-) +c (OH-)
) +c ([N2H5·H2O]+) +c (H+) =c (Cl-) +c (OH-)d.2c (N2H
 ) + 2c ([N2H5·H2O]+) + 2c ([N2H4·2H2O]=c (Cl-)
) + 2c ([N2H5·H2O]+) + 2c ([N2H4·2H2O]=c (Cl-)
您最近一年使用:0次
名校
解题方法
5 . O2对人类有着重要的作用。请回答下列问题:
(1)甲醇是一种绿色可再生能源,已知热化学方程式:
ⅰ.2CO(g)+O2(g)=2CO2(g) ΔH1=-566.0kJ•mol-1
ⅱ.2H2(g)+O2(g)=2H2O(g) ΔH2=-483.0kJ•mol-1
ⅲ.CO(g)+2H2(g)=CH3OH(g) ΔH3=-574.0kJ•mol-1
则计算CH3OH(g)+ O2(g)=CO2(g)+2H2O(g)的ΔH=
O2(g)=CO2(g)+2H2O(g)的ΔH=___ 。
(2)人体内化学反应时刻需要O2参与,如肌肉中的肌红蛋白(Mb),具有结合O2的能力,可表示为Mb(aq)+O2(g) MbO2(aq)。肌红蛋白的结合度(即转化率α)与平衡时的氧气分压p(O2)密切相关,其变化曲线如图1。已知K=
MbO2(aq)。肌红蛋白的结合度(即转化率α)与平衡时的氧气分压p(O2)密切相关,其变化曲线如图1。已知K=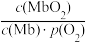 (气体和溶液中的溶质分别用分压和物质的量浓度表达)。
(气体和溶液中的溶质分别用分压和物质的量浓度表达)。
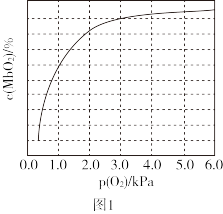
①37℃时,已知平衡常数K=2,测得人正常呼吸时α的最大值为98%,则空气中氧气分压p(O2)=___ kPa。
②血红蛋白Hb结合O2形成动脉血,存在反应1:HbH+(aq)+O2(g) HbO2(aq)+H+(aq)。血液中还同时存在反应2:CO2+H2O
HbO2(aq)+H+(aq)。血液中还同时存在反应2:CO2+H2O H++HCO
H++HCO ,结合两个反应,肺部氧分压
,结合两个反应,肺部氧分压___ (填“较高”或“较低”)有利于CO2排出体外。请你从平衡移动的角度解释原因___ 。
(3)游泳池水质普遍存在尿素[CO(NH2)2]超标现象,一种电化学除游泳池中尿素的实验装置如图2所示,其中钌钛常用作析氯电极 ,本身不参与电解。已知:3NaClO+CO(NH2)2=3NaCl+2H2O+N2↑+CO2↑。

①氮原子的核外电子排布式___ 。
②电解过程中钌钛电极上发生反应为___ 。
③电解过程中不锈钢电极附近pH___ (填“降低”“升高”或“不变”)。
④标准状况下,电解过程中每逸出22.4L N2,电路中至少通过电子数目___ 。
(1)甲醇是一种绿色可再生能源,已知热化学方程式:
ⅰ.2CO(g)+O2(g)=2CO2(g) ΔH1=-566.0kJ•mol-1
ⅱ.2H2(g)+O2(g)=2H2O(g) ΔH2=-483.0kJ•mol-1
ⅲ.CO(g)+2H2(g)=CH3OH(g) ΔH3=-574.0kJ•mol-1
则计算CH3OH(g)+
 O2(g)=CO2(g)+2H2O(g)的ΔH=
O2(g)=CO2(g)+2H2O(g)的ΔH=(2)人体内化学反应时刻需要O2参与,如肌肉中的肌红蛋白(Mb),具有结合O2的能力,可表示为Mb(aq)+O2(g)
 MbO2(aq)。肌红蛋白的结合度(即转化率α)与平衡时的氧气分压p(O2)密切相关,其变化曲线如图1。已知K=
MbO2(aq)。肌红蛋白的结合度(即转化率α)与平衡时的氧气分压p(O2)密切相关,其变化曲线如图1。已知K=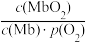 (气体和溶液中的溶质分别用分压和物质的量浓度表达)。
(气体和溶液中的溶质分别用分压和物质的量浓度表达)。
①37℃时,已知平衡常数K=2,测得人正常呼吸时α的最大值为98%,则空气中氧气分压p(O2)=
②血红蛋白Hb结合O2形成动脉血,存在反应1:HbH+(aq)+O2(g)
 HbO2(aq)+H+(aq)。血液中还同时存在反应2:CO2+H2O
HbO2(aq)+H+(aq)。血液中还同时存在反应2:CO2+H2O H++HCO
H++HCO ,结合两个反应,肺部氧分压
,结合两个反应,肺部氧分压(3)游泳池水质普遍存在尿素[CO(NH2)2]超标现象,一种电化学除游泳池中尿素的实验装置如图2所示,其中钌钛常用作

①氮原子的核外电子排布式
②电解过程中钌钛电极上发生反应为
③电解过程中不锈钢电极附近pH
④标准状况下,电解过程中每逸出22.4L N2,电路中至少通过电子数目
您最近一年使用:0次
名校
6 . 有效消除含氮化合物的污染是目前研究的热点问题。
I.消除氨的污染
我国首创的大气氨有机处理法,其主要反应为:2C6H7N(s)+3O2(g)+2NH3(g) 2C6H4N2(s)+6H2O(g) ΔH<0,其中O2和NH3只参与本反应。
2C6H4N2(s)+6H2O(g) ΔH<0,其中O2和NH3只参与本反应。
回答下列问题:
(1)向恒容容器中加入一定量的C6H7N(s)、O2(g)、NH3(g),在不同温度下反应,测得数据如下:(已知:①数据测量时间均为1h;②有效收率=转化率×选择性)
①分析表中数据,推测最佳反应温度为_______ 。
②表中φ=_______ (保留一位小数)。
③下列能够说明该反应一定达到平衡状态的是_______ (填标号)。
A.容器内气体的密度保持不变
B.3v正(O2)=2v逆(NH3)
C.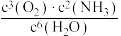 不变
不变
II.消除氮氧化物的污染
汽车尾气中的主要污染物有CO、NOx、碳氢化合物等,汽车尾气净化技术是减轻氮氧化物污染的重要举措。其中一种“净化反应”的原理为:2NO(g)+2CO(g) N2(g)+2CO2(g) △H。
N2(g)+2CO2(g) △H。
(2)已知N2(g)+O2(g)=2NO(g)) △H1=+180.5kJ·mol-1
C(s)+O2(g)=CO2(g) △H2=—393.5kJ·mol-1
2C(s)+O2(g)=2CO(g) △H3=—221kJ·mol-1
净化反应的△H=_______ kJ·mol-1。
(3)净化反应速率v=v正—v逆=k正x2(CO)·x2(NO)—k逆x2(CO2)·x(N2),其中k正、k逆分别为正、逆反应的速率常数,x为气体的体积分数。
①升高温度,k正—k逆_______ (填“增大”、“减小”或“不变”);
②按照n(CO):n(NO)=1:1投料反应,在不同压强下,净化反应中CO的平衡转化率随温度的变化如图所示,则p1_______ p2(填“>”、“<”或“=”);T1温度时, =
=_______ 。

I.消除氨的污染
我国首创的大气氨有机处理法,其主要反应为:2C6H7N(s)+3O2(g)+2NH3(g)
 2C6H4N2(s)+6H2O(g) ΔH<0,其中O2和NH3只参与本反应。
2C6H4N2(s)+6H2O(g) ΔH<0,其中O2和NH3只参与本反应。回答下列问题:
(1)向恒容容器中加入一定量的C6H7N(s)、O2(g)、NH3(g),在不同温度下反应,测得数据如下:(已知:①数据测量时间均为1h;②有效收率=转化率×选择性)
| 温度/°C | C6H7N的转化率/% | 催化剂的选择性/% | C6H4N2的有效收率/% |
| 350 | 66.2 | 96.6 | φ |
| 360 | 80.7 | 95.0 | 76.7 |
| 370 | 86.5 | 95.5 | 82.6 |
| 380 | 91.1 | 93.5 | 85.2 |
| 390 | 95.0 | 80.0 | 76.0 |
| 400 | 97.7 | 58.1 | 56.8 |
②表中φ=
③下列能够说明该反应一定达到平衡状态的是
A.容器内气体的密度保持不变
B.3v正(O2)=2v逆(NH3)
C.
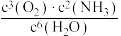 不变
不变II.消除氮氧化物的污染
汽车尾气中的主要污染物有CO、NOx、碳氢化合物等,汽车尾气净化技术是减轻氮氧化物污染的重要举措。其中一种“净化反应”的原理为:2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H。
N2(g)+2CO2(g) △H。(2)已知N2(g)+O2(g)=2NO(g)) △H1=+180.5kJ·mol-1
C(s)+O2(g)=CO2(g) △H2=—393.5kJ·mol-1
2C(s)+O2(g)=2CO(g) △H3=—221kJ·mol-1
净化反应的△H=
(3)净化反应速率v=v正—v逆=k正x2(CO)·x2(NO)—k逆x2(CO2)·x(N2),其中k正、k逆分别为正、逆反应的速率常数,x为气体的体积分数。
①升高温度,k正—k逆
②按照n(CO):n(NO)=1:1投料反应,在不同压强下,净化反应中CO的平衡转化率随温度的变化如图所示,则p1
 =
=
您最近一年使用:0次
2022-01-22更新
|
211次组卷
|
2卷引用:福建省连城县第一中学2023-2024学年高二上学期12月月考化学试题
7 . 工业燃煤废气(含有CO、SO2等)的处理和合理利用,越来越受到关注。
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:
①CO(g)+ O2(g)⇌CO2(g) ΔH=-283.0kJ·mol-1
O2(g)⇌CO2(g) ΔH=-283.0kJ·mol-1
②S(s)+O2(g)⇌SO2(g) ΔH=-296.0kJ·mol-1
则按上述方法处理CO、SO2的热化学方程式是___________ 。
(2)在两个固定容积为2L的恒容密闭容器中均充入2molCO和2molNO,在不同条件下发生反应2CO(g)+2NO(g)⇌2CO2(g)+N2(g),实验测得反应体系的压强与时间t的变化曲线如图所示。
①与实验a相比,实验b采取的措施可能是___________ ,理由是___________ 。
②在a实验条件下,NO的平衡转化率α(NO)=___________ 。
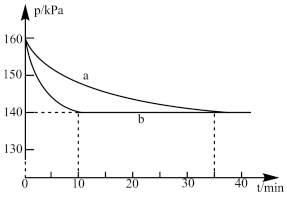
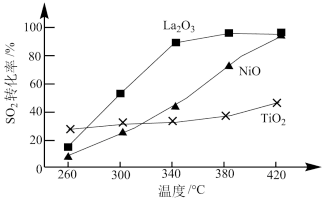
(3)燃煤烟气中硫的回收反应为2CO(g)+SO2(g)=2CO2(g)+S(l)。在其他条件相同、催化剂不同时,硫回收中SO2转化率随反应温度的变化如图所示。260℃时,___________ (填“La2O3”“NiO”或“TiO2” )的催化效率最高。La2O3和NiO作催化剂均能使SO2的转化率达到很高,不考虑价格因素,选择La2O3的主要优点是___________ 。
(4)CO和H2在一定条件下可以合成甲醇:CO(g)+2H2(g)⇌CH3OH(g) △H。 已知:v(正)=k(正)·x(CO)·x2(H2),v(逆)=k(逆)·x(CH3OH),其中x为各组分的体积分数。在密闭容器中按物质的量之比为1:2充入CO和H2,测得平衡混合气体中CO的平衡转化率随温度、压强的变化关系如图所示。
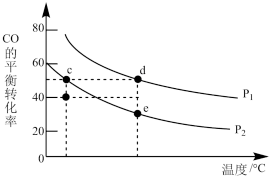
①P1___________ P2(填“>”或“<”);升高温度,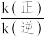
___________ (填“增大”“减小”或“不变”);
②c、d、e三点平衡常数Kc、Kd、Ke三者之间的关系为___________ 。
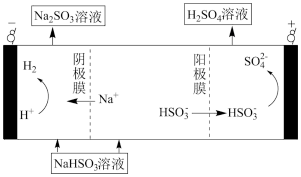
(5)用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液可制得硫酸。原理如图,写出开始电解时阳极的电极反应式___________ 。
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:
①CO(g)+
 O2(g)⇌CO2(g) ΔH=-283.0kJ·mol-1
O2(g)⇌CO2(g) ΔH=-283.0kJ·mol-1②S(s)+O2(g)⇌SO2(g) ΔH=-296.0kJ·mol-1
则按上述方法处理CO、SO2的热化学方程式是
(2)在两个固定容积为2L的恒容密闭容器中均充入2molCO和2molNO,在不同条件下发生反应2CO(g)+2NO(g)⇌2CO2(g)+N2(g),实验测得反应体系的压强与时间t的变化曲线如图所示。

①与实验a相比,实验b采取的措施可能是
②在a实验条件下,NO的平衡转化率α(NO)=
(3)燃煤烟气中硫的回收反应为2CO(g)+SO2(g)=2CO2(g)+S(l)。在其他条件相同、催化剂不同时,硫回收中SO2转化率随反应温度的变化如图所示。260℃时,

(4)CO和H2在一定条件下可以合成甲醇:CO(g)+2H2(g)⇌CH3OH(g) △H。 已知:v(正)=k(正)·x(CO)·x2(H2),v(逆)=k(逆)·x(CH3OH),其中x为各组分的体积分数。在密闭容器中按物质的量之比为1:2充入CO和H2,测得平衡混合气体中CO的平衡转化率随温度、压强的变化关系如图所示。

①P1
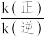
②c、d、e三点平衡常数Kc、Kd、Ke三者之间的关系为
(5)用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液可制得硫酸。原理如图,写出开始电解时阳极的电极反应式

您最近一年使用:0次
名校
解题方法
8 . “碳中和”是指企业、团体或个人测算在一定时间内,直接或间接产生的温室气体排放总量,通过植树造林、节能减排等形式,抵消自身产生的二氧化碳排放,实现二氧化碳的“零排放”。简单地说,也就是让二氧化碳排放量“收支相抵”。中国政府在第七十五届联合国大会上提出:“中国将提高国家自主贡献力度,采取更加有力的政策和措施,二氧化碳排放力争于2030年前达到峰值,努力争取2060年前实现碳中和。” 利用CO2合成二甲醚在近年来深受人们的关注,可以很大程度地帮助实现“碳中和”,其合成过程由两种工艺组成。
工艺1:先在设备一加氢合成甲醇,涉及以下主要反应:
Ⅰ.甲醇的合成:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
Ⅱ.逆水汽变换:CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
再通过设备二由甲醇脱水合成二甲醚。
Ⅲ.甲醇脱水:2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
工艺2:在双功能催化剂作用下,由CO2加氢直接得到二甲醚。
已知:相关物质变化的变示意图如下:

(1)请写出工艺2中CO2直接加氢合成CH3OCH3(g) (反应Ⅳ)的热化学方程式为___________ 。
(2)①工艺1需先在设备一先合成甲醇。在不同压强下,按照n(CO2):n(H2)=1:3投料合成甲醇,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
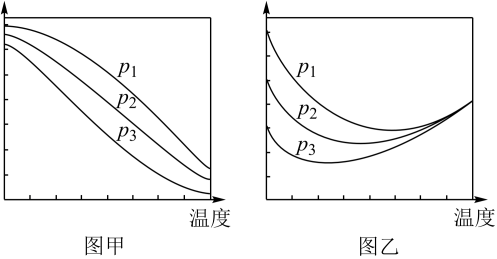
下列说法正确的是___________ 。
A.图甲纵坐标表示CH3OH的平衡产率
B.P1>P2>P3
C.为了同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择低温、高压的反应条件
D.一定温度、压强下,寻找活性更高的催化剂,是提高CO2的平衡转化率的主要研究方向
②解释图乙不同压强下CO2的平衡转化率在550℃后趋于相等的原因___________ 。
(3)假定工艺2在一定温度下,控制恒容0.6 L的刚性容器中进行,不考虑反应Ⅱ的逆水汽变换及其他副反应,将1 mol CO2与3 mol H2与双能催化剂充分接触反应,测定CO2的平衡转化率为80%,CH3OCH3选择性为50%,求此温度下反应Ⅳ的平衡常数K=___________ 。(CH3OCH3选择性=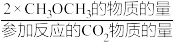 ×100%)
×100%)
(4)若CO2和H2仅发生反应Ⅰ和Ⅱ,研究表明:在其他条件相同的情况下,用新型催化剂可以显著提高甲醇的选择性,使用该催化剂,按n(CO2):n(H2)=1:3 (总量为a mol)投料于恒容密闭容器中进行反应,CO2的平衡转化率和甲醇的选择率(甲醇的选择率:转化的CO2中生成甲醇的物质的量分数)随温度的变化趋势如图所示:(忽略温度对催化剂的影响)

①根据图中数据,温度选择___________ K,达到平衡时,反应体系内甲醇的产量最高。
②随着温度的升高,CO2的平衡转化率增加但甲醇的选择率降低,请分析其原因:___________ 。
工艺1:先在设备一加氢合成甲醇,涉及以下主要反应:
Ⅰ.甲醇的合成:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)Ⅱ.逆水汽变换:CO2(g)+H2(g)
 CO(g)+H2O(g)
CO(g)+H2O(g)再通过设备二由甲醇脱水合成二甲醚。
Ⅲ.甲醇脱水:2CH3OH(g)
 CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)工艺2:在双功能催化剂作用下,由CO2加氢直接得到二甲醚。
已知:相关物质变化的变示意图如下:

(1)请写出工艺2中CO2直接加氢合成CH3OCH3(g) (反应Ⅳ)的热化学方程式为
(2)①工艺1需先在设备一先合成甲醇。在不同压强下,按照n(CO2):n(H2)=1:3投料合成甲醇,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。

下列说法正确的是
A.图甲纵坐标表示CH3OH的平衡产率
B.P1>P2>P3
C.为了同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择低温、高压的反应条件
D.一定温度、压强下,寻找活性更高的催化剂,是提高CO2的平衡转化率的主要研究方向
②解释图乙不同压强下CO2的平衡转化率在550℃后趋于相等的原因
(3)假定工艺2在一定温度下,控制恒容0.6 L的刚性容器中进行,不考虑反应Ⅱ的逆水汽变换及其他副反应,将1 mol CO2与3 mol H2与双能催化剂充分接触反应,测定CO2的平衡转化率为80%,CH3OCH3选择性为50%,求此温度下反应Ⅳ的平衡常数K=
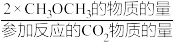 ×100%)
×100%)(4)若CO2和H2仅发生反应Ⅰ和Ⅱ,研究表明:在其他条件相同的情况下,用新型催化剂可以显著提高甲醇的选择性,使用该催化剂,按n(CO2):n(H2)=1:3 (总量为a mol)投料于恒容密闭容器中进行反应,CO2的平衡转化率和甲醇的选择率(甲醇的选择率:转化的CO2中生成甲醇的物质的量分数)随温度的变化趋势如图所示:(忽略温度对催化剂的影响)

①根据图中数据,温度选择
②随着温度的升高,CO2的平衡转化率增加但甲醇的选择率降低,请分析其原因:
您最近一年使用:0次
名校
解题方法
9 . CO2催化加氢合成CH4的反应为CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH
已知:①CH4(g)+2O2(g)⇌CO2(g)+2H2O(g) ΔH1=-802.0kJ·mol-1
②CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
③2CO(g)+O2(g)⇌2CO2(g) ΔH3=-566.0kJ·mol-1
下列有关说法正确的是
已知:①CH4(g)+2O2(g)⇌CO2(g)+2H2O(g) ΔH1=-802.0kJ·mol-1
②CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
③2CO(g)+O2(g)⇌2CO2(g) ΔH3=-566.0kJ·mol-1
下列有关说法正确的是
| A.CH4的摩尔燃烧焓为802.0kJ·mol-1 |
| B.ΔH=+165.2kJ·mol-1 |
| C.使用催化剂是为了提高CO2加氢时原料的平衡转化率 |
| D.反应②能自发进行,其原因是ΔS>0 |
您最近一年使用:0次
2021-11-20更新
|
477次组卷
|
8卷引用:福建省三明市教研联盟校2021-2022学年高二上学期期中联考化学试题
福建省三明市教研联盟校2021-2022学年高二上学期期中联考化学试题江苏省南通市如皋中学2020-2021学年高二下学期第二次阶段考试化学试题(已下线)作业06 化学反应的调控-2021年高二化学暑假作业(人教版2019)(已下线)第二章 第四节 化学反应进行的方向(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)河南省洛阳市豫西名校2021-2022学年高二上学期第一次联考化学试题河北深州市长江中学2021-2022学年高二上学期10月月考化学(理)试题重庆育才中学2021-2022学年高二上学期第二次定时练习化学试题上海市行知中学2022-2023学年高二上学期期中考试化学(加试)试题
名校
10 . 科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示(条件及物质未标出)。

(1)已知: 、CO、
、CO、 的标准燃烧热(ΔH)分别为
的标准燃烧热(ΔH)分别为 、
、 、
、 ,则上述流程中第一步反应
,则上述流程中第一步反应 的
的
___________ 。
(2)工业中 和
和 制备甲醇的方程式为
制备甲醇的方程式为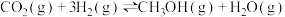 ,某温度下,将
,某温度下,将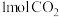 和
和 充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表,该温度下
充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表,该温度下 的平衡转化率为
的平衡转化率为___________ 。
(3)某温度下,将 和
和 按物质的量之比1:3通入压强为8MPa的恒压密闭容器中,发生(2)中反应,达到平衡时,测得
按物质的量之比1:3通入压强为8MPa的恒压密闭容器中,发生(2)中反应,达到平衡时,测得 的平衡转化率为50%,则该反应条件下的平衡常数为
的平衡转化率为50%,则该反应条件下的平衡常数为
___________  (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4) 经催化加氢可合成低碳烯烃:
经催化加氢可合成低碳烯烃: 。在0.1MPa时,按
。在0.1MPa时,按 投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
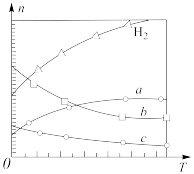
①该反应的ΔH___________ (填“>”或“<”)。
②曲线c表示的物质为___________ 。
③为提高 的平衡转化率,除改变温度外,还可采取的措施是
的平衡转化率,除改变温度外,还可采取的措施是___________ 。

(1)已知:
 、CO、
、CO、 的标准燃烧热(ΔH)分别为
的标准燃烧热(ΔH)分别为 、
、 、
、 ,则上述流程中第一步反应
,则上述流程中第一步反应 的
的
(2)工业中
 和
和 制备甲醇的方程式为
制备甲醇的方程式为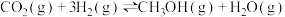 ,某温度下,将
,某温度下,将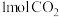 和
和 充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表,该温度下
充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表,该温度下 的平衡转化率为
的平衡转化率为| 时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
 | 0.90 | 0.85 | 0.836 | 0.81 | 0.80 | 0.80 |
 和
和 按物质的量之比1:3通入压强为8MPa的恒压密闭容器中,发生(2)中反应,达到平衡时,测得
按物质的量之比1:3通入压强为8MPa的恒压密闭容器中,发生(2)中反应,达到平衡时,测得 的平衡转化率为50%,则该反应条件下的平衡常数为
的平衡转化率为50%,则该反应条件下的平衡常数为
 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。(4)
 经催化加氢可合成低碳烯烃:
经催化加氢可合成低碳烯烃: 。在0.1MPa时,按
。在0.1MPa时,按 投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
①该反应的ΔH
②曲线c表示的物质为
③为提高
 的平衡转化率,除改变温度外,还可采取的措施是
的平衡转化率,除改变温度外,还可采取的措施是
您最近一年使用:0次



