解题方法
1 . 甲醇和二甲醚是可再生能源,具有广泛的发展前景。相关的主要反应有:
制备合成气:I.
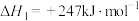

制备甲醇和二甲醚:Ⅱ.


Ⅲ.
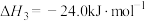

请回答:
(1)有利于制备合成气(反应I)的条件是___________ 。
A. 低温低压 B. 低温高压 C. 高温低压 D. 高温高压
(2)一定条件下,相关物质的相对能量与反应过程如下图:

①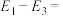
___________  。
。
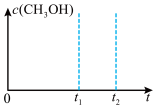
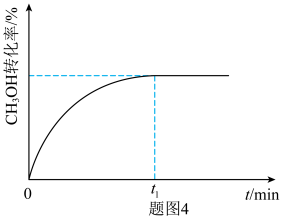
②在某温度下,在体积为1L的恒容容器中,投料为1molCO和2molH2,仅发生反应Ⅱ和Ⅲ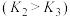 ,在
,在 时达到平衡状态,请画出
时达到平衡状态,请画出 之间
之间 的变化趋势
的变化趋势___________ 。
(3)甲醇生成二甲醚的转化率 可以根据冷凝液中的
可以根据冷凝液中的 与
与 的相对百分含量来计算(忽略副反应和各物质的挥发)。冷凝液中
的相对百分含量来计算(忽略副反应和各物质的挥发)。冷凝液中 的质量分数为
的质量分数为 ,
, 的质量分数为
的质量分数为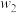 ,则甲醇的转化率
,则甲醇的转化率
___________ 。(用含 和
和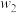 的式子表示)
的式子表示)
(4)制备合成气(反应I)时,还存在反应
 ,该过程可用于热化学能的储存。已知:储能效率
,该过程可用于热化学能的储存。已知:储能效率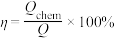 (
( 是通过化学反应吸收的热量,
是通过化学反应吸收的热量, 是设备的加热功率)。反应物气体流速、
是设备的加热功率)。反应物气体流速、 对
对 转化率
转化率 、储能效率(
、储能效率( )的影响,部分数据如下表:
)的影响,部分数据如下表:
①下列说法不正确 的是___________ 。
A.反应I可以储能的原因是该反应是吸热反应,将热量储存在高热值物质CO、H2中
B.其他条件不变,反应物气体流速越小,CH4转化率越大,有利于热化学能储存
C.其他条件不变, 越小,CH4转化率越大
越小,CH4转化率越大
D.反应物气体流速越大,CH4转化率越低的可能原因是反应物与催化剂未充分接触
②在实验2和3中,经过相同的时间,混合气中CO2占比越低,储能效率越高,说明其可能的原因___________ 。(该条件下设备的加热功率视为不变)
制备合成气:I.

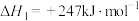

制备甲醇和二甲醚:Ⅱ.



Ⅲ.

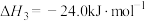

请回答:
(1)有利于制备合成气(反应I)的条件是
A. 低温低压 B. 低温高压 C. 高温低压 D. 高温高压
(2)一定条件下,相关物质的相对能量与反应过程如下图:

①
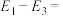
 。
。②在某温度下,在体积为1L的恒容容器中,投料为1molCO和2molH2,仅发生反应Ⅱ和Ⅲ
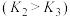 ,在
,在 时达到平衡状态,请画出
时达到平衡状态,请画出 之间
之间 的变化趋势
的变化趋势
(3)甲醇生成二甲醚的转化率
 可以根据冷凝液中的
可以根据冷凝液中的 与
与 的相对百分含量来计算(忽略副反应和各物质的挥发)。冷凝液中
的相对百分含量来计算(忽略副反应和各物质的挥发)。冷凝液中 的质量分数为
的质量分数为 ,
, 的质量分数为
的质量分数为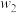 ,则甲醇的转化率
,则甲醇的转化率
 和
和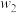 的式子表示)
的式子表示)(4)制备合成气(反应I)时,还存在反应

 ,该过程可用于热化学能的储存。已知:储能效率
,该过程可用于热化学能的储存。已知:储能效率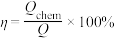 (
( 是通过化学反应吸收的热量,
是通过化学反应吸收的热量, 是设备的加热功率)。反应物气体流速、
是设备的加热功率)。反应物气体流速、 对
对 转化率
转化率 、储能效率(
、储能效率( )的影响,部分数据如下表:
)的影响,部分数据如下表:| 序号 | 加热温度/℃ | 反应物气体流速/ |  |  |  |
| 1 | 800 | 4 | 1:1 | 79.6 | 52.2 |
| 2 | 800 | 6 | 1:1 | 64.2 | 61.9 |
| 3 | 800 | 6 | 1:2 | 81.1 | 41.6 |
A.反应I可以储能的原因是该反应是吸热反应,将热量储存在高热值物质CO、H2中
B.其他条件不变,反应物气体流速越小,CH4转化率越大,有利于热化学能储存
C.其他条件不变,
 越小,CH4转化率越大
越小,CH4转化率越大D.反应物气体流速越大,CH4转化率越低的可能原因是反应物与催化剂未充分接触
②在实验2和3中,经过相同的时间,混合气中CO2占比越低,储能效率越高,说明其可能的原因
您最近一年使用:0次
解题方法
2 . 二氧化碳的捕集、利用与封存(CCUS)是我国能源领域的一个重要战略方向,CCUS或许发展成一项重要的新兴产业。
(1)已知:CH4(g) + 2O2(g)=CO2(g) + 2H2O(g) ΔH1= a kJ•mol-1
CO(g) + H2O (g)=CO2(g) + H2(g) ΔH2= b kJ•mol-1
2CO(g) + O2(g)=2CO2(g) ΔH3 = c kJ•mol-1
反应CO2(g) + CH4(g) = 2CO(g) + 2H2(g) 的ΔH=__________ kJ•mol-1。
(2)利用废气中的CO2为原料制取甲醇,反应方程式为:CO2+3H2 ⇌CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示。
①a点所代表的状态________ (填“是”或“不是”)平衡状态。
②c点CO2的转化率高于b点,原因是_____________________________________ 。

(3)在实际生产中发现,随着甲醇的生成,还伴随有少量CO副产物出现:
CO2+H2⇌CO+H2O △H>0,且CO2的转化率、甲醇的产率和CO含量除受浓度、度、压强等因素影响外,还受催化剂CuO的质量分数、气体混合物在反应锅炉内的流动速率影响(用空间流率表示)。通过实验分别得到如下数据图2、3:

①由图2得,最佳空间流率为_______ h-1;
②在其他条件不变的前提下调整催化剂配比,并记录到达平衡所需的时间,得到如下表数据,试说明不选择单组份ZnO原因是____________________________ 。
(4)用二氧化碳催化加氢来合成低碳烯烃,起始时以0.1MPa,n(H2):n(CO2)=3:1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g)  C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图4所示:
C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图4所示:
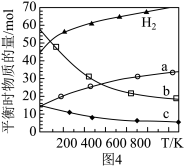
①该进行的反应的△S______ 0(填:“>”或“<”)
②对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则该反应的KP=________________ 。
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是______________ (列举2项)。
(1)已知:CH4(g) + 2O2(g)=CO2(g) + 2H2O(g) ΔH1= a kJ•mol-1
CO(g) + H2O (g)=CO2(g) + H2(g) ΔH2= b kJ•mol-1
2CO(g) + O2(g)=2CO2(g) ΔH3 = c kJ•mol-1
反应CO2(g) + CH4(g) = 2CO(g) + 2H2(g) 的ΔH=
(2)利用废气中的CO2为原料制取甲醇,反应方程式为:CO2+3H2 ⇌CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示。
①a点所代表的状态
②c点CO2的转化率高于b点,原因是

(3)在实际生产中发现,随着甲醇的生成,还伴随有少量CO副产物出现:
CO2+H2⇌CO+H2O △H>0,且CO2的转化率、甲醇的产率和CO含量除受浓度、度、压强等因素影响外,还受催化剂CuO的质量分数、气体混合物在反应锅炉内的流动速率影响(用空间流率表示)。通过实验分别得到如下数据图2、3:

①由图2得,最佳空间流率为
②在其他条件不变的前提下调整催化剂配比,并记录到达平衡所需的时间,得到如下表数据,试说明不选择单组份ZnO原因是
催化剂组分 质量分数(%) | CuO | 0 | 25 | 50 | 75 | 100 |
ZnO | 100 | 75 | 50 | 25 | 0 | |
到达平衡所需时间(h) | 2.5 | 7.4 | 8.1 | 12 | 无催化活性 | |
 C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图4所示:
C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图4所示:
①该进行的反应的△S
②对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则该反应的KP=
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是
您最近一年使用:0次
23-24高三上·浙江·开学考试
解题方法
3 . 以煤为原料,经由甲醇可制取甲醚,也可以制取烯烃并可以此取代传统的以石油为原料制取烯烃的路线。
(1)已知:在25℃和101kPa条件下,甲醇的燃烧热为-726.5 ,乙烯的燃烧热为-1411
,乙烯的燃烧热为-1411  ,
,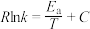 (
( 为活化能,R、C为常数,k为平衡常数)。则:
为活化能,R、C为常数,k为平衡常数)。则:
① 脱水生成
脱水生成 的热化学方程式是
的热化学方程式是___________ ,该反应自发进行的条件是___________ (填“较低”、“较高”或“任意”)温度。
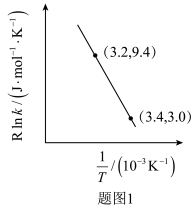
②甲醇脱水生成乙烯的温度与平衡常数的实验数据图如图1所示,该反应的正反应的活化能为___________  。
。
(2)以煤为原料气化产生的原料气可以用来合成 和
和 ,合成气平衡转化率随氢碳比 (
,合成气平衡转化率随氢碳比 (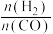 )的变化如图2所示:甲醇制取烃的过程中,会发生多种反应,可以生成
)的变化如图2所示:甲醇制取烃的过程中,会发生多种反应,可以生成 、
、 、
、 等,一定条件下,测得各烃的质量分数、
等,一定条件下,测得各烃的质量分数、 转化率随温度变化情况如图3所示。
转化率随温度变化情况如图3所示。
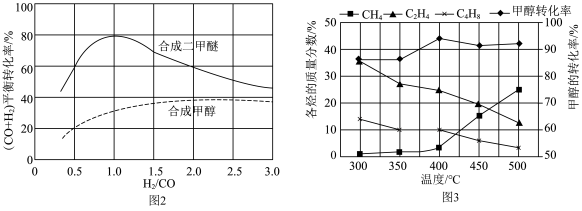
①下列叙述不正确 的是___________ 。
A.合成 的最佳氢碳比为1.0
的最佳氢碳比为1.0
B.甲醇制取烃的过程中,相同条件下,温度越高越有利于 的生成
的生成
C.甲醇制取乙烯的过程中,一般控制在350℃~400℃比较合适
D.甲醇制取烃的过程中, 的平衡转化率随温度升高先增大后减少
的平衡转化率随温度升高先增大后减少
②原料气合成 、
、 过程有如下反应发生:
过程有如下反应发生:
反应Ⅰ
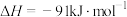
反应Ⅱ

反应Ⅲ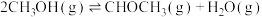

图2中原料气合成 的转化率高于
的转化率高于 的原因
的原因___________ 。
③在350℃,1MPa下,甲醇制取乙烯的转化率随时间的变化曲线如图4所示( 为该条件下的平衡时刻)。画出在相同条件下,向容器中添加氮气作稀释剂时甲醇的转化率随时间的变化曲线。
为该条件下的平衡时刻)。画出在相同条件下,向容器中添加氮气作稀释剂时甲醇的转化率随时间的变化曲线。_________
(1)已知:在25℃和101kPa条件下,甲醇的燃烧热为-726.5
 ,乙烯的燃烧热为-1411
,乙烯的燃烧热为-1411  ,
,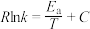 (
( 为活化能,R、C为常数,k为平衡常数)。则:
为活化能,R、C为常数,k为平衡常数)。则:①
 脱水生成
脱水生成 的热化学方程式是
的热化学方程式是②甲醇脱水生成乙烯的温度与平衡常数的实验数据图如图1所示,该反应的正反应的活化能为
 。
。
(2)以煤为原料气化产生的原料气可以用来合成
 和
和 ,合成气平衡转化率随氢碳比 (
,合成气平衡转化率随氢碳比 (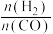 )的变化如图2所示:甲醇制取烃的过程中,会发生多种反应,可以生成
)的变化如图2所示:甲醇制取烃的过程中,会发生多种反应,可以生成 、
、 、
、 等,一定条件下,测得各烃的质量分数、
等,一定条件下,测得各烃的质量分数、 转化率随温度变化情况如图3所示。
转化率随温度变化情况如图3所示。
①下列叙述
A.合成
 的最佳氢碳比为1.0
的最佳氢碳比为1.0B.甲醇制取烃的过程中,相同条件下,温度越高越有利于
 的生成
的生成C.甲醇制取乙烯的过程中,一般控制在350℃~400℃比较合适
D.甲醇制取烃的过程中,
 的平衡转化率随温度升高先增大后减少
的平衡转化率随温度升高先增大后减少②原料气合成
 、
、 过程有如下反应发生:
过程有如下反应发生:反应Ⅰ

反应Ⅱ


反应Ⅲ
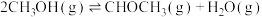

图2中原料气合成
 的转化率高于
的转化率高于 的原因
的原因③在350℃,1MPa下,甲醇制取乙烯的转化率随时间的变化曲线如图4所示(
 为该条件下的平衡时刻)。画出在相同条件下,向容器中添加氮气作稀释剂时甲醇的转化率随时间的变化曲线。
为该条件下的平衡时刻)。画出在相同条件下,向容器中添加氮气作稀释剂时甲醇的转化率随时间的变化曲线。
您最近一年使用:0次
4 . 卤素的单质和化合物在生产和生活中应用广泛。
(1)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。
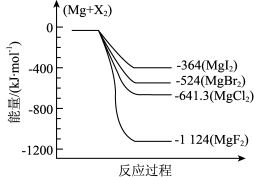
①图中四种MgX2的热稳定由小到大的顺序是:_______ 。
②MgBr2(s)+Cl2(g) MgCl2(s)+Br2(g) △H=
MgCl2(s)+Br2(g) △H=_______ kJ∙mol-1。
某温度下,在密闭恒容容器中放入一定量MgBr2(s)和Cl2(g)进行该反应,一定时间后不能说明该反应已经达到平衡的是_______ 。(选填序号)。
A.容器内的压强不再改变 B.混合气体的密度不再改变
C.混合气体的颜色不再改变 D.混合气体的平均相对分子质量不再改变
E.容器内的固体的质量不再改变
③工业上用金属Mg与I2反应制取MgI2时,常加入少量水,水的作用是_______ 。
④AgBr常用作感光剂和镇静剂,工业制得的AgBr固体常含有AgCl固体。现有含AgCl质量分数为14.35%的AgBr固体100.00g,可用饱和KBr溶液一次性浸泡,恰好溶解除去AgCl固体,需要5.015 mol∙L-1的饱和KBr溶液的体积至少为_______ mL。(保留4位有效数字)(已知常温下Ksp(ABr)=5.418×10-13,Ksp(AgCl)=1.806×10-10)
(2)将一定量的PCl5(g)在T℃、Po压强下发生反应:PCl5(g) PCl3(g)+Cl2(g),测得平衡时PCl5的分解率为a,求该温度下此反应的平衡常数Kp=
PCl3(g)+Cl2(g),测得平衡时PCl5的分解率为a,求该温度下此反应的平衡常数Kp=_______ 。(用含a的式子表示。其中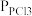 、
、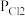 、
、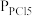 为各组分的平衡分压,如
为各组分的平衡分压,如 ,p为平衡总压,
,p为平衡总压, 为平衡系统中PCl5的物质的量分数)
为平衡系统中PCl5的物质的量分数)
(3)向11mL0.40mol∙L-1H2O2溶液中加入适量FeCl3溶液,16分钟时测得生成O2的体积(已折算为标准状况)为44.8mL。资料显示,反应分两步进行:①2Fe3++H2O2=2Fe2++O2↑+2H+,②2Fe2++H2O2+2H+=2Fe3++2H2O。反应过程中能量变化如图1所示,在图2中画出在0~16分钟内产生O2的物质的量随时间的变化示意图_______ 。

(1)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。

①图中四种MgX2的热稳定由小到大的顺序是:
②MgBr2(s)+Cl2(g)
 MgCl2(s)+Br2(g) △H=
MgCl2(s)+Br2(g) △H=某温度下,在密闭恒容容器中放入一定量MgBr2(s)和Cl2(g)进行该反应,一定时间后不能说明该反应已经达到平衡的是
A.容器内的压强不再改变 B.混合气体的密度不再改变
C.混合气体的颜色不再改变 D.混合气体的平均相对分子质量不再改变
E.容器内的固体的质量不再改变
③工业上用金属Mg与I2反应制取MgI2时,常加入少量水,水的作用是
④AgBr常用作感光剂和镇静剂,工业制得的AgBr固体常含有AgCl固体。现有含AgCl质量分数为14.35%的AgBr固体100.00g,可用饱和KBr溶液一次性浸泡,恰好溶解除去AgCl固体,需要5.015 mol∙L-1的饱和KBr溶液的体积至少为
(2)将一定量的PCl5(g)在T℃、Po压强下发生反应:PCl5(g)
 PCl3(g)+Cl2(g),测得平衡时PCl5的分解率为a,求该温度下此反应的平衡常数Kp=
PCl3(g)+Cl2(g),测得平衡时PCl5的分解率为a,求该温度下此反应的平衡常数Kp=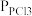 、
、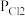 、
、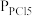 为各组分的平衡分压,如
为各组分的平衡分压,如 ,p为平衡总压,
,p为平衡总压, 为平衡系统中PCl5的物质的量分数)
为平衡系统中PCl5的物质的量分数)(3)向11mL0.40mol∙L-1H2O2溶液中加入适量FeCl3溶液,16分钟时测得生成O2的体积(已折算为标准状况)为44.8mL。资料显示,反应分两步进行:①2Fe3++H2O2=2Fe2++O2↑+2H+,②2Fe2++H2O2+2H+=2Fe3++2H2O。反应过程中能量变化如图1所示,在图2中画出在0~16分钟内产生O2的物质的量随时间的变化示意图

您最近一年使用:0次
5 . 研究发现,含三聚氰胺(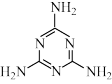 )助催化剂的复合石墨正极可有效提高锌一氧气二次电池的能源储存与转换效率。已知当分子中多原子形成多电子的
)助催化剂的复合石墨正极可有效提高锌一氧气二次电池的能源储存与转换效率。已知当分子中多原子形成多电子的 键(称为大
键(称为大 键)时,能降低能量,提高分子稳定性,因形成大
键)时,能降低能量,提高分子稳定性,因形成大 键而降低的能量称为共轭能。请回答:
键而降低的能量称为共轭能。请回答:
(1)Zn的核外电子排布式是_______ 。
(2)根据苯的不同结构进行理论计算或实验测定,得到如下数据:
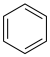
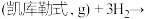
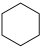

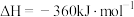
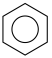
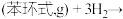


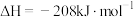
则苯分子的共轭能约为_______  。
。
(3)电池工作时,三聚氰胺会转化成三聚氰酸(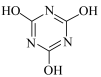 )。三聚氰酸中能检测到含量很低的异构体
)。三聚氰酸中能检测到含量很低的异构体 ,异构体含量很低的原因是
,异构体含量很低的原因是_______ 。
(4)碳元素的常见单质有石墨与金刚石,它们的某种晶胞结构如下图1、2所示。
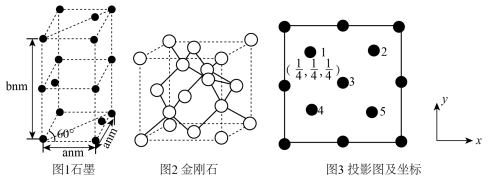
①设 为阿伏加德罗常数的值,石墨的密度为
为阿伏加德罗常数的值,石墨的密度为_______  (用含a、b、
(用含a、b、 的式子表示)。
的式子表示)。
②以晶胞参数为单位长度建立的坐标系可表示各原子的位置,称作原子分数坐标。图3是金刚石沿y轴的投影及1号碳原子的坐标,则2~3号碳原子的坐标不可能 是_______ (填序号)。
A.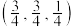 B.
B. C.
C.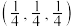 D.
D.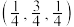
 )助催化剂的复合石墨正极可有效提高锌一氧气二次电池的能源储存与转换效率。已知当分子中多原子形成多电子的
)助催化剂的复合石墨正极可有效提高锌一氧气二次电池的能源储存与转换效率。已知当分子中多原子形成多电子的 键(称为大
键(称为大 键)时,能降低能量,提高分子稳定性,因形成大
键)时,能降低能量,提高分子稳定性,因形成大 键而降低的能量称为共轭能。请回答:
键而降低的能量称为共轭能。请回答:(1)Zn的核外电子排布式是
(2)根据苯的不同结构进行理论计算或实验测定,得到如下数据:

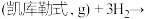


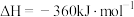

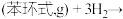


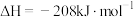
则苯分子的共轭能约为
 。
。(3)电池工作时,三聚氰胺会转化成三聚氰酸(
 )。三聚氰酸中能检测到含量很低的异构体
)。三聚氰酸中能检测到含量很低的异构体 ,异构体含量很低的原因是
,异构体含量很低的原因是(4)碳元素的常见单质有石墨与金刚石,它们的某种晶胞结构如下图1、2所示。

①设
 为阿伏加德罗常数的值,石墨的密度为
为阿伏加德罗常数的值,石墨的密度为 (用含a、b、
(用含a、b、 的式子表示)。
的式子表示)。②以晶胞参数为单位长度建立的坐标系可表示各原子的位置,称作原子分数坐标。图3是金刚石沿y轴的投影及1号碳原子的坐标,则2~3号碳原子的坐标
A.
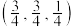 B.
B. C.
C.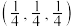 D.
D.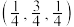
您最近一年使用:0次
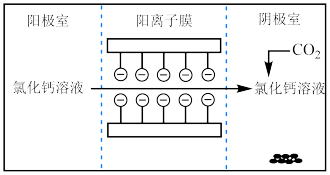
6 . I.电解法可处理氯化钙废液同时,吸收CO2,装置如图所示。_______ 和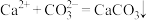 。
。
II.工业含硫烟气污染大气,研究烟气脱硫具有重要意义。
方法一、H2还原脱硫:
(2)300℃,发生反应:①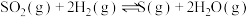

②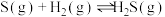

③

请用一个等式来表示三个反应的 之间的关系
之间的关系_______ 。
(3)反应③,在恒温、恒容的密闭容器中,充入 和
和 ,平衡常数
,平衡常数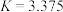 ,测得平衡时
,测得平衡时 和
和 的浓度均为
的浓度均为 ,则平衡时
,则平衡时 的值为
的值为_______ 。
方法二、O2氧化脱硫:
(4)某同学探究活性炭吸附催化氧化 ,以N2作稀释剂,一定温度下,通入
,以N2作稀释剂,一定温度下,通入 、
、 和
和 反应生成
反应生成 ,其中不同温度下,
,其中不同温度下, 在活性炭上的吸附情况如图,下列说法正确的是_______。
在活性炭上的吸附情况如图,下列说法正确的是_______。
(5)在SO2与O2反应过程中掺入少量CH4有利于提高SO2转化成SO3,其中一种解释是甲烷参与氧化反应过程中存在如图机理。原料以一定流速通过反应容器,出口处测SO3的含量,结合机理说明甲烷体积分数增大,SO3体积分数也增大的理由_______ 。
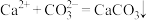 。
。II.工业含硫烟气污染大气,研究烟气脱硫具有重要意义。
方法一、H2还原脱硫:
(2)300℃,发生反应:①
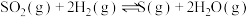

②
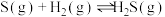

③


请用一个等式来表示三个反应的
 之间的关系
之间的关系(3)反应③,在恒温、恒容的密闭容器中,充入
 和
和 ,平衡常数
,平衡常数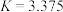 ,测得平衡时
,测得平衡时 和
和 的浓度均为
的浓度均为 ,则平衡时
,则平衡时 的值为
的值为方法二、O2氧化脱硫:
(4)某同学探究活性炭吸附催化氧化
 ,以N2作稀释剂,一定温度下,通入
,以N2作稀释剂,一定温度下,通入 、
、 和
和 反应生成
反应生成 ,其中不同温度下,
,其中不同温度下, 在活性炭上的吸附情况如图,下列说法正确的是_______。
在活性炭上的吸附情况如图,下列说法正确的是_______。
| A.温度越低,SO2的吸附量越高,SO2氧化反应速率越快 |
| B.已知:SO2的物理吸附过程能自发进行,可推断该过程是熵减、放热的过程,温度过高不利 |
| C.原料中水蒸气的含量越大,脱硫速率一定越快 |
D.随着时间的推移,SO2吸附速率降低,可能是由于生成的 占据了吸附位点没及时脱出导致 占据了吸附位点没及时脱出导致 |
(5)在SO2与O2反应过程中掺入少量CH4有利于提高SO2转化成SO3,其中一种解释是甲烷参与氧化反应过程中存在如图机理。原料以一定流速通过反应容器,出口处测SO3的含量,结合机理说明甲烷体积分数增大,SO3体积分数也增大的理由

您最近一年使用:0次
2024-04-24更新
|
251次组卷
|
2卷引用:浙江绍兴市2023-2024学年高三下学期选考科目适应性考试化学试题
23-24高三上·浙江·期中
7 . 氢能源是最具应用前景的能源之一。甲烷-水蒸气催化重整制氢(SMR)是一种制高纯氢的方法之一,其涉及的主要反应如下:
反应Ⅰ:
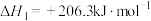
反应Ⅱ: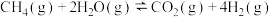

反应Ⅲ:
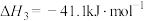
回答下列问题:
(1)反应Ⅱ能自发进行的条件是___________ 。
(2)一定温度下,向某容积为1L的恒容容器中按照水碳比[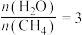 ]充入
]充入 和
和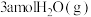 ,tmin后反应达到平衡。达到平衡时,容器中CO为mmol,
,tmin后反应达到平衡。达到平衡时,容器中CO为mmol, 为nmol。
为nmol。
①下列说法不正确 的是___________ 。
A.为防止催化剂中毒和安全事故发生,需对原料气进行脱硫等净化处理
B.提高水碳比[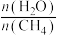 ],有利于提高
],有利于提高 的产率
的产率
C.升高温度有利于反应Ⅰ、Ⅱ的平衡正向移动,温度越高越好
D.以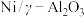 作催化剂,降低反应活化能,提高反应速率和原料利用率
作催化剂,降低反应活化能,提高反应速率和原料利用率
②反应Ⅲ的平衡常数
___________ (用含a,m,n的代数式表示)。
(3)650℃(局部温度过高会造成积碳)、按照一定流速通入原料气,当水碳比[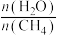 ]一定时,催化剂中无添加吸附剂和添加
]一定时,催化剂中无添加吸附剂和添加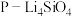 吸附剂(吸收
吸附剂(吸收 ),各气体组分反应的平衡含量与时间的关系如图所示:
),各气体组分反应的平衡含量与时间的关系如图所示:
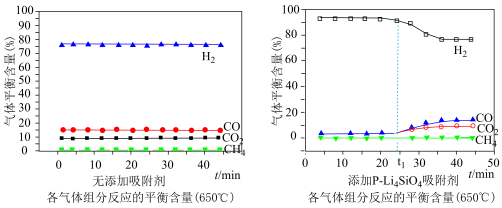
①催化剂中添加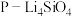 吸附剂与无添加吸附剂比较,
吸附剂与无添加吸附剂比较,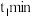 前
前 的平衡含量升高,
的平衡含量升高, 、CO和
、CO和 的平衡含量降低;
的平衡含量降低;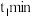 后
后 的平衡含量降低,
的平衡含量降低, 、CO和
、CO和 的平衡含量升高,最后与无添加吸附剂时的含量相同,可能的原因是
的平衡含量升高,最后与无添加吸附剂时的含量相同,可能的原因是___________ 。
②实验时发现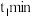 后
后 的平衡含量低于理论平衡值,CO的平衡含量高于理论平衡值,可能的原因是
的平衡含量低于理论平衡值,CO的平衡含量高于理论平衡值,可能的原因是___________ 。(用化学反应方程式表示)
(4)该反应常采用钯膜分离技术(可选择性地让某气体通过而离开体系),其机理如图所示,其中过程2: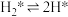 ,其活化能
,其活化能 ;过程3:H*在钯膜内的迁移速率是决速步骤(*表示物质吸附在催化剂表面),下列说法
;过程3:H*在钯膜内的迁移速率是决速步骤(*表示物质吸附在催化剂表面),下列说法不正确 的是___________。
反应Ⅰ:

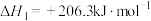
反应Ⅱ:
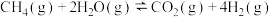

反应Ⅲ:

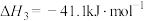
回答下列问题:
(1)反应Ⅱ能自发进行的条件是
(2)一定温度下,向某容积为1L的恒容容器中按照水碳比[
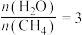 ]充入
]充入 和
和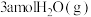 ,tmin后反应达到平衡。达到平衡时,容器中CO为mmol,
,tmin后反应达到平衡。达到平衡时,容器中CO为mmol, 为nmol。
为nmol。①下列说法
A.为防止催化剂中毒和安全事故发生,需对原料气进行脱硫等净化处理
B.提高水碳比[
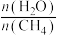 ],有利于提高
],有利于提高 的产率
的产率C.升高温度有利于反应Ⅰ、Ⅱ的平衡正向移动,温度越高越好
D.以
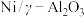 作催化剂,降低反应活化能,提高反应速率和原料利用率
作催化剂,降低反应活化能,提高反应速率和原料利用率②反应Ⅲ的平衡常数

(3)650℃(局部温度过高会造成积碳)、按照一定流速通入原料气,当水碳比[
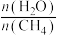 ]一定时,催化剂中无添加吸附剂和添加
]一定时,催化剂中无添加吸附剂和添加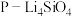 吸附剂(吸收
吸附剂(吸收 ),各气体组分反应的平衡含量与时间的关系如图所示:
),各气体组分反应的平衡含量与时间的关系如图所示:
①催化剂中添加
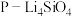 吸附剂与无添加吸附剂比较,
吸附剂与无添加吸附剂比较,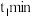 前
前 的平衡含量升高,
的平衡含量升高, 、CO和
、CO和 的平衡含量降低;
的平衡含量降低;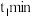 后
后 的平衡含量降低,
的平衡含量降低, 、CO和
、CO和 的平衡含量升高,最后与无添加吸附剂时的含量相同,可能的原因是
的平衡含量升高,最后与无添加吸附剂时的含量相同,可能的原因是②实验时发现
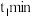 后
后 的平衡含量低于理论平衡值,CO的平衡含量高于理论平衡值,可能的原因是
的平衡含量低于理论平衡值,CO的平衡含量高于理论平衡值,可能的原因是(4)该反应常采用钯膜分离技术(可选择性地让某气体通过而离开体系),其机理如图所示,其中过程2:
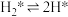 ,其活化能
,其活化能 ;过程3:H*在钯膜内的迁移速率是决速步骤(*表示物质吸附在催化剂表面),下列说法
;过程3:H*在钯膜内的迁移速率是决速步骤(*表示物质吸附在催化剂表面),下列说法
A.钯膜对 分子的透过具有选择性 分子的透过具有选择性 |
B.过程4的 |
| C.采用钯膜分离技术可以提高原料的利用率 |
D.常用 将过程5中的 将过程5中的 吹扫出反应器,增大钯膜两侧的压强差,提高过程1、3速率而促进反应 吹扫出反应器,增大钯膜两侧的压强差,提高过程1、3速率而促进反应 |
您最近一年使用:0次
名校
8 . 某恒容密闭容器中,只改变温度(T)或压强(p),水蒸气百分含量随时间的变化趋势符合下图所示的反应是
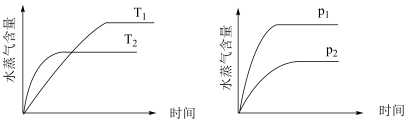

A.  |
B.  |
C.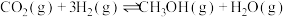  |
D.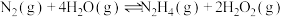  |
您最近一年使用:0次
2023-08-21更新
|
478次组卷
|
3卷引用:浙江省精诚联盟2022-2023学年高三上学期12月适应性联考化学试题
21-22高三上·浙江·阶段练习
9 . 氨气广泛应用于化肥、制药、合成纤维等领域。
Ⅰ.工业上可由氢气和氮气合成氨气。若用 、
、 、
、 、
、 分别表示
分别表示 、
、 、
、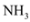 和催化剂,则在催化剂表面合成氨的过程如图所示:
和催化剂,则在催化剂表面合成氨的过程如图所示:
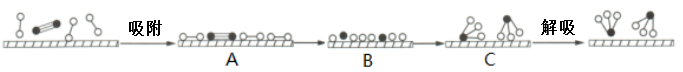
(1)吸附后,能量状态最高的是___ (填序号)。
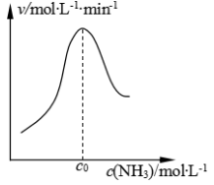
(2)结合上述过程,一定温度下在固体催化剂表面进行NH3的分解实验,发现NH3的分解速率与浓度的关系如图所示。从吸附和解吸过程分析 ,c0前反应速率增加的原因可能是___ ;c0之后反应速率降低的原因可能是___ 。
Ⅱ.利用NH3在催化剂(V2O5—WO3/TiO2)作用下将NOx还原为N2是目前应用最为广泛的氮氧化物NOx的净化方法,其原理是:
主反应:4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g) ΔH1
4N2(g)+6H2O(g) ΔH1
副反应:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔH2
2N2(g)+6H2O(g) ΔH2
(3)根据盖斯定律可得:4NH3(g)+6NO(g) 5N2(g)+6H2O(g) ΔH3,则ΔH3=
5N2(g)+6H2O(g) ΔH3,则ΔH3=____ (用含ΔH1、ΔH2的式子表示)。
(4)催化剂V2O5—WO3/TiO2中的V2O5是活性组分。在反应器中以一定流速通过混合气[n(O2):n(NH3):n(NO)=71:1:1],在不同温度下进行该催化反应,V2O5的质量分数对单位时间内NO去除率的影响如图所示。
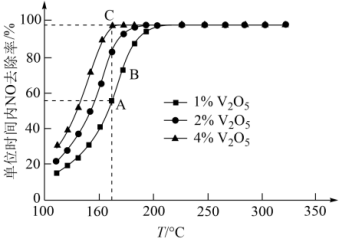
①从起始至对应A、B、C三点的平均反应速率由小到大的顺序为___ 。
②V2O5的质量分数对该催化剂活性的影响是___ 。
(5)一定温度下,向1L恒容密闭容器(含催化剂)中投入1molNH3和1.5molNO,发生反应4NH3(g)+6NO(g) 5N2(g)+6H2O(g)。达到平衡状态时,NO的转化率为60%,则平衡常数为
5N2(g)+6H2O(g)。达到平衡状态时,NO的转化率为60%,则平衡常数为___ mol·L-1(列出计算式即可)。
Ⅰ.工业上可由氢气和氮气合成氨气。若用
 、
、 、
、 、
、 分别表示
分别表示 、
、 、
、 和催化剂,则在催化剂表面合成氨的过程如图所示:
和催化剂,则在催化剂表面合成氨的过程如图所示:
(1)吸附后,能量状态最高的是
(2)结合上述过程,一定温度下在固体催化剂表面进行NH3的分解实验,发现NH3的分解速率与浓度的关系如图所示。从

Ⅱ.利用NH3在催化剂(V2O5—WO3/TiO2)作用下将NOx还原为N2是目前应用最为广泛的氮氧化物NOx的净化方法,其原理是:
主反应:4NH3(g)+4NO(g)+O2(g)
 4N2(g)+6H2O(g) ΔH1
4N2(g)+6H2O(g) ΔH1副反应:4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) ΔH2
2N2(g)+6H2O(g) ΔH2(3)根据盖斯定律可得:4NH3(g)+6NO(g)
 5N2(g)+6H2O(g) ΔH3,则ΔH3=
5N2(g)+6H2O(g) ΔH3,则ΔH3=(4)催化剂V2O5—WO3/TiO2中的V2O5是活性组分。在反应器中以一定流速通过混合气[n(O2):n(NH3):n(NO)=71:1:1],在不同温度下进行该催化反应,V2O5的质量分数对单位时间内NO去除率的影响如图所示。

①从起始至对应A、B、C三点的平均反应速率由小到大的顺序为
②V2O5的质量分数对该催化剂活性的影响是
(5)一定温度下,向1L恒容密闭容器(含催化剂)中投入1molNH3和1.5molNO,发生反应4NH3(g)+6NO(g)
 5N2(g)+6H2O(g)。达到平衡状态时,NO的转化率为60%,则平衡常数为
5N2(g)+6H2O(g)。达到平衡状态时,NO的转化率为60%,则平衡常数为
您最近一年使用:0次
2021-11-05更新
|
445次组卷
|
5卷引用:二轮拔高卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(浙江专用)
(已下线)二轮拔高卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(浙江专用) 浙江省湖州、衢州、丽水三地市2021-2022学年高三上学期11月教学质量检测化学试题(已下线)解密09 化学反应速率与化学平衡(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)山东省青岛市2022届高三下学期五月模拟考试化学试题(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-练习
解题方法
10 . 甲烷水蒸气重整反应是工业制备氢气的重要方式,在催化剂(如镍)表面发生的主要反应有:
①
 kJ⋅mol-1
kJ⋅mol-1
②

副反应: ,
, ,
,
Ⅰ.已知: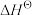 为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1 mol该物质的焓变。对于稳定相态单质,其
为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1 mol该物质的焓变。对于稳定相态单质,其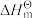 为零。
为零。
例如C(石墨)
 kJ·mol-1,则
kJ·mol-1,则 的标准生成焓为-393.5 kJ⋅mol-1。
的标准生成焓为-393.5 kJ⋅mol-1。
(1)
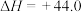 kJ⋅mol-1,结合表中数据计算反应
kJ⋅mol-1,结合表中数据计算反应
___________ 。
(2)在镍催化剂表面甲烷和水蒸气发生反应,最后生成CO、 和
和 ,反应机理如下,请补充其中的两个反应方程式(Z表示催化剂的活性中心)。
,反应机理如下,请补充其中的两个反应方程式(Z表示催化剂的活性中心)。
a. ;
;
b.___________ ;
c. ;
;
d.___________ ;
e.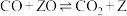
Ⅱ.在一体积可变的密闭容器中,投入一定量的 和
和 发生甲烷水蒸气重整反应。
发生甲烷水蒸气重整反应。
(3)下列有关说法正确的是___________。
(4)维持压强100 kPa,平衡时 、
、 、CO、
、CO、 的体积分数分别为a、b、c、d,反应①的平衡常数
的体积分数分别为a、b、c、d,反应①的平衡常数
___________  (用含字母的式子表示。
(用含字母的式子表示。 是以分压表示的平衡常数,分压=总压×体积分数)。
是以分压表示的平衡常数,分压=总压×体积分数)。
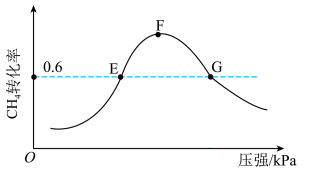
(5)500℃时,反应相同时间后测得 的转化率随压强的变化如图所示。则图中E点和G点CH4的浓度大小关系为c(E)
的转化率随压强的变化如图所示。则图中E点和G点CH4的浓度大小关系为c(E)___________ c(G)(填“>”“<”或“=”)。
(6)通过甲烷水蒸气重整反应的平衡含量计算,以及析碳条件的判断,该转化需适当增大水碳比[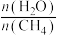 ],请分析可能的原因:
],请分析可能的原因:___________ 。
①

 kJ⋅mol-1
kJ⋅mol-1②


副反应:
 ,
, ,
,
Ⅰ.已知:
 为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1 mol该物质的焓变。对于稳定相态单质,其
为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1 mol该物质的焓变。对于稳定相态单质,其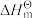 为零。
为零。例如C(石墨)

 kJ·mol-1,则
kJ·mol-1,则 的标准生成焓为-393.5 kJ⋅mol-1。
的标准生成焓为-393.5 kJ⋅mol-1。| 物质 |  |  | CO |
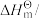 /kJ⋅mol-1 /kJ⋅mol-1 | -285.8 | -393.5 | -110.5 |

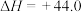 kJ⋅mol-1,结合表中数据计算反应
kJ⋅mol-1,结合表中数据计算反应
(2)在镍催化剂表面甲烷和水蒸气发生反应,最后生成CO、
 和
和 ,反应机理如下,请补充其中的两个反应方程式(Z表示催化剂的活性中心)。
,反应机理如下,请补充其中的两个反应方程式(Z表示催化剂的活性中心)。a.
 ;
; b.
c.
 ;
;d.
e.
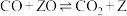
Ⅱ.在一体积可变的密闭容器中,投入一定量的
 和
和 发生甲烷水蒸气重整反应。
发生甲烷水蒸气重整反应。(3)下列有关说法正确的是___________。
A. 浓度不变,说明体系已达平衡状态 浓度不变,说明体系已达平衡状态 |
| B.反应②前后气体物质的量不变,所以此反应熵变为0 |
C.在催化剂表面, 、 、 分子中的化学键被削弱 分子中的化学键被削弱 |
D.在体系中通入适量的 ,有利于减少积碳,从而有利于反应进行 ,有利于减少积碳,从而有利于反应进行 |
 、
、 、CO、
、CO、 的体积分数分别为a、b、c、d,反应①的平衡常数
的体积分数分别为a、b、c、d,反应①的平衡常数
 (用含字母的式子表示。
(用含字母的式子表示。 是以分压表示的平衡常数,分压=总压×体积分数)。
是以分压表示的平衡常数,分压=总压×体积分数)。(5)500℃时,反应相同时间后测得
 的转化率随压强的变化如图所示。则图中E点和G点CH4的浓度大小关系为c(E)
的转化率随压强的变化如图所示。则图中E点和G点CH4的浓度大小关系为c(E)
(6)通过甲烷水蒸气重整反应的平衡含量计算,以及析碳条件的判断,该转化需适当增大水碳比[
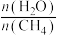 ],请分析可能的原因:
],请分析可能的原因:
您最近一年使用:0次



