解题方法
1 . 工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖。工业合成氨生产示意图如图所示。

(1)下列有关合成氨工业的说法正确的是_________
(2)循环利用的Y是氮气和氢气,目的是__________________ 。
(3)在合成氨工业中,要使氨的产率增大,同时又能提高反应速率,可采取的措施有_________ (填编号)。
①使用催化剂 ②恒温恒容,增大原料气 和
和 充入量 ③及时分离产生的
充入量 ③及时分离产生的
④升高温度 ⑤恒温恒容,充入惰性气体 使压强增大
使压强增大
(4)氮的固定和氮的循环是几百年来科学家一直研究的课题。下表列举了不同温度下大气固氮和工业固氮的部分 值。
值。
分析数据可知:
①在 下模拟工业固氮,某时刻
下模拟工业固氮,某时刻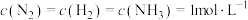 ,此时
,此时
_________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②人类不适合大规模模拟大气固氮的原因是__________________ 。
(5)为获得合成氨的原料气氢气,某科研小组以太阳能为热源分解 ,经热化学铁氧化合物循环分解水制
,经热化学铁氧化合物循环分解水制 的过程如下。
的过程如下。
已知: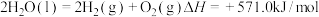 。
。
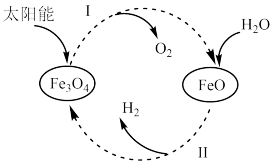
过程Ⅰ: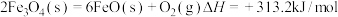
过程Ⅱ:……
过程Ⅱ的热化学方程式为_________ 。

(1)下列有关合成氨工业的说法正确的是_________
| A.工业合成氨的反应是熵减小的放热反应,在低温或常温时可自发进行 |
| B.合成氨反应中,反应物的总键能小于产物的总键能 |
C.合成氨厂一般采用的压强为 ,因为该压强下铁触媒的活性最高 ,因为该压强下铁触媒的活性最高 |
D. 的量越多, 的量越多, 的转化率越大,因此,充入的 的转化率越大,因此,充入的 越多越有利于 越多越有利于 的合成 的合成 |
(3)在合成氨工业中,要使氨的产率增大,同时又能提高反应速率,可采取的措施有
①使用催化剂 ②恒温恒容,增大原料气
 和
和 充入量 ③及时分离产生的
充入量 ③及时分离产生的
④升高温度 ⑤恒温恒容,充入惰性气体
 使压强增大
使压强增大(4)氮的固定和氮的循环是几百年来科学家一直研究的课题。下表列举了不同温度下大气固氮和工业固氮的部分
 值。
值。| 反应 | 大气固氮 | 工业固氮 | |||
温度 | 27 | 2000 | 25 | 400 | 450 |
 |  | 0.1 | 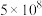 | 0.507 | 0.152 |
①在
 下模拟工业固氮,某时刻
下模拟工业固氮,某时刻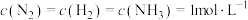 ,此时
,此时
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②人类不适合大规模模拟大气固氮的原因是
(5)为获得合成氨的原料气氢气,某科研小组以太阳能为热源分解
 ,经热化学铁氧化合物循环分解水制
,经热化学铁氧化合物循环分解水制 的过程如下。
的过程如下。已知:
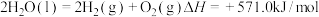 。
。
过程Ⅰ:
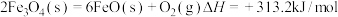
过程Ⅱ:……
过程Ⅱ的热化学方程式为
您最近一年使用:0次
2 . 能源是国民经济发展的重要基础。请根据所学知识回答下列问题:
Ⅰ.在标准状况下,1.68L家用燃料(仅由C、H两种元素组成的某气体)质量为1.2g,在25℃和101kPa下完全燃烧生成 和
和 时,放出66.77kJ的热量。
时,放出66.77kJ的热量。
(1)该气体的分子式为___________ 。该气体的燃烧热
___________ 。(保留一位小数)
Ⅱ.火箭发射时可以用肼( ,液态)作燃料,
,液态)作燃料, 作氧化剂,二者反应生成
作氧化剂,二者反应生成 和水蒸气。
和水蒸气。
已知:
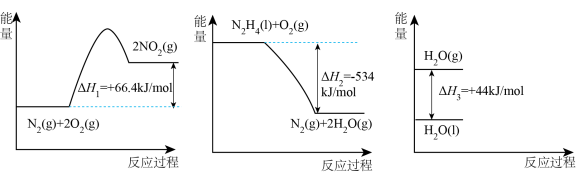
(2)请写出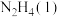 与
与 反应的热化学方程式
反应的热化学方程式___________ 。
(3)32g液态肼与足量 反应生成氮气和液态水时,放出的热量是
反应生成氮气和液态水时,放出的热量是___________ kJ。
(4)上述反应用于火箭推进器的原因:①能快速产生大量气体;②___________ 。
Ⅲ.氢能是一种极具发展潜力的清洁能源。 可用CO在高温下与水蒸气反应制得,是目前大规模制取氢气的方法之一
可用CO在高温下与水蒸气反应制得,是目前大规模制取氢气的方法之一
已知:在25℃、101kPa下,
①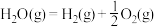
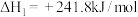
②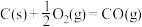
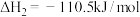
③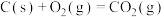

(5)25℃、101kPa下,CO与水蒸气反应转化为 和
和 的热化学方程式为
的热化学方程式为___________ 。
Ⅰ.在标准状况下,1.68L家用燃料(仅由C、H两种元素组成的某气体)质量为1.2g,在25℃和101kPa下完全燃烧生成
 和
和 时,放出66.77kJ的热量。
时,放出66.77kJ的热量。(1)该气体的分子式为

Ⅱ.火箭发射时可以用肼(
 ,液态)作燃料,
,液态)作燃料, 作氧化剂,二者反应生成
作氧化剂,二者反应生成 和水蒸气。
和水蒸气。已知:

(2)请写出
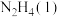 与
与 反应的热化学方程式
反应的热化学方程式(3)32g液态肼与足量
 反应生成氮气和液态水时,放出的热量是
反应生成氮气和液态水时,放出的热量是(4)上述反应用于火箭推进器的原因:①能快速产生大量气体;②
Ⅲ.氢能是一种极具发展潜力的清洁能源。
 可用CO在高温下与水蒸气反应制得,是目前大规模制取氢气的方法之一
可用CO在高温下与水蒸气反应制得,是目前大规模制取氢气的方法之一已知:在25℃、101kPa下,
①
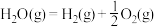
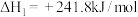
②
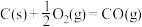
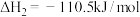
③
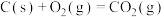

(5)25℃、101kPa下,CO与水蒸气反应转化为
 和
和 的热化学方程式为
的热化学方程式为
您最近一年使用:0次
解题方法
3 . 回答下列问题:
I.化石燃料燃烧过程中形成 和
和 等污染物,利用
等污染物,利用 脱除
脱除 的研究获得了广泛关注。在催化剂作用下,
的研究获得了广泛关注。在催化剂作用下, 与
与 的反应为
的反应为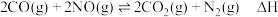 。回答下列问题:
。回答下列问题:
(1)已知: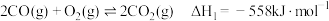
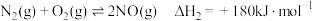
则
___________
(2)向某刚性容器中加入 、
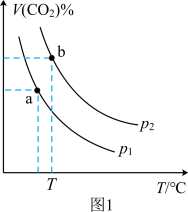
、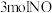 和催化剂,测得平衡时
和催化剂,测得平衡时 的体积分数随温度和压强的关系如图1所示。
的体积分数随温度和压强的关系如图1所示。
①下列叙述不能说明反应已经达到平衡状态的是___________ (填标号)。
A.断裂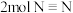 的同时生成
的同时生成
B.压强不再变化
C.混合气体的密度不再变化
D. 的体积分数不再变化
的体积分数不再变化
②压强
___________  (填“>”或“<”,下同),a、b两点的平衡常数
(填“>”或“<”,下同),a、b两点的平衡常数
___________  。
。
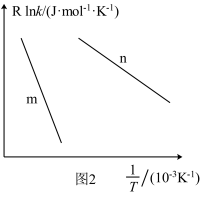
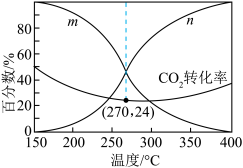
(3)已知Arrhenius经验公式为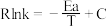 (Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能进行了实验探究,获得如图2曲线。从图中信息获知催化效能较高的催化剂是
(Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能进行了实验探究,获得如图2曲线。从图中信息获知催化效能较高的催化剂是___________ (填“m”或“n”)。
Ⅱ. 在催化剂作用下,通过电催化还原为
在催化剂作用下,通过电催化还原为 、
、 等物质被认为是一种具有前景的利用
等物质被认为是一种具有前景的利用 的方式。
的方式。
(4) 催化剂中引入
催化剂中引入 能够提高它的选择性。
能够提高它的选择性。 的价电子排布式为
的价电子排布式为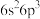 ,其在元素周期表中的位置为
,其在元素周期表中的位置为___________ 。
(5)写出 在酸性介质中电催化还原为
在酸性介质中电催化还原为 的电极反应式
的电极反应式___________ 。
I.化石燃料燃烧过程中形成
 和
和 等污染物,利用
等污染物,利用 脱除
脱除 的研究获得了广泛关注。在催化剂作用下,
的研究获得了广泛关注。在催化剂作用下, 与
与 的反应为
的反应为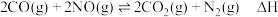 。回答下列问题:
。回答下列问题:(1)已知:
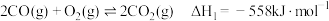
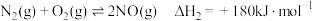
则

(2)向某刚性容器中加入
 、
、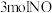 和催化剂,测得平衡时
和催化剂,测得平衡时 的体积分数随温度和压强的关系如图1所示。
的体积分数随温度和压强的关系如图1所示。
①下列叙述不能说明反应已经达到平衡状态的是
A.断裂
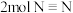 的同时生成
的同时生成
B.压强不再变化
C.混合气体的密度不再变化
D.
 的体积分数不再变化
的体积分数不再变化②压强

 (填“>”或“<”,下同),a、b两点的平衡常数
(填“>”或“<”,下同),a、b两点的平衡常数
 。
。(3)已知Arrhenius经验公式为
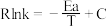 (Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能进行了实验探究,获得如图2曲线。从图中信息获知催化效能较高的催化剂是
(Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能进行了实验探究,获得如图2曲线。从图中信息获知催化效能较高的催化剂是
Ⅱ.
 在催化剂作用下,通过电催化还原为
在催化剂作用下,通过电催化还原为 、
、 等物质被认为是一种具有前景的利用
等物质被认为是一种具有前景的利用 的方式。
的方式。(4)
 催化剂中引入
催化剂中引入 能够提高它的选择性。
能够提高它的选择性。 的价电子排布式为
的价电子排布式为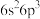 ,其在元素周期表中的位置为
,其在元素周期表中的位置为(5)写出
 在酸性介质中电催化还原为
在酸性介质中电催化还原为 的电极反应式
的电极反应式
您最近一年使用:0次
4 . 2030年实现“碳达峰”,2060年达到“碳中和”的承诺,体现了我国的大国风范。二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
二氧化碳加氢制甲醇涉及的反应可表示为:
①

②
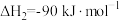
③
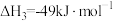
(1)根据上述反应求:④ 的
的
___________  。
。
(2)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上反应④的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。
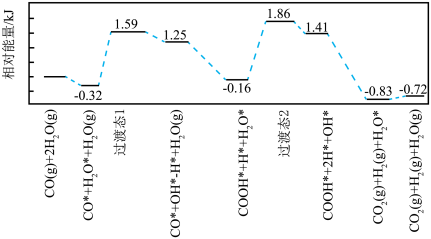
写出该历程中决速步骤的化学方程式:________ 。
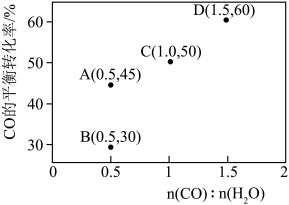
(3)一体积可变的密闭容器中,在保持a MPa下,按照 投料,平衡时,CO和CH3OH在含碳产物中物质的量分数及CO2的转化率随温度的变化如图所示:
投料,平衡时,CO和CH3OH在含碳产物中物质的量分数及CO2的转化率随温度的变化如图所示:
①图中m曲线代表的物质为________ 。
②下列说法正确的是________ (填标号)。
A.180~380℃范围内,H2的平衡转化率始终低于CO2
B.温度越高,越有利于工业生产CH3OH
C.一定时间内反应,加入选择性高的催化剂,可提高CH3OH的产率
D.150~400℃范围内,随着温度的升高,CO2的反应速率先减小后增大
③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数 ,270℃时反应①的分压平衡常数为
,270℃时反应①的分压平衡常数为________ (保留2位有效数字)。
(4)在一定条件下,密闭容器中加入一定量的CO、H2O(g)和催化剂仅发生反应 ,其速率方程为
,其速率方程为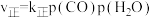 ,
,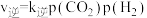 ,其中
,其中 、
、 为正、逆反应速率,
为正、逆反应速率, 、
、 分别为速率常数,p为气体的分压。已知降低温度时,
分别为速率常数,p为气体的分压。已知降低温度时, 增大,调整CO和H2O初始投料比,测得CO的平衡转化率如图,A、B、C、D四点中温度由高到低的顺序是
增大,调整CO和H2O初始投料比,测得CO的平衡转化率如图,A、B、C、D四点中温度由高到低的顺序是________ ,在C点所示投料比下,当CO转化率达到40%时,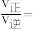
________ 。
二氧化碳加氢制甲醇涉及的反应可表示为:
①


②

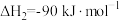
③

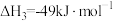
(1)根据上述反应求:④
 的
的
 。
。(2)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上反应④的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。

写出该历程中决速步骤的化学方程式:
(3)一体积可变的密闭容器中,在保持a MPa下,按照
 投料,平衡时,CO和CH3OH在含碳产物中物质的量分数及CO2的转化率随温度的变化如图所示:
投料,平衡时,CO和CH3OH在含碳产物中物质的量分数及CO2的转化率随温度的变化如图所示:
①图中m曲线代表的物质为
②下列说法正确的是
A.180~380℃范围内,H2的平衡转化率始终低于CO2
B.温度越高,越有利于工业生产CH3OH
C.一定时间内反应,加入选择性高的催化剂,可提高CH3OH的产率
D.150~400℃范围内,随着温度的升高,CO2的反应速率先减小后增大
③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数
 ,270℃时反应①的分压平衡常数为
,270℃时反应①的分压平衡常数为(4)在一定条件下,密闭容器中加入一定量的CO、H2O(g)和催化剂仅发生反应
 ,其速率方程为
,其速率方程为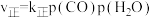 ,
,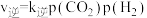 ,其中
,其中 、
、 为正、逆反应速率,
为正、逆反应速率, 、
、 分别为速率常数,p为气体的分压。已知降低温度时,
分别为速率常数,p为气体的分压。已知降低温度时, 增大,调整CO和H2O初始投料比,测得CO的平衡转化率如图,A、B、C、D四点中温度由高到低的顺序是
增大,调整CO和H2O初始投料比,测得CO的平衡转化率如图,A、B、C、D四点中温度由高到低的顺序是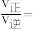

您最近一年使用:0次
2023-06-29更新
|
389次组卷
|
2卷引用:湖北省咸宁市2022-2023学年高二下学期期末考试化学试题
名校
5 . 科学家开发铜基掺杂锌催化剂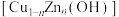 提高乙炔加氢制备乙烯的活性(如图所示)。回答下列问题:
提高乙炔加氢制备乙烯的活性(如图所示)。回答下列问题:
(1)已知:
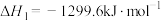

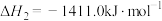
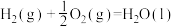
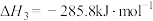
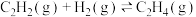

___________  ,为了提高乙烯的平衡收率(乙烯收率等于实际乙烯产量与乙烯的理论产量之比),宜选择的条件是
,为了提高乙烯的平衡收率(乙烯收率等于实际乙烯产量与乙烯的理论产量之比),宜选择的条件是___________ (填标号)。
A.高温高压 B.低温高压 C.高温低压 D.低温低压
(2)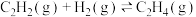 的速率方程为
的速率方程为 ,
,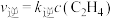 (
( 、
、 为正、逆反应速率常数,只与温度、催化剂有关,与浓度无关)。
为正、逆反应速率常数,只与温度、催化剂有关,与浓度无关)。
①达到平衡后,改变下列条件,能使 增大的是
增大的是___________ (填标号)。
A.加入高效催化剂 B.增大氢气浓度 C.降低反应温度 D.增大反应压强
②向某恒容密闭容器中充入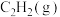 和
和 ,同时发生反应
,同时发生反应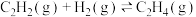 和
和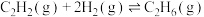 。下列能表明反应达到平衡状态的是
。下列能表明反应达到平衡状态的是___________ (填标号)。
A.容器内气体密度不随时间变化
B.容器内气体总压强不随时间变化
C.单位时间内,断裂和形成的H—H键数目相等
D.容器内
(3)100℃时,在 恒容密闭容器中充入
恒容密闭容器中充入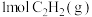 和
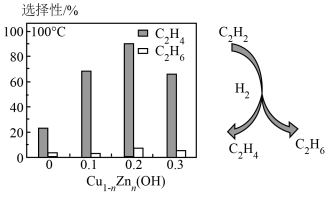
和 ,实验测得单位时间内乙炔转化率、乙烷选择性[乙烷选择性
,实验测得单位时间内乙炔转化率、乙烷选择性[乙烷选择性 %]与
%]与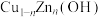 中n值的关系如图所示。
中n值的关系如图所示。
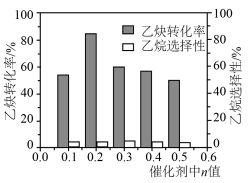
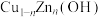 中n的最佳值为
中n的最佳值为___________ (填“0.1”、“0.2”或“0.3”)。若在 内乙炔转化率为80%,乙烷选择性为4%,则
内乙炔转化率为80%,乙烷选择性为4%,则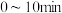 内
内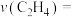
___________  。
。
(4)一定条件下,向一密闭容器中充入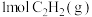 和
和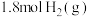 仅发生反应
仅发生反应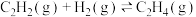 ,压强为
,压强为 和
和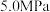 下
下 平衡转化率随温度的变化关系如图。
平衡转化率随温度的变化关系如图。
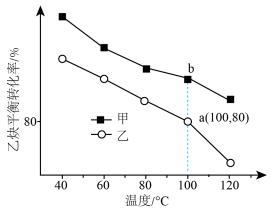
①甲对应的压强为___________ 。
②a点对应的 平衡转化率为
平衡转化率为___________ %(保留3位有效数字)。
③100℃时,b点对应的平衡常数
___________  (提示:分压=总压×物质的量分数)。
(提示:分压=总压×物质的量分数)。
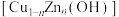 提高乙炔加氢制备乙烯的活性(如图所示)。回答下列问题:
提高乙炔加氢制备乙烯的活性(如图所示)。回答下列问题:
(1)已知:

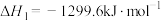

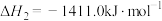
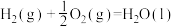
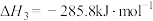
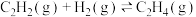

 ,为了提高乙烯的平衡收率(乙烯收率等于实际乙烯产量与乙烯的理论产量之比),宜选择的条件是
,为了提高乙烯的平衡收率(乙烯收率等于实际乙烯产量与乙烯的理论产量之比),宜选择的条件是A.高温高压 B.低温高压 C.高温低压 D.低温低压
(2)
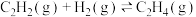 的速率方程为
的速率方程为 ,
,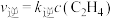 (
( 、
、 为正、逆反应速率常数,只与温度、催化剂有关,与浓度无关)。
为正、逆反应速率常数,只与温度、催化剂有关,与浓度无关)。①达到平衡后,改变下列条件,能使
 增大的是
增大的是A.加入高效催化剂 B.增大氢气浓度 C.降低反应温度 D.增大反应压强
②向某恒容密闭容器中充入
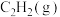 和
和 ,同时发生反应
,同时发生反应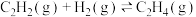 和
和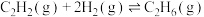 。下列能表明反应达到平衡状态的是
。下列能表明反应达到平衡状态的是A.容器内气体密度不随时间变化
B.容器内气体总压强不随时间变化
C.单位时间内,断裂和形成的H—H键数目相等
D.容器内

(3)100℃时,在
 恒容密闭容器中充入
恒容密闭容器中充入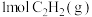 和
和 ,实验测得单位时间内乙炔转化率、乙烷选择性[乙烷选择性
,实验测得单位时间内乙炔转化率、乙烷选择性[乙烷选择性 %]与
%]与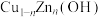 中n值的关系如图所示。
中n值的关系如图所示。
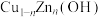 中n的最佳值为
中n的最佳值为 内乙炔转化率为80%,乙烷选择性为4%,则
内乙炔转化率为80%,乙烷选择性为4%,则 内
内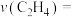
 。
。(4)一定条件下,向一密闭容器中充入
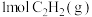 和
和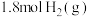 仅发生反应
仅发生反应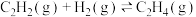 ,压强为
,压强为 和
和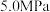 下
下 平衡转化率随温度的变化关系如图。
平衡转化率随温度的变化关系如图。
①甲对应的压强为
②a点对应的
 平衡转化率为
平衡转化率为③100℃时,b点对应的平衡常数

 (提示:分压=总压×物质的量分数)。
(提示:分压=总压×物质的量分数)。
您最近一年使用:0次
2023-06-27更新
|
113次组卷
|
2卷引用:湖北省十堰市2022-2023学年高二下学期期末调研考试化学试题
6 . 一定条件下,水气变换反应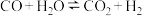 的中间产物是
的中间产物是 。为探究该反应过程,研究
。为探究该反应过程,研究 水溶液在密封石英管中的分解反应:
水溶液在密封石英管中的分解反应:
Ⅰ.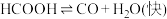
Ⅱ.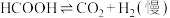
研究发现,在反应Ⅰ、Ⅱ中, 仅对反应Ⅰ有催加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:
仅对反应Ⅰ有催加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:
(1)一定条件下,反应Ⅰ、Ⅱ的焓变分别为 、
、 ,则该条件下水气变换反应的焓变
,则该条件下水气变换反应的焓变
_____ (用含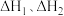 的代数式表示)。
的代数式表示)。
(2)反应Ⅰ正反应速率方程为: ,k为反应速率常数。
,k为反应速率常数。 温度下,
温度下, 电离平衡常数为
电离平衡常数为 ,当
,当 平衡浓度为
平衡浓度为 时,
时, 浓度为
浓度为_____  ,此时反应Ⅰ的反应速率
,此时反应Ⅰ的反应速率
_____  (用含
(用含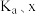 和k的代数式表示)。
和k的代数式表示)。
(3) 温度下,在密封石英管内完全充满
温度下,在密封石英管内完全充满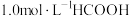 水溶液,使
水溶液,使 分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。
分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。 时刻测得
时刻测得 的浓度分别为
的浓度分别为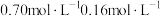 ,反应Ⅱ达平衡时,测得
,反应Ⅱ达平衡时,测得 的浓度为
的浓度为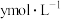 。体系达平衡后
。体系达平衡后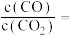
_____ (用含y的代数式表示,下同),反应Ⅱ的平衡常数为_____ 。
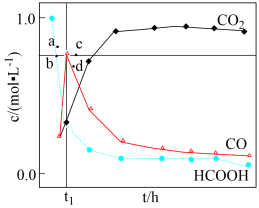
相同条件下,若反应起始时溶液中同时还含有 盐酸,则图示点
盐酸,则图示点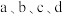 中,
中, 的浓度峰值点可能是
的浓度峰值点可能是_____ (填标号)。与不含盐酸相比, 达浓度峰值时,
达浓度峰值时, 浓度
浓度_____ (填“增大”“减小”或“不变”), 的值
的值_____ (填“增大”“减小”或“不变”)。
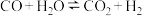 的中间产物是
的中间产物是 。为探究该反应过程,研究
。为探究该反应过程,研究 水溶液在密封石英管中的分解反应:
水溶液在密封石英管中的分解反应:Ⅰ.
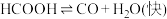
Ⅱ.
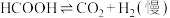
研究发现,在反应Ⅰ、Ⅱ中,
 仅对反应Ⅰ有催加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:
仅对反应Ⅰ有催加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:(1)一定条件下,反应Ⅰ、Ⅱ的焓变分别为
 、
、 ,则该条件下水气变换反应的焓变
,则该条件下水气变换反应的焓变
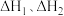 的代数式表示)。
的代数式表示)。(2)反应Ⅰ正反应速率方程为:
 ,k为反应速率常数。
,k为反应速率常数。 温度下,
温度下, 电离平衡常数为
电离平衡常数为 ,当
,当 平衡浓度为
平衡浓度为 时,
时, 浓度为
浓度为 ,此时反应Ⅰ的反应速率
,此时反应Ⅰ的反应速率
 (用含
(用含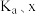 和k的代数式表示)。
和k的代数式表示)。(3)
 温度下,在密封石英管内完全充满
温度下,在密封石英管内完全充满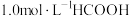 水溶液,使
水溶液,使 分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。
分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。 时刻测得
时刻测得 的浓度分别为
的浓度分别为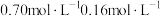 ,反应Ⅱ达平衡时,测得
,反应Ⅱ达平衡时,测得 的浓度为
的浓度为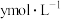 。体系达平衡后
。体系达平衡后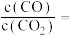

相同条件下,若反应起始时溶液中同时还含有
 盐酸,则图示点
盐酸,则图示点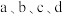 中,
中, 的浓度峰值点可能是
的浓度峰值点可能是 达浓度峰值时,
达浓度峰值时, 浓度
浓度 的值
的值
您最近一年使用:0次
2023-06-19更新
|
10707次组卷
|
10卷引用:湖北省武汉市第二中学2023-2024学年高二上学期10月月考化学试题
湖北省武汉市第二中学2023-2024学年高二上学期10月月考化学试题四川省宜宾市第四中学校2022-2023学年高二下学期6月期末化学试题(已下线)第20练 化学反应原理综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)湖北省武汉市第二中学2023-2024学年高三上学期10月月考化学试题(已下线)专题04 电离平衡 水的电离和溶液的pH-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)2023年高考山东卷化学真题(已下线)2023年高考山东卷化学真题变式题(原理综合题)(已下线)专题17 原理综合题(已下线)专题17 原理综合题(已下线)专题15 化学反应原理综合题-2023年高考化学真题题源解密(全国通用)
解题方法
7 . I.研究电解质在水溶液中的离子反应与平衡有重要的意义。
(1) 下,将
下,将 的
的 溶液
溶液 与
与 的
的 溶液
溶液 混合,若所得溶液
混合,若所得溶液 ,则
,则
_______ 。
(2)已知 时,
时, 的溶度积常数
的溶度积常数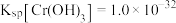 。则使
。则使 恰好完全沉淀,即溶液中
恰好完全沉淀,即溶液中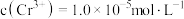 时,应调节
时,应调节 为
为_______ 。
(3)已知: 下
下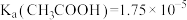 。
。
 下将
下将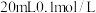 的
的 溶液与
溶液与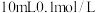 的
的 溶液混合后,所得混合溶液中离子浓度由大到小的顺序为
溶液混合后,所得混合溶液中离子浓度由大到小的顺序为_______ 。
II.2022年11月29日23时08分,我国在酒泉卫星发射中心使用长征二号F遥十五火箭,成功将神舟十五号载人飞船发射升空,是空间站建造阶段最后一次载人飞行任务。
(4)火箭发射时可以用肼( ,液态)作燃料,
,液态)作燃料, 作氧化剂,二者反应生成
作氧化剂,二者反应生成 和水蒸气。已知:
和水蒸气。已知:
①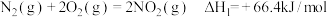
②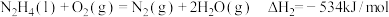
请写出 与
与 反应的热化学方程式:
反应的热化学方程式:_______ 。
(5)二甲醚 是一种新型能源,被誉为“21世纪的清洁燃料”。
是一种新型能源,被誉为“21世纪的清洁燃料”。
用 和
和 合成二甲醚的主反应为:
合成二甲醚的主反应为: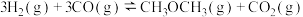
制备过程中还会发生副反应:
①在恒温恒容体系中,下列能判断主反应达到平衡状态的是_______ (填字母)。
A.气体的平均相对分子质量不变
B.气体的密度不再发生变化
C.每断裂 键的同时断裂
键的同时断裂 的
的 键
键
D.二甲醚的体积分数不再变化
②在实验室模拟进行二甲醚制备实验,在 刚性容器中,起始加入
刚性容器中,起始加入 和
和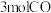 ,体系起始总压为
,体系起始总压为 ,体系温度保持恒温(在该温度下甲醇为气态)。经实验测定,平衡时
,体系温度保持恒温(在该温度下甲醇为气态)。经实验测定,平衡时 且
且 的体积分数为
的体积分数为 ,则
,则 的平衡转化率为
的平衡转化率为_______ (写成百分数形式,保留一位小数),该温度下主反应的
_______ 。
(1)
 下,将
下,将 的
的 溶液
溶液 与
与 的
的 溶液
溶液 混合,若所得溶液
混合,若所得溶液 ,则
,则
(2)已知
 时,
时, 的溶度积常数
的溶度积常数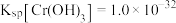 。则使
。则使 恰好完全沉淀,即溶液中
恰好完全沉淀,即溶液中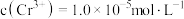 时,应调节
时,应调节 为
为(3)已知:
 下
下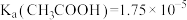 。
。 下将
下将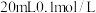 的
的 溶液与
溶液与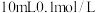 的
的 溶液混合后,所得混合溶液中离子浓度由大到小的顺序为
溶液混合后,所得混合溶液中离子浓度由大到小的顺序为II.2022年11月29日23时08分,我国在酒泉卫星发射中心使用长征二号F遥十五火箭,成功将神舟十五号载人飞船发射升空,是空间站建造阶段最后一次载人飞行任务。
(4)火箭发射时可以用肼(
 ,液态)作燃料,
,液态)作燃料, 作氧化剂,二者反应生成
作氧化剂,二者反应生成 和水蒸气。已知:
和水蒸气。已知:①
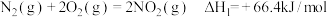
②
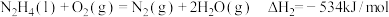
请写出
 与
与 反应的热化学方程式:
反应的热化学方程式:(5)二甲醚
 是一种新型能源,被誉为“21世纪的清洁燃料”。
是一种新型能源,被誉为“21世纪的清洁燃料”。用
 和
和 合成二甲醚的主反应为:
合成二甲醚的主反应为: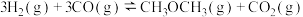
制备过程中还会发生副反应:

①在恒温恒容体系中,下列能判断主反应达到平衡状态的是
A.气体的平均相对分子质量不变
B.气体的密度不再发生变化
C.每断裂
 键的同时断裂
键的同时断裂 的
的 键
键D.二甲醚的体积分数不再变化
②在实验室模拟进行二甲醚制备实验,在
 刚性容器中,起始加入
刚性容器中,起始加入 和
和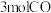 ,体系起始总压为
,体系起始总压为 ,体系温度保持恒温(在该温度下甲醇为气态)。经实验测定,平衡时
,体系温度保持恒温(在该温度下甲醇为气态)。经实验测定,平衡时 且
且 的体积分数为
的体积分数为 ,则
,则 的平衡转化率为
的平衡转化率为
您最近一年使用:0次
解题方法
8 . 党的二十大报告中指出:积极稳妥推进碳达峰碳中和,立足我国能源资源禀赋,坚持先立后破,有计划分步骤实施碳达峰行动。因此CO2的捕集和利用成了研究的重点。
(1)一种从空气中捕获CO2的转化原理如图所示。
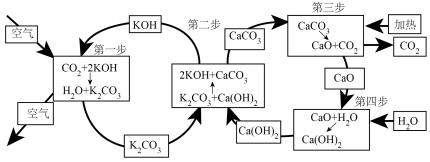
已知图中涉及的四步反应中,△H1=-193.7kJ•mol-1、△H3=+179.2kJ•mol-1、△H4=-64.5kJ•mol-1,则△H2=_____ kJ•mol-1。(四步反应中相同物质的状态相同)
(2)CH4-CO2催化重整对温室气体的减排具有重要意义。T1℃时,在体积为10L的恒温恒容的密闭容器中充入等物质的量的CH4(g)和CO2(g),同时进行反应:
I.CH4(g)+CO2(g) 2CO(g)+2H2(g) △H=+246.9kJ•mol-1;
2CO(g)+2H2(g) △H=+246.9kJ•mol-1;
II.CO(g)+3H2(g) CH4(g)+H2O(g) △H=-205.7kJ•mol-1。
CH4(g)+H2O(g) △H=-205.7kJ•mol-1。
体系中各组分的物质的量随时间的变化如图所示,H2O(g)的物质的量变化情况如曲线D所示。
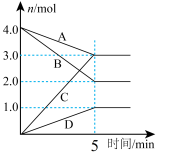
①图中表示两种组分的是曲线_____ (填标号),曲线B表示的物质为_____ (填化学式)。
②CH4-CO2催化重整的目的主要是获得更多的合成气(CO和H2),则反应I更适宜的条件是_____ (填标号)。
A.高温、高压 B.高温、低压 C.低温、高压 D.低温、低压
③T1℃时,用CH4表示从开始到5min时的平均反应速率v(CH4)=_____ mol•L-1•min-1。反应I的平衡常数K=_____ 。
(3)利用固体氧化物电解池可将CO2和H2O转化为合成气并生产高纯度O2,原理如图3所示。a极为_____ (填“阴极”或“阳极”),写出b极上参加反应的CO2和H2O(物质的量比1:1)发生的电极反应:_____ 。

(1)一种从空气中捕获CO2的转化原理如图所示。

已知图中涉及的四步反应中,△H1=-193.7kJ•mol-1、△H3=+179.2kJ•mol-1、△H4=-64.5kJ•mol-1,则△H2=
(2)CH4-CO2催化重整对温室气体的减排具有重要意义。T1℃时,在体积为10L的恒温恒容的密闭容器中充入等物质的量的CH4(g)和CO2(g),同时进行反应:
I.CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H=+246.9kJ•mol-1;
2CO(g)+2H2(g) △H=+246.9kJ•mol-1;II.CO(g)+3H2(g)
 CH4(g)+H2O(g) △H=-205.7kJ•mol-1。
CH4(g)+H2O(g) △H=-205.7kJ•mol-1。体系中各组分的物质的量随时间的变化如图所示,H2O(g)的物质的量变化情况如曲线D所示。

①图中表示两种组分的是曲线
②CH4-CO2催化重整的目的主要是获得更多的合成气(CO和H2),则反应I更适宜的条件是
A.高温、高压 B.高温、低压 C.低温、高压 D.低温、低压
③T1℃时,用CH4表示从开始到5min时的平均反应速率v(CH4)=
(3)利用固体氧化物电解池可将CO2和H2O转化为合成气并生产高纯度O2,原理如图3所示。a极为

您最近一年使用:0次
2023-05-25更新
|
52次组卷
|
2卷引用:湖北省孝感市部分学校2022-2023学年高二下学期5月联考化学试题
解题方法
9 . 氨的用途十分广泛,是现代工业、农业生产最基础的化工原料之一。
I.以氨为原料可生产尿素:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g) ΔH, 其反应分两步进行:
CO(NH2)2(l)+H2O(g) ΔH, 其反应分两步进行:
①2NH3(g)+CO2(g) NH2COONH4(l) ΔH1=−117kJ·mol−1
NH2COONH4(l) ΔH1=−117kJ·mol−1
②NH2COONH4(l) CO(NH2)2(l)+H2O(g) ΔH2=+15kJ·mol−1
CO(NH2)2(l)+H2O(g) ΔH2=+15kJ·mol−1
(1)生产尿素的决速步骤是第二步,可判断活化能较小的是_______ (填“①”或“②”)。
(2)总反应的ΔH=_______ 。
Ⅱ.传统的“哈伯法”合成氨原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ·mol−1 ΔS=−200J·K−1·mol−1
2NH3(g) ΔH=-92.4kJ·mol−1 ΔS=−200J·K−1·mol−1
(3)上述反应在常温下_______ (填“能”或“不能”)自发进行。
(4)一定条件下,在恒温恒容的密闭容器中充入等物质的量的N2和H2发生反应生成NH3下列状态能说明反应达到平衡的是_______(填标号)。
(5)科研小组模拟不同条件下的合成氨反应,向体积可变的密闭容器中充入6mol N2和10mol H2,不同温度下平衡时氨气的体积分数与总压强(p)的关系如图所示。
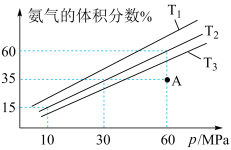
①T1、T2、T3由小到大的顺序为_______ 。
②在T2、60MPa条件下,平衡时N2的转化率为_______ %;平衡常数Kp=_______ (保留两位有效数字)。(用平衡分压代替平衡浓度,分压=总压x物质的量分数)
I.以氨为原料可生产尿素:2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(g) ΔH, 其反应分两步进行:
CO(NH2)2(l)+H2O(g) ΔH, 其反应分两步进行:①2NH3(g)+CO2(g)
 NH2COONH4(l) ΔH1=−117kJ·mol−1
NH2COONH4(l) ΔH1=−117kJ·mol−1②NH2COONH4(l)
 CO(NH2)2(l)+H2O(g) ΔH2=+15kJ·mol−1
CO(NH2)2(l)+H2O(g) ΔH2=+15kJ·mol−1(1)生产尿素的决速步骤是第二步,可判断活化能较小的是
(2)总反应的ΔH=
Ⅱ.传统的“哈伯法”合成氨原理为:N2(g)+3H2(g)
 2NH3(g) ΔH=-92.4kJ·mol−1 ΔS=−200J·K−1·mol−1
2NH3(g) ΔH=-92.4kJ·mol−1 ΔS=−200J·K−1·mol−1(3)上述反应在常温下
(4)一定条件下,在恒温恒容的密闭容器中充入等物质的量的N2和H2发生反应生成NH3下列状态能说明反应达到平衡的是_______(填标号)。
| A.容器内气体的平均摩尔质量不变 | B.N2的体积分数不变 |
| C.混合气体的颜色不再改变 | D.3v正(NH3)=2v逆(H2) |

①T1、T2、T3由小到大的顺序为
②在T2、60MPa条件下,平衡时N2的转化率为
您最近一年使用:0次
名校
10 . 我国力争于2030年前实现碳达峰,2060年前实现碳中和。CO2催化加氢合成二甲醚是一种实现“碳中和”理想的CO2转化方法。该过程中涉及的反应如下:
主反应:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)
副反应:CO2(g)+H2(g)⇌CO(g)+H2O(g)
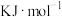
回答下列问题:
(1)主反应通过以下步骤来实现:
Ⅰ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)

Ⅱ.2CH3OH(g)⇌CH3OCH3(g)+H2O(g)

则主反应的 =
=_______  。
。
(2)在恒压、CO2和H2的起始量一定时,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如下图所示,CH3OCH3的选择性=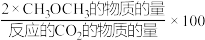 %。
%。
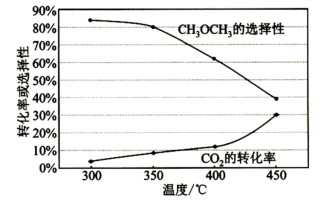
①CO2平衡转化率随温度升高而增大的原因是_______ 。
②420℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性约为50%。不改变反应时间,一定能提高CH3OCH3选择性的措施有_______ (填标号)。
A.升高温度B.增大压强C.增大c(CO2)D.更换适宜的催化剂
(3)在温度为543K、原料组成为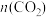 :
: =1:3、初始总压为4MPa的恒容密闭容器中进行反应,体系达到平衡时CO2的转化率为30%,二甲醚的选择性为50%,则氢气的转化率
=1:3、初始总压为4MPa的恒容密闭容器中进行反应,体系达到平衡时CO2的转化率为30%,二甲醚的选择性为50%,则氢气的转化率 =
=_______ ;副反应的压强平衡常数 =
=_______ (保留两位有效数字)。
(4)二甲醚直接燃料电池具有启动快、效率高、能量密度大等优点。若电解质溶液呈碱性,二甲醚直接燃料电池的负极反应为_______ ,该电池的理论输出电压为1.20V,能量密度E=_______ 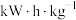 (精确到小数点后1位。能量密度=电池输出电能/燃料质量,
(精确到小数点后1位。能量密度=电池输出电能/燃料质量,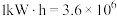 J,电子电量为1.6×10-19库伦,阿伏伽德罗常数为6.02×1023)。
J,电子电量为1.6×10-19库伦,阿伏伽德罗常数为6.02×1023)。
主反应:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)

副反应:CO2(g)+H2(g)⇌CO(g)+H2O(g)
回答下列问题:
(1)主反应通过以下步骤来实现:
Ⅰ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)


Ⅱ.2CH3OH(g)⇌CH3OCH3(g)+H2O(g)


则主反应的
 =
= 。
。(2)在恒压、CO2和H2的起始量一定时,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如下图所示,CH3OCH3的选择性=
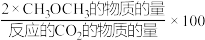 %。
%。
①CO2平衡转化率随温度升高而增大的原因是
②420℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性约为50%。不改变反应时间,一定能提高CH3OCH3选择性的措施有
A.升高温度B.增大压强C.增大c(CO2)D.更换适宜的催化剂
(3)在温度为543K、原料组成为
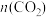 :
: =1:3、初始总压为4MPa的恒容密闭容器中进行反应,体系达到平衡时CO2的转化率为30%,二甲醚的选择性为50%,则氢气的转化率
=1:3、初始总压为4MPa的恒容密闭容器中进行反应,体系达到平衡时CO2的转化率为30%,二甲醚的选择性为50%,则氢气的转化率 =
= =
=(4)二甲醚直接燃料电池具有启动快、效率高、能量密度大等优点。若电解质溶液呈碱性,二甲醚直接燃料电池的负极反应为
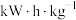 (精确到小数点后1位。能量密度=电池输出电能/燃料质量,
(精确到小数点后1位。能量密度=电池输出电能/燃料质量,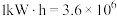 J,电子电量为1.6×10-19库伦,阿伏伽德罗常数为6.02×1023)。
J,电子电量为1.6×10-19库伦,阿伏伽德罗常数为6.02×1023)。
您最近一年使用:0次



