解题方法
1 . 我国的能源以煤炭为主,燃煤烟气中 、
、 等有害气体的排放会污染环境,用
等有害气体的排放会污染环境,用 还原脱除
还原脱除 将其转化为单质硫,对工业生产具有重要的意义。
将其转化为单质硫,对工业生产具有重要的意义。
(1) 与
与 的反应为
的反应为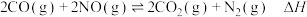
已知: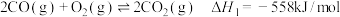
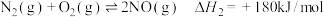
则
________
(2)在某温度时,进行 还原脱除
还原脱除 :
: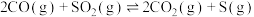 。
。
①若在刚性容器中进行,下列说法一定能确定反应达到平衡状态的是________ 。
A. B.
B. 与
与 的浓度之比不再改变
的浓度之比不再改变
C.容器内的压强不再改变 D.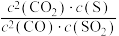 的值不再改变
的值不再改变
②若控制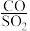 进料比(物质的量)为
进料比(物质的量)为 ,反应达平衡时,混合气体中
,反应达平衡时,混合气体中 的体积分数为
的体积分数为 ,则该反应在此温度下的平衡常数为
,则该反应在此温度下的平衡常数为___________ 。
(3)在600℃时,发生如下系列反应( 、
、 、
、 为平衡常数),测得不同
为平衡常数),测得不同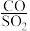 进料比(物质的量)下平衡体系各物质分布如图所示(图中SO2起始投料固定为
进料比(物质的量)下平衡体系各物质分布如图所示(图中SO2起始投料固定为 )。
)。
反应I: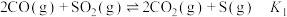
反应II:
反应III: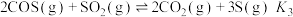
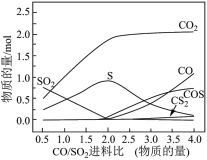
①该条件下,为减少有毒物质 的产生,同时脱除SO2,实际生产中应控
的产生,同时脱除SO2,实际生产中应控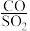 制进料比为
制进料比为___________ 。
②根据图中曲线,可判断
___________  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
(4)SO2—空气质子交换膜燃料电池也可用于处理SO2,其原理如下图。

①写出a极的电极反应式___________ 。
②若用该电池处理标准状况下SO2含量为20%的燃煤烟气3.36L,则理论上电路中转移电子数为_______ ( 表示阿伏伽德罗常数的值)。
表示阿伏伽德罗常数的值)。
 、
、 等有害气体的排放会污染环境,用
等有害气体的排放会污染环境,用 还原脱除
还原脱除 将其转化为单质硫,对工业生产具有重要的意义。
将其转化为单质硫,对工业生产具有重要的意义。(1)
 与
与 的反应为
的反应为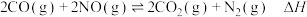
已知:
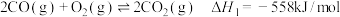
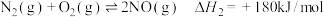
则

(2)在某温度时,进行
 还原脱除
还原脱除 :
: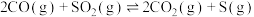 。
。①若在刚性容器中进行,下列说法一定能确定反应达到平衡状态的是
A.
 B.
B. 与
与 的浓度之比不再改变
的浓度之比不再改变C.容器内的压强不再改变 D.
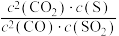 的值不再改变
的值不再改变②若控制
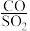 进料比(物质的量)为
进料比(物质的量)为 ,反应达平衡时,混合气体中
,反应达平衡时,混合气体中 的体积分数为
的体积分数为 ,则该反应在此温度下的平衡常数为
,则该反应在此温度下的平衡常数为(3)在600℃时,发生如下系列反应(
 、
、 、
、 为平衡常数),测得不同
为平衡常数),测得不同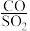 进料比(物质的量)下平衡体系各物质分布如图所示(图中SO2起始投料固定为
进料比(物质的量)下平衡体系各物质分布如图所示(图中SO2起始投料固定为 )。
)。反应I:
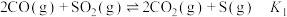
反应II:

反应III:
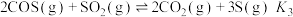

①该条件下,为减少有毒物质
 的产生,同时脱除SO2,实际生产中应控
的产生,同时脱除SO2,实际生产中应控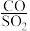 制进料比为
制进料比为②根据图中曲线,可判断

 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。(4)SO2—空气质子交换膜燃料电池也可用于处理SO2,其原理如下图。

①写出a极的电极反应式
②若用该电池处理标准状况下SO2含量为20%的燃煤烟气3.36L,则理论上电路中转移电子数为
 表示阿伏伽德罗常数的值)。
表示阿伏伽德罗常数的值)。
您最近一年使用:0次
2 . 氮氧化物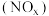 排放到大气中会严重危害人体健康。
排放到大气中会严重危害人体健康。 技术是去除NOx最为有效的技术之一,在催化剂条件下,以
技术是去除NOx最为有效的技术之一,在催化剂条件下,以 将尾气中NOx还原为
将尾气中NOx还原为 从而降低污染。
从而降低污染。
(1)反应Ⅰ:
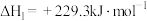
反应Ⅱ: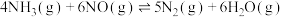
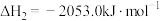
反应Ⅲ:

则:ΔH3=_______ kJ/mol
(2)用 去除尾气中的NOx,当
去除尾气中的NOx,当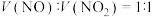 时,可发生“快速
时,可发生“快速 反应”,其有利于增大NOx脱除率。该反应的化学方程式为
反应”,其有利于增大NOx脱除率。该反应的化学方程式为___________ 。
(3)研究发现加入臭氧会发生反应: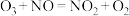 ,对
,对 技术去除NOx有一定的辅助作用。
技术去除NOx有一定的辅助作用。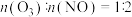 时,
时, 脱除率较高,原因是
脱除率较高,原因是___________ 。
(4)一定温度下,向 恒容密闭容器中充入
恒容密闭容器中充入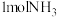 和
和 ,仅发生反应Ⅱ,起始压强为
,仅发生反应Ⅱ,起始压强为 ,反应过程中
,反应过程中 的物质的量如下表所示:
的物质的量如下表所示:
 内,该反应的平均反应速率
内,该反应的平均反应速率
___________ 。该反应的平衡常数
___________ (列出计算式)。
(5)利用隔膜电解法脱除废气中的 的装置如图所示。
的装置如图所示。
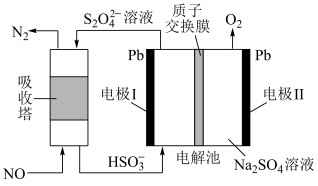
电解池中阴极的电极反应式为___________ 。当处理 的物质的量为
的物质的量为 时,阳极区电解质溶液的质量减少
时,阳极区电解质溶液的质量减少___________  。
。
 排放到大气中会严重危害人体健康。
排放到大气中会严重危害人体健康。 技术是去除NOx最为有效的技术之一,在催化剂条件下,以
技术是去除NOx最为有效的技术之一,在催化剂条件下,以 将尾气中NOx还原为
将尾气中NOx还原为 从而降低污染。
从而降低污染。(1)反应Ⅰ:

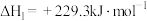
反应Ⅱ:
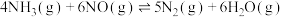
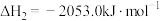
反应Ⅲ:


则:ΔH3=
(2)用
 去除尾气中的NOx,当
去除尾气中的NOx,当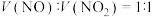 时,可发生“快速
时,可发生“快速 反应”,其有利于增大NOx脱除率。该反应的化学方程式为
反应”,其有利于增大NOx脱除率。该反应的化学方程式为(3)研究发现加入臭氧会发生反应:
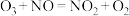 ,对
,对 技术去除NOx有一定的辅助作用。
技术去除NOx有一定的辅助作用。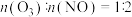 时,
时, 脱除率较高,原因是
脱除率较高,原因是(4)一定温度下,向
 恒容密闭容器中充入
恒容密闭容器中充入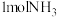 和
和 ,仅发生反应Ⅱ,起始压强为
,仅发生反应Ⅱ,起始压强为 ,反应过程中
,反应过程中 的物质的量如下表所示:
的物质的量如下表所示: | 0 | 5 | 10 | 20 | 30 | 40 |
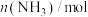 | 1 | 0.8 | 0.7 | 0.6 | 0.6 | 0.6 |
 内,该反应的平均反应速率
内,该反应的平均反应速率

(5)利用隔膜电解法脱除废气中的
 的装置如图所示。
的装置如图所示。
电解池中阴极的电极反应式为
 的物质的量为
的物质的量为 时,阳极区电解质溶液的质量减少
时,阳极区电解质溶液的质量减少 。
。
您最近一年使用:0次
名校
解题方法
3 . 探究甲醇对丙烷制丙烯的影响。丙烷制烯烃过程主要发生的反应有
ⅰ.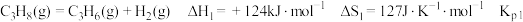
ⅱ.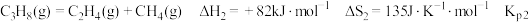
ⅲ.
已知: 为用气体分压表示的平衡常数,分压=物质的量分数×总压。在
为用气体分压表示的平衡常数,分压=物质的量分数×总压。在 下,丙烷单独进料时,平衡体系中各组分的体积分数
下,丙烷单独进料时,平衡体系中各组分的体积分数 见下表。
见下表。
(1)比较反应自发进行(∆G=∆H-T∆S<0)的最低温度,反应ⅰ_____ 反应 ⅱ(填“>”或“<”)。
(2)①从初始投料到达到平衡,反应 ⅰ、ⅱ、ⅲ 的丙烷消耗的平均速率从大到小的顺序为:_____ 。
②平衡体系中检测不到 ,可认为存在反应:
,可认为存在反应: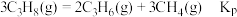 ,下列相关说法正确的是
,下列相关说法正确的是_____ (填标号)。
a.
b.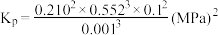
c.使用催化剂,可提高丙烯的平衡产率
d.平衡后再通入少量丙烷,可提高丙烯的体积分数
③由表中数据推算:丙烯选择性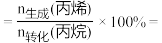
_____ (列出计算式)。
(3)丙烷甲醇共进料时,还发生反应:ⅳ.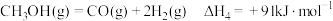 ,在
,在 下,平衡体系中各组分体积分数与进料比的关系如图所示。
下,平衡体系中各组分体积分数与进料比的关系如图所示。
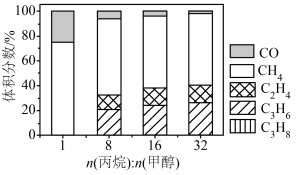
①进料比n(丙烷):n(甲醇) 时,体系总反应:
时,体系总反应: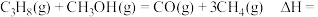
______  。
。
②随着甲醇投料增加,平衡体系中丙烯的体积分数降低的原因是______ 。
ⅰ.
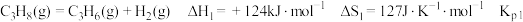
ⅱ.
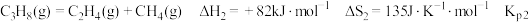
ⅲ.

已知:
 为用气体分压表示的平衡常数,分压=物质的量分数×总压。在
为用气体分压表示的平衡常数,分压=物质的量分数×总压。在 下,丙烷单独进料时,平衡体系中各组分的体积分数
下,丙烷单独进料时,平衡体系中各组分的体积分数 见下表。
见下表。| 物质 | 丙烯 | 乙烯 | 甲烷 | 丙烷 | 氢气 |
| 体积分数(%) | 21 | 23.7 | 55.2 | 0.1 | 0 |
(1)比较反应自发进行(∆G=∆H-T∆S<0)的最低温度,反应ⅰ
(2)①从初始投料到达到平衡,反应 ⅰ、ⅱ、ⅲ 的丙烷消耗的平均速率从大到小的顺序为:
②平衡体系中检测不到
 ,可认为存在反应:
,可认为存在反应: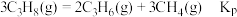 ,下列相关说法正确的是
,下列相关说法正确的是a.

b.
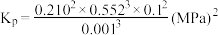
c.使用催化剂,可提高丙烯的平衡产率
d.平衡后再通入少量丙烷,可提高丙烯的体积分数
③由表中数据推算:丙烯选择性
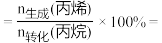
(3)丙烷甲醇共进料时,还发生反应:ⅳ.
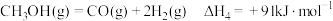 ,在
,在 下,平衡体系中各组分体积分数与进料比的关系如图所示。
下,平衡体系中各组分体积分数与进料比的关系如图所示。
①进料比n(丙烷):n(甲醇)
 时,体系总反应:
时,体系总反应: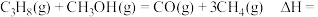
 。
。②随着甲醇投料增加,平衡体系中丙烯的体积分数降低的原因是
您最近一年使用:0次
4 . CH3OH是重要的能源物质,CO2转化为甲醇是一种有效减少CO2排放的方法。
(1) 加氢制甲醇过程中发生的主要反应为反应Ⅰ
加氢制甲醇过程中发生的主要反应为反应Ⅰ  ,
,
该反应一般认为通过反应Ⅱ和反应Ⅲ两步实现。
反应Ⅱ

反应Ⅲ
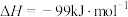
若反应Ⅱ为慢反应,下列示意图中能体现上述反应能量变化的是___________(填标号)。
(2)向恒温2L容器中充入一定量 和
和 ,发生反应
,发生反应
 。图中过程Ⅰ、Ⅱ是在不同催化剂作用下
。图中过程Ⅰ、Ⅱ是在不同催化剂作用下 的转化率
的转化率 随时间(t)的变化曲线。
随时间(t)的变化曲线。
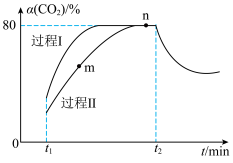
下列说法正确的是___________(填序号)。
(3)在25℃和 的条件下,发生反应
的条件下,发生反应 ,反应建立平衡后,再逐步增大体系的压强。表中列出了不同压强下平衡时物质CO的浓度。
,反应建立平衡后,再逐步增大体系的压强。表中列出了不同压强下平衡时物质CO的浓度。
①压强从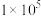 到
到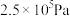 ,平衡
,平衡___________ (填“正向”“逆向”或“不”)移动;
②压强从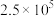 到
到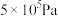 ,浓度从0.20变为
,浓度从0.20变为 的原因是
的原因是___________ 。
(4)在温度 、容积2L的密闭容器中加入1mol
、容积2L的密闭容器中加入1mol 和3mol
和3mol 发生如下反应:
发生如下反应: ,平衡后
,平衡后 的体积分数为50%。若在相同温度,相同体积的容器中加入2.4mol
的体积分数为50%。若在相同温度,相同体积的容器中加入2.4mol 、4.2mol
、4.2mol 、1mol
、1mol 、2mol
、2mol ,平衡后,
,平衡后,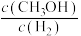
___________  (填“>”“<”“=”或“不能确定”)
(填“>”“<”“=”或“不能确定”)
(5)温度为 时,在容积为2L的密闭容器中加入1mol
时,在容积为2L的密闭容器中加入1mol 和3mol
和3mol 发生下列反应,平衡时
发生下列反应,平衡时 的物质的量为0.5mol。反应开始时与平衡时压强之比为
的物质的量为0.5mol。反应开始时与平衡时压强之比为___________ 。
反应Ⅰ
反应Ⅱ
反应Ⅲ
(1)
 加氢制甲醇过程中发生的主要反应为反应Ⅰ
加氢制甲醇过程中发生的主要反应为反应Ⅰ  ,
,该反应一般认为通过反应Ⅱ和反应Ⅲ两步实现。
反应Ⅱ


反应Ⅲ

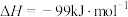
若反应Ⅱ为慢反应,下列示意图中能体现上述反应能量变化的是___________(填标号)。
A.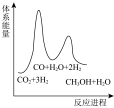 | B.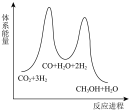 | C. | D. |
(2)向恒温2L容器中充入一定量
 和
和 ,发生反应
,发生反应
 。图中过程Ⅰ、Ⅱ是在不同催化剂作用下
。图中过程Ⅰ、Ⅱ是在不同催化剂作用下 的转化率
的转化率 随时间(t)的变化曲线。
随时间(t)的变化曲线。
下列说法正确的是___________(填序号)。
A.m点: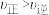 |
B. 时刻改变的反应条件可能是增大水蒸气的浓度 时刻改变的反应条件可能是增大水蒸气的浓度 |
| C.活化能:过程Ⅱ<过程Ⅰ |
D. 时刻改变的反应条件可能是降低温度 时刻改变的反应条件可能是降低温度 |
(3)在25℃和
 的条件下,发生反应
的条件下,发生反应 ,反应建立平衡后,再逐步增大体系的压强。表中列出了不同压强下平衡时物质CO的浓度。
,反应建立平衡后,再逐步增大体系的压强。表中列出了不同压强下平衡时物质CO的浓度。| 压强(Pa) | 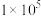 | 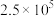 | 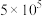 |
浓度( ) ) | 0.08 | 0.20 | 0.44 |
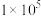 到
到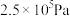 ,平衡
,平衡②压强从
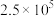 到
到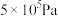 ,浓度从0.20变为
,浓度从0.20变为 的原因是
的原因是(4)在温度
 、容积2L的密闭容器中加入1mol
、容积2L的密闭容器中加入1mol 和3mol
和3mol 发生如下反应:
发生如下反应: ,平衡后
,平衡后 的体积分数为50%。若在相同温度,相同体积的容器中加入2.4mol
的体积分数为50%。若在相同温度,相同体积的容器中加入2.4mol 、4.2mol
、4.2mol 、1mol
、1mol 、2mol
、2mol ,平衡后,
,平衡后,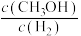
 (填“>”“<”“=”或“不能确定”)
(填“>”“<”“=”或“不能确定”)(5)温度为
 时,在容积为2L的密闭容器中加入1mol
时,在容积为2L的密闭容器中加入1mol 和3mol
和3mol 发生下列反应,平衡时
发生下列反应,平衡时 的物质的量为0.5mol。反应开始时与平衡时压强之比为
的物质的量为0.5mol。反应开始时与平衡时压强之比为反应Ⅰ

反应Ⅱ

反应Ⅲ

您最近一年使用:0次
名校
解题方法
5 . “绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国的新名片。
Ⅰ.已知25℃和101kPa下:
①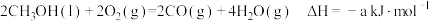
②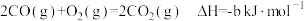
③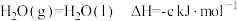
(1)表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为___________ 。
Ⅱ. 和
和 在一定条件下反应可制得合成气,在1L密闭容器中分别通入
在一定条件下反应可制得合成气,在1L密闭容器中分别通入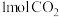 和
和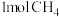 ,发生反应:
,发生反应: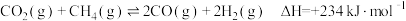 。
。
(2)该反应在___________ (填“高温”或“低温”)条件下能自发进行。
(3)下列能判断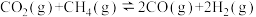 达到平衡状态的是___________(填序号)。
达到平衡状态的是___________(填序号)。
Ⅲ.已知 催化加氢合成乙醇的反应原理为:
催化加氢合成乙醇的反应原理为: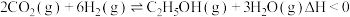 ,设m为起始时的投料比,即
,设m为起始时的投料比,即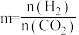 。
。
(4)图1中m1、m2、m3从大到小的顺序为___________ 。
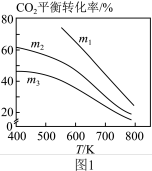
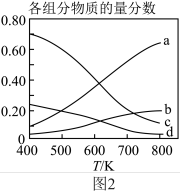
(5)图2表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系,则曲线d代表的物质为___________ (填化学式)。
Ⅳ.工业上可用丙烯加成法制备1,2-二氯丙烷(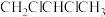 ),主要副产物为3-氯丙烯(
),主要副产物为3-氯丙烯( ),反应原理为:
),反应原理为:
①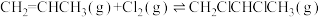
②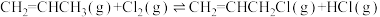
一定温度下,向恒容密闭容器中充入等物质的量的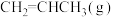 和
和 发生反应,容器内气体的压强随时间的变化如表所示:
发生反应,容器内气体的压强随时间的变化如表所示:
(6)用单位时间内气体分压的变化表示反应①的反应速率,即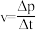 ,则前120min内平均反应速率
,则前120min内平均反应速率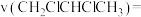
___________ 。
(7)该温度下,若平衡时HCl的体积分数为12.5%,反应①的平衡常数
___________  (
( 为以分压表示的平衡常数,保留小数点后2位)。
为以分压表示的平衡常数,保留小数点后2位)。
Ⅰ.已知25℃和101kPa下:
①
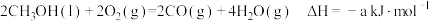
②
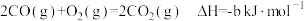
③
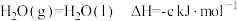
(1)表示
 燃烧热的热化学方程式为
燃烧热的热化学方程式为Ⅱ.
 和
和 在一定条件下反应可制得合成气,在1L密闭容器中分别通入
在一定条件下反应可制得合成气,在1L密闭容器中分别通入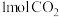 和
和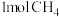 ,发生反应:
,发生反应: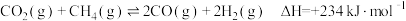 。
。(2)该反应在
(3)下列能判断
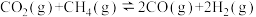 达到平衡状态的是___________(填序号)。
达到平衡状态的是___________(填序号)。| A.一定温度下,容积固定的容器中,密度保持不变 |
| B.容积固定的绝热容器中,温度保持不变 |
| C.一定温度和容积固定的容器中,平均相对分子质量不变 |
D. 和 和 的物质的量之比不再改变 的物质的量之比不再改变 |
Ⅲ.已知
 催化加氢合成乙醇的反应原理为:
催化加氢合成乙醇的反应原理为: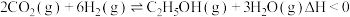 ,设m为起始时的投料比,即
,设m为起始时的投料比,即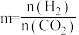 。
。(4)图1中m1、m2、m3从大到小的顺序为

(5)图2表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系,则曲线d代表的物质为

Ⅳ.工业上可用丙烯加成法制备1,2-二氯丙烷(
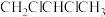 ),主要副产物为3-氯丙烯(
),主要副产物为3-氯丙烯( ),反应原理为:
),反应原理为:①
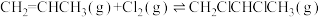
②
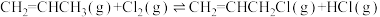
一定温度下,向恒容密闭容器中充入等物质的量的
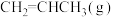 和
和 发生反应,容器内气体的压强随时间的变化如表所示:
发生反应,容器内气体的压强随时间的变化如表所示:| 时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
| 压强/kPa | 80 | 74.2 | 69.2 | 65.2 | 61.6 | 57.6 | 57.6 |
(6)用单位时间内气体分压的变化表示反应①的反应速率,即
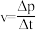 ,则前120min内平均反应速率
,则前120min内平均反应速率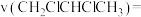
(7)该温度下,若平衡时HCl的体积分数为12.5%,反应①的平衡常数

 (
( 为以分压表示的平衡常数,保留小数点后2位)。
为以分压表示的平衡常数,保留小数点后2位)。
您最近一年使用:0次
解题方法
6 . 合成氨工业和硫酸工业在国民经济中占有重要地位。
(1)在合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前需经过铜氨液处理,目的是除去其中的CO其反应为:[Cu(NH3)2]++CO+NH3 [Cu(NH3)3CO]+ △H<0。吸收CO后的铜氨液经过适当处理可再生,恢复其吸收CO的能力,可循环使用。铜氨液再生适宜的生产条件是
[Cu(NH3)3CO]+ △H<0。吸收CO后的铜氨液经过适当处理可再生,恢复其吸收CO的能力,可循环使用。铜氨液再生适宜的生产条件是_______ 。
(2)将等物质的量的H2和N2通入绝热恒容密闭容器中发生反应N2(g)+3H2(g) 2NH3(g) △H<0,下列选项表明反应一定已达平衡状态的是_______(填标号,下同)。
2NH3(g) △H<0,下列选项表明反应一定已达平衡状态的是_______(填标号,下同)。
接触法制硫酸的关键反应为SO2的催化氧化,二氧化硫在V2O5作用下的催化氧化是工业上生产硫酸的主要反应。SO2的催化氧化热化学方程式为:2SO2(g)+O2(g) 2SO3(g) △H=akJ·mol-1其催化机理分为三步:
2SO3(g) △H=akJ·mol-1其催化机理分为三步:
第1步:SO2(g)+V2O5(s) SO3(g)+V2O4(s) △H=bkJ·mol-1
SO3(g)+V2O4(s) △H=bkJ·mol-1
第2步:V2O4(s)+O2(g)+2SO2(g) 2VOSO4(s) △H=ckJ·mol-1
2VOSO4(s) △H=ckJ·mol-1
第3步:_______。
(3)第3步热化学方程式_______ (△H的值用a、b、c的代数式表示)。
(4)T℃时,将3molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应。3min时反应达到平衡,此时测得O2还剩余0.1mol。则达平衡时SO2的转化率为_______ ;从反应开始至达到平衡,用SO3表示反应速率为_______ 。
(5)为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率(α)下反应速率(数值已略去)与温度的关系如下图所示,下列说法正确的是_______。
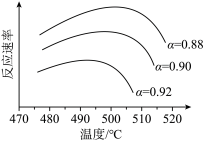
(6)为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如图所示,催化性能最佳的是_______ (填标号)。
(7)设O2的平衡分压为p,SO2的平衡转化率为α,用含p和α的代数式表示上述催化氧化反应的Kp=_______ (用平衡分压代替平衡浓度计算)。
(1)在合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前需经过铜氨液处理,目的是除去其中的CO其反应为:[Cu(NH3)2]++CO+NH3
 [Cu(NH3)3CO]+ △H<0。吸收CO后的铜氨液经过适当处理可再生,恢复其吸收CO的能力,可循环使用。铜氨液再生适宜的生产条件是
[Cu(NH3)3CO]+ △H<0。吸收CO后的铜氨液经过适当处理可再生,恢复其吸收CO的能力,可循环使用。铜氨液再生适宜的生产条件是(2)将等物质的量的H2和N2通入绝热恒容密闭容器中发生反应N2(g)+3H2(g)
 2NH3(g) △H<0,下列选项表明反应一定已达平衡状态的是_______(填标号,下同)。
2NH3(g) △H<0,下列选项表明反应一定已达平衡状态的是_______(填标号,下同)。| A.容器内的压强不再变化 |
| B.相同时间内,断开H-H键的数目和生成N-H键的数目相等 |
| C.容器内气体的浓度c(N2):c(H2):c(NH3)=1:3:2 |
| D.N2的体积分数不再发生变化 |
接触法制硫酸的关键反应为SO2的催化氧化,二氧化硫在V2O5作用下的催化氧化是工业上生产硫酸的主要反应。SO2的催化氧化热化学方程式为:2SO2(g)+O2(g)
 2SO3(g) △H=akJ·mol-1其催化机理分为三步:
2SO3(g) △H=akJ·mol-1其催化机理分为三步:第1步:SO2(g)+V2O5(s)
 SO3(g)+V2O4(s) △H=bkJ·mol-1
SO3(g)+V2O4(s) △H=bkJ·mol-1第2步:V2O4(s)+O2(g)+2SO2(g)
 2VOSO4(s) △H=ckJ·mol-1
2VOSO4(s) △H=ckJ·mol-1第3步:_______。
(3)第3步热化学方程式
(4)T℃时,将3molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应。3min时反应达到平衡,此时测得O2还剩余0.1mol。则达平衡时SO2的转化率为
(5)为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率(α)下反应速率(数值已略去)与温度的关系如下图所示,下列说法正确的是_______。

| A.温度越高,反应速率越大 |
| B.可根据不同α下的最大速率,选择最佳生产温度 |
| C.α=0.88的曲线代表平衡转化率 |
| D.α越大,反应速率最大值对应温度越低 |
(6)为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如图所示,催化性能最佳的是

(7)设O2的平衡分压为p,SO2的平衡转化率为α,用含p和α的代数式表示上述催化氧化反应的Kp=
您最近一年使用:0次
7 . 碳酸二甲脂( )是一种重要的化工原料,被广泛应用于制备锂离子电池和聚碳酸酯等。某科研小组以
)是一种重要的化工原料,被广泛应用于制备锂离子电池和聚碳酸酯等。某科研小组以 、
、 、
、 为原料合成碳酸二甲酯。
为原料合成碳酸二甲酯。
主反应: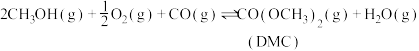

副反应: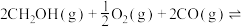
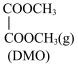

(1)在 作用下,主反应可分两步进行:
作用下,主反应可分两步进行:
ⅰ)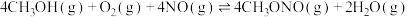
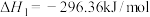
ⅱ)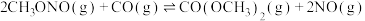
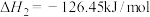
则主反应
_______ 。
(2)研究发理,合成 时易生成则产物草酸二甲脂(
时易生成则产物草酸二甲脂(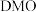 )。某温度下,在2L密闭容器中充入
)。某温度下,在2L密闭容器中充入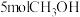 、
、 、
、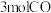 以及
以及 ,达平衡后,
,达平衡后, 和
和 的体积分数相等且为
的体积分数相等且为 体积分数的一半,则主反应的平衡常数
体积分数的一半,则主反应的平衡常数
_______ ;碳酸二甲酯( )的选择性=
)的选择性=_______ ( 的选择性
的选择性 )
)
(3)在200~300℃下,草酸二甲酯(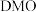 )容易被催化脱膜形成碳酸二甲酯(
)容易被催化脱膜形成碳酸二甲酯( ),某温度下,经过相同时间测得的部分数据如下表所示:
),某温度下,经过相同时间测得的部分数据如下表所示:
①由数据可知,催化效果最好的催化剂及其负载量是_______ 。
②将 、
、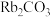 和
和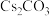 负载于活性炭上对其催化活性具有重要的促进作用,可能的原因是
负载于活性炭上对其催化活性具有重要的促进作用,可能的原因是_______ 。
(4)早在20世纪已有科学家设计通过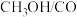 电化学氧化合成碳酸二甲酯(
电化学氧化合成碳酸二甲酯( ),阳极发生的反应分3步进行:
),阳极发生的反应分3步进行:

第一步: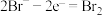
第二步: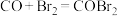
则第三步的方程式为_______ ; 在总反应中的作用是
在总反应中的作用是_______ 。
 )是一种重要的化工原料,被广泛应用于制备锂离子电池和聚碳酸酯等。某科研小组以
)是一种重要的化工原料,被广泛应用于制备锂离子电池和聚碳酸酯等。某科研小组以 、
、 、
、 为原料合成碳酸二甲酯。
为原料合成碳酸二甲酯。主反应:
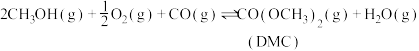

副反应:
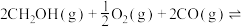
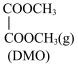

(1)在
 作用下,主反应可分两步进行:
作用下,主反应可分两步进行:ⅰ)
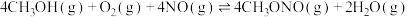
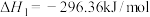
ⅱ)
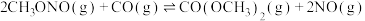
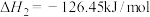
则主反应

(2)研究发理,合成
 时易生成则产物草酸二甲脂(
时易生成则产物草酸二甲脂(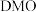 )。某温度下,在2L密闭容器中充入
)。某温度下,在2L密闭容器中充入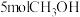 、
、 、
、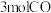 以及
以及 ,达平衡后,
,达平衡后, 和
和 的体积分数相等且为
的体积分数相等且为 体积分数的一半,则主反应的平衡常数
体积分数的一半,则主反应的平衡常数
 )的选择性=
)的选择性= 的选择性
的选择性 )
)(3)在200~300℃下,草酸二甲酯(
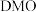 )容易被催化脱膜形成碳酸二甲酯(
)容易被催化脱膜形成碳酸二甲酯( ),某温度下,经过相同时间测得的部分数据如下表所示:
),某温度下,经过相同时间测得的部分数据如下表所示:| 催化剂 |  /活性炭 /活性炭 | 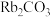 /活性炭 /活性炭 | 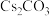 /活性炭 /活性炭 | ||||||
| 负载量 | 5% | 10% | 15% | 5% | 10% | 15% | 5% | 10% | 15% |
| 转化率% | 64 | 70 | 56 | 87 | 84 | 82 | 30 | 95 | 89 |
| 选择性% | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 90 | 85 |
②将
 、
、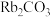 和
和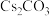 负载于活性炭上对其催化活性具有重要的促进作用,可能的原因是
负载于活性炭上对其催化活性具有重要的促进作用,可能的原因是(4)早在20世纪已有科学家设计通过
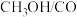 电化学氧化合成碳酸二甲酯(
电化学氧化合成碳酸二甲酯( ),阳极发生的反应分3步进行:
),阳极发生的反应分3步进行:
第一步:
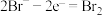
第二步:
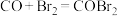
则第三步的方程式为
 在总反应中的作用是
在总反应中的作用是
您最近一年使用:0次
名校
解题方法
8 . 处理、回收CO是环境科学家研究的热点课题。
(1)环境空气质量指数(AQI)日报和实时报告包括了NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
已知:①2NO(g)=N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
③2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
某反应的平衡常数表达式为K= ,写出此反应的热化学方程式:
,写出此反应的热化学方程式:___________ 。
(2)CO用于处理大气污染物N2O所发生的反应为N2O(g)+CO(g) CO2(g)+N2(g) ΔH=-365 kJ·mol-1,几种物质的相对能量如下:
CO2(g)+N2(g) ΔH=-365 kJ·mol-1,几种物质的相对能量如下:
①a=___________ kJ·mol-1,改变下列“量”,一定会引起ΔH发生变化的是___________ (填代号)
A.温度 B.反应物浓度 C.催化剂 D.化学计量数
②有人提出上述反应可以用“Fe+”作催化剂。其总反应分两步进行:
第一步:___________ ;(写化学方程式)
第二步:FeO++CO=Fe++CO2。
(3)在实验室,采用I2O5测定空气中CO的含量。在密闭容器中充入足量的I2O5粉末和一定量的CO,发生反应:I2O5 (s)+5CO(g) 5CO2(g)+I2(s)。测得CO的转化率如图1所示。
5CO2(g)+I2(s)。测得CO的转化率如图1所示。___________ 。
②在此温度下,该可逆反应的平衡常数K=___________ (用含x的代数式表示)。
(4)工业上,利用CO和H2合成CH3OH,在1 L恒容密闭容器中充入1 mol CO(g)和n mol H2,在250 ℃发生反应:CO(g)+2H2(g) CH3OH(g),测得平衡时混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是
CH3OH(g),测得平衡时混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是___________ 。
(1)环境空气质量指数(AQI)日报和实时报告包括了NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
已知:①2NO(g)=N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
③2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
某反应的平衡常数表达式为K=
 ,写出此反应的热化学方程式:
,写出此反应的热化学方程式:(2)CO用于处理大气污染物N2O所发生的反应为N2O(g)+CO(g)
 CO2(g)+N2(g) ΔH=-365 kJ·mol-1,几种物质的相对能量如下:
CO2(g)+N2(g) ΔH=-365 kJ·mol-1,几种物质的相对能量如下:| 物质 | N2O(g) | CO(g) | CO2(g) | N2(g) |
| 相对能量/kJ·mol-1 | 475.5 | 283 | a | 393.5 |
A.温度 B.反应物浓度 C.催化剂 D.化学计量数
②有人提出上述反应可以用“Fe+”作催化剂。其总反应分两步进行:
第一步:
第二步:FeO++CO=Fe++CO2。
(3)在实验室,采用I2O5测定空气中CO的含量。在密闭容器中充入足量的I2O5粉末和一定量的CO,发生反应:I2O5 (s)+5CO(g)
 5CO2(g)+I2(s)。测得CO的转化率如图1所示。
5CO2(g)+I2(s)。测得CO的转化率如图1所示。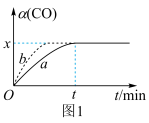
②在此温度下,该可逆反应的平衡常数K=
(4)工业上,利用CO和H2合成CH3OH,在1 L恒容密闭容器中充入1 mol CO(g)和n mol H2,在250 ℃发生反应:CO(g)+2H2(g)
 CH3OH(g),测得平衡时混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是
CH3OH(g),测得平衡时混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是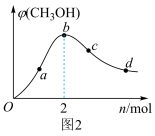
您最近一年使用:0次
2023-10-26更新
|
190次组卷
|
3卷引用:湖北省武汉市第四中学2023-2024学年高二上学期10月月考化学试题
解题方法
9 .  为无色、有臭鸡蛋气味的剧毒气体,能源的开发和利用过程常伴有
为无色、有臭鸡蛋气味的剧毒气体,能源的开发和利用过程常伴有 气体生。
气体生。 脱硫技术是当前的重点研究方向。回答下列问题:
脱硫技术是当前的重点研究方向。回答下列问题:
(1)1883年英国化学家Claus开发了 氧化制硫的方法,即:
氧化制硫的方法,即:
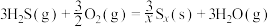
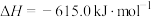
20世纪30年代,德国法本公司将 的氧化分两阶段完成。
的氧化分两阶段完成。
第一阶段反应为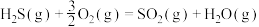
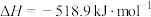
则第二阶段反应

___________  。
。
(2)氧化锌法也是一种传统的脱硫方法,其反应原理如下:
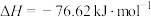
 。据此判断,该反应的△G
。据此判断,该反应的△G___________ 0(填“>”“<”或“=”)。文献资料显示,氧化锌法反应温度控制在300~400℃,工业上这么做的理由为___________ 。
(3)栲胶法是我国本土自主研发和发展起来的湿法氧化脱硫方法,其原理如下(其中,TQ为醌态栲胶;THQ为酚态栲胶):
脱硫过程:



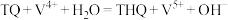
再生过程:
①基态钒原子的价电子排布式为___________ 。
②根据栲胶法原理,脱硫过程中起到催化作用的物质为___________ 。
(4)在密闭容器中, 气体分解生成
气体分解生成 和
和 (g)的平衡转化率与温度、压强的关系如下图所示:
(g)的平衡转化率与温度、压强的关系如下图所示:
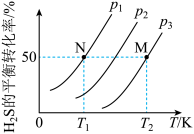
①图中压强 、
、 、
、 由大到小的顺序为
由大到小的顺序为___________ 。
②初始量相同的 分别在
分别在 和
和 、温度
、温度 和
和 下各自达到平衡,则N点和M点的压强平衡常数
下各自达到平衡,则N点和M点的压强平衡常数 之比
之比
___________ 。
 为无色、有臭鸡蛋气味的剧毒气体,能源的开发和利用过程常伴有
为无色、有臭鸡蛋气味的剧毒气体,能源的开发和利用过程常伴有 气体生。
气体生。 脱硫技术是当前的重点研究方向。回答下列问题:
脱硫技术是当前的重点研究方向。回答下列问题:(1)1883年英国化学家Claus开发了
 氧化制硫的方法,即:
氧化制硫的方法,即: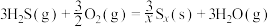
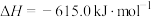
20世纪30年代,德国法本公司将
 的氧化分两阶段完成。
的氧化分两阶段完成。第一阶段反应为
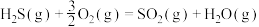
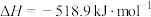
则第二阶段反应


 。
。(2)氧化锌法也是一种传统的脱硫方法,其反应原理如下:

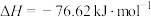
 。据此判断,该反应的△G
。据此判断,该反应的△G(3)栲胶法是我国本土自主研发和发展起来的湿法氧化脱硫方法,其原理如下(其中,TQ为醌态栲胶;THQ为酚态栲胶):
脱硫过程:



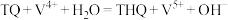
再生过程:

①基态钒原子的价电子排布式为
②根据栲胶法原理,脱硫过程中起到催化作用的物质为
(4)在密闭容器中,
 气体分解生成
气体分解生成 和
和 (g)的平衡转化率与温度、压强的关系如下图所示:
(g)的平衡转化率与温度、压强的关系如下图所示:
①图中压强
 、
、 、
、 由大到小的顺序为
由大到小的顺序为②初始量相同的
 分别在
分别在 和
和 、温度
、温度 和
和 下各自达到平衡,则N点和M点的压强平衡常数
下各自达到平衡,则N点和M点的压强平衡常数 之比
之比
您最近一年使用:0次
2023-10-25更新
|
158次组卷
|
2卷引用:湖北省腾云联盟2023-2024学年高三上学期10月联考化学试题
解题方法
10 .  转化利用对化解全球环境生态危机助力全球“碳达峰、碳中和”目标的实现具有重要意义。化学工作者致力于将
转化利用对化解全球环境生态危机助力全球“碳达峰、碳中和”目标的实现具有重要意义。化学工作者致力于将 转化为各种化工原料。
转化为各种化工原料。
Ⅰ.早在二十世纪初,工业上以 和
和 为原料在一定温度和压强下合成尿素。反应分两步:①
为原料在一定温度和压强下合成尿素。反应分两步:① 和
和 生成
生成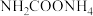 ;②
;②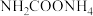 分解生成尿素。
分解生成尿素。
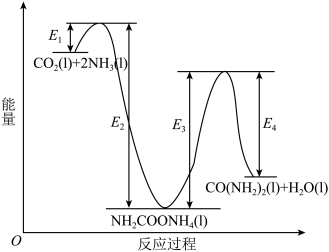
(1)活化能:反应①___________ 反应②(填“>”、“<” 或“二”);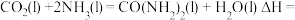
___________ (用含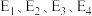 的式子表示)。
的式子表示)。
Ⅱ.我国科学家研究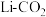 电池,取得了重大科研成果。
电池,取得了重大科研成果。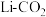 电池中,反应产物为
电池中,反应产物为 ;和单质碳,正极
;和单质碳,正极 电还原后与锂离子结合形成
电还原后与锂离子结合形成 按以下4个步骤进行,
按以下4个步骤进行,
①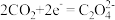 ;
;
②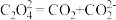 ;
;
③___________;
④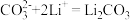
(2)写出步骤③中 与
与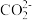 反应的离子方程式
反应的离子方程式___________ 。
Ⅲ.利用 和
和 重整技术可获得合成气(主要成分为
重整技术可获得合成气(主要成分为 ,
, ),重整过程中反应的热化学方程式如下:
),重整过程中反应的热化学方程式如下:
反应i:

反应ii: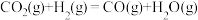
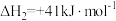
不同配比随温度变化对出口合成气中 的影响如下图所示
的影响如下图所示
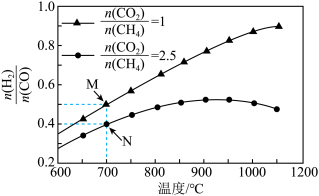
(3)对于反应i,试比较 点和
点和 点
点 的转化率:
的转化率:
___________  (填“>"、“<"或“=”下同);平衡常数
(填“>"、“<"或“=”下同);平衡常数
___________  ,当
,当 一定,有利于提高
一定,有利于提高 平衡转化率的反应条件是
平衡转化率的反应条件是___________ (填序号)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(4)当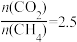 ,温度高于900℃,
,温度高于900℃, 减小的原因可能是
减小的原因可能是___________ 。
(5)在930℃、101kPa时, 按投料比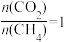 加入刚性密闭容器中,达平衡时,测得
加入刚性密闭容器中,达平衡时,测得 的转化率为90%,
的转化率为90%, 的转化率为95%,试计算反应ii的压强平衡常数
的转化率为95%,试计算反应ii的压强平衡常数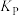 =
=___________ (计算结果保留3位有效数字,用平衡分压代替平衡浓度,分压=总压×物质的量分数)
 转化利用对化解全球环境生态危机助力全球“碳达峰、碳中和”目标的实现具有重要意义。化学工作者致力于将
转化利用对化解全球环境生态危机助力全球“碳达峰、碳中和”目标的实现具有重要意义。化学工作者致力于将 转化为各种化工原料。
转化为各种化工原料。Ⅰ.早在二十世纪初,工业上以
 和
和 为原料在一定温度和压强下合成尿素。反应分两步:①
为原料在一定温度和压强下合成尿素。反应分两步:① 和
和 生成
生成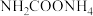 ;②
;②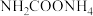 分解生成尿素。
分解生成尿素。
(1)活化能:反应①
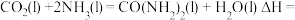
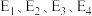 的式子表示)。
的式子表示)。Ⅱ.我国科学家研究
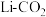 电池,取得了重大科研成果。
电池,取得了重大科研成果。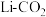 电池中,反应产物为
电池中,反应产物为 ;和单质碳,正极
;和单质碳,正极 电还原后与锂离子结合形成
电还原后与锂离子结合形成 按以下4个步骤进行,
按以下4个步骤进行,①
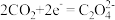 ;
;②
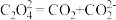 ;
;③___________;
④
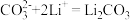
(2)写出步骤③中
 与
与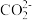 反应的离子方程式
反应的离子方程式Ⅲ.利用
 和
和 重整技术可获得合成气(主要成分为
重整技术可获得合成气(主要成分为 ,
, ),重整过程中反应的热化学方程式如下:
),重整过程中反应的热化学方程式如下:反应i:


反应ii:
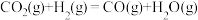
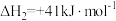
不同配比随温度变化对出口合成气中
 的影响如下图所示
的影响如下图所示
(3)对于反应i,试比较
 点和
点和 点
点 的转化率:
的转化率:
 (填“>"、“<"或“=”下同);平衡常数
(填“>"、“<"或“=”下同);平衡常数
 ,当
,当 一定,有利于提高
一定,有利于提高 平衡转化率的反应条件是
平衡转化率的反应条件是A.高温高压 B.高温低压 C.低温高压 D.低温低压
(4)当
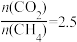 ,温度高于900℃,
,温度高于900℃, 减小的原因可能是
减小的原因可能是(5)在930℃、101kPa时, 按投料比
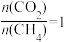 加入刚性密闭容器中,达平衡时,测得
加入刚性密闭容器中,达平衡时,测得 的转化率为90%,
的转化率为90%, 的转化率为95%,试计算反应ii的压强平衡常数
的转化率为95%,试计算反应ii的压强平衡常数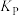 =
=
您最近一年使用:0次



