名校
解题方法
1 . A、B是中学化学常见的化合物,它们各由两种元素组成;乙为元素R组成的单质,它们之间存在如图所示关系.根据要求回答问题:

 如图三个反应中,属于氧化还原反应的有
如图三个反应中,属于氧化还原反应的有______ 个.
 若元素R与氧同主族,下列事实能说明R与氧的非金属性相对强弱的有
若元素R与氧同主族,下列事实能说明R与氧的非金属性相对强弱的有______ .
A.还原性: B.酸性:
B.酸性:
C.稳定性: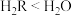 C.沸点:
C.沸点: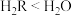
 若化合物B常温下为气体,其水溶液呈碱性
若化合物B常温下为气体,其水溶液呈碱性 答题必须用具体物质表示
答题必须用具体物质表示 .
.
 化合物B的电子式为
化合物B的电子式为______ ;其水溶液呈碱性的原因是______  用离子方程式表示
用离子方程式表示 .
.
 化合物B可与
化合物B可与 组成燃料电池
组成燃料电池 氢氧化钾溶液为电解质溶液
氢氧化钾溶液为电解质溶液 ,其反应产物与反应Ⅲ相同.写出该电池负极的电极反应式
,其反应产物与反应Ⅲ相同.写出该电池负极的电极反应式______ .
 当1mol的化合物B分别参与反应Ⅱ、Ⅲ时,热效应为
当1mol的化合物B分别参与反应Ⅱ、Ⅲ时,热效应为 和
和 ,则反应Ⅰ的热化学方程式为
,则反应Ⅰ的热化学方程式为______  注:反应条件相同、所有物质均为气体
注:反应条件相同、所有物质均为气体 .
.

 如图三个反应中,属于氧化还原反应的有
如图三个反应中,属于氧化还原反应的有 若元素R与氧同主族,下列事实能说明R与氧的非金属性相对强弱的有
若元素R与氧同主族,下列事实能说明R与氧的非金属性相对强弱的有A.还原性:
 B.酸性:
B.酸性:
C.稳定性:
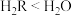 C.沸点:
C.沸点: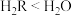
 若化合物B常温下为气体,其水溶液呈碱性
若化合物B常温下为气体,其水溶液呈碱性 答题必须用具体物质表示
答题必须用具体物质表示 .
. 化合物B的电子式为
化合物B的电子式为 用离子方程式表示
用离子方程式表示 .
. 化合物B可与
化合物B可与 组成燃料电池
组成燃料电池 氢氧化钾溶液为电解质溶液
氢氧化钾溶液为电解质溶液 ,其反应产物与反应Ⅲ相同.写出该电池负极的电极反应式
,其反应产物与反应Ⅲ相同.写出该电池负极的电极反应式 当1mol的化合物B分别参与反应Ⅱ、Ⅲ时,热效应为
当1mol的化合物B分别参与反应Ⅱ、Ⅲ时,热效应为 和
和 ,则反应Ⅰ的热化学方程式为
,则反应Ⅰ的热化学方程式为 注:反应条件相同、所有物质均为气体
注:反应条件相同、所有物质均为气体 .
.
您最近一年使用:0次
2020-01-04更新
|
376次组卷
|
5卷引用:2015届福建省龙岩市高三5月教学质量检查理综化学试卷
2 . 氨氮(NH3、NH4+等)是一种重要污染物,可利用合适的氧化剂氧化去除。
(1)氯气与水反应产生的HClO可去除废水中含有的NH3。
已知:NH3(aq)+HClO(aq)=NH2Cl(aq)+H2O(l) ΔH=a kJ·mol-1
2NH2Cl(aq)+HClO(aq)=N2(g)+H2O(l)+3H+(aq)+3Cl-(aq) ΔH=b kJ·mol-1
则反应2NH3(aq)+3HClO(aq)=N2(g)+3H2O(l)+3H+(aq)+3Cl-(aq)的ΔH=________ kJ·mol-1。
(2)在酸性废水中加入NaCl进行电解,阳极产生的HClO可氧化氨氮。电解过程中,废水中初始Cl-浓度对氨氮去除速率及能耗(处理一定量氨氮消耗的电能)的影响如图所示。
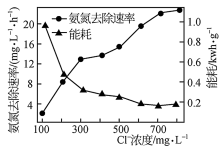
①写出电解时阳极的电极反应式:________________ 。
②当Cl-浓度减小时,氨氮去除速率下降,能耗却增加的原因是____________________________ 。
③保持加入NaCl的量不变,当废水的pH低于4时,氨氮去除速率也会降低的原因是____________________________ 。
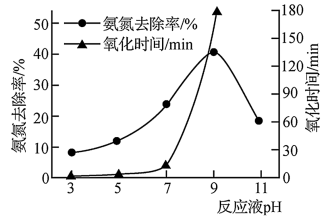
(3)高铁酸钾(K2FeO4)是一种高效氧化剂,可用于氨氮处理。K2FeO4在干燥空气中和强碱性溶液中能稳定存在。氧化剂的氧化性受溶液中的H+浓度影响较大。
①碱性条件下K2FeO4可将水中的NH3转化为N2除去,该反应的离子方程式为________________________________ 。
②用K2FeO4氧化含氨氮废水,其他条件相同时,废水pH对氧化氨氮去除率及氧化时间的影响如图所示。当pH小于9时,随着pH的增大,氨氮去除率增大、氧化时间明显增长的原因是_________________ 。
(1)氯气与水反应产生的HClO可去除废水中含有的NH3。
已知:NH3(aq)+HClO(aq)=NH2Cl(aq)+H2O(l) ΔH=a kJ·mol-1
2NH2Cl(aq)+HClO(aq)=N2(g)+H2O(l)+3H+(aq)+3Cl-(aq) ΔH=b kJ·mol-1
则反应2NH3(aq)+3HClO(aq)=N2(g)+3H2O(l)+3H+(aq)+3Cl-(aq)的ΔH=
(2)在酸性废水中加入NaCl进行电解,阳极产生的HClO可氧化氨氮。电解过程中,废水中初始Cl-浓度对氨氮去除速率及能耗(处理一定量氨氮消耗的电能)的影响如图所示。

①写出电解时阳极的电极反应式:
②当Cl-浓度减小时,氨氮去除速率下降,能耗却增加的原因是
③保持加入NaCl的量不变,当废水的pH低于4时,氨氮去除速率也会降低的原因是
(3)高铁酸钾(K2FeO4)是一种高效氧化剂,可用于氨氮处理。K2FeO4在干燥空气中和强碱性溶液中能稳定存在。氧化剂的氧化性受溶液中的H+浓度影响较大。
①碱性条件下K2FeO4可将水中的NH3转化为N2除去,该反应的离子方程式为
②用K2FeO4氧化含氨氮废水,其他条件相同时,废水pH对氧化氨氮去除率及氧化时间的影响如图所示。当pH小于9时,随着pH的增大,氨氮去除率增大、氧化时间明显增长的原因是

您最近一年使用:0次
2020-04-14更新
|
462次组卷
|
2卷引用:江苏省苏锡常镇四市2020届高三教学情况调查(一) 化学试题
3 . 金是一种用途广泛的贵重金属。某化工厂利用氰化法从一种含金矿石中提取金的工艺流程如下:
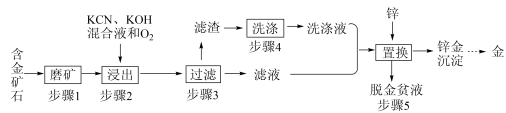
资料:
① Zn + O2 + H2O = Zn(OH)2
O2 + H2O = Zn(OH)2
② Zn2+(aq) Zn(CN)2(s)
Zn(CN)2(s)  Zn(CN)42-(aq)
Zn(CN)42-(aq)
(1)步骤2中发生的反应有:
① 2Au(s) + 4CN-(aq) + 2H2O(l) + O2(g) = 2Au(CN)2-(aq) + 2OH-(aq) + H2O2(aq) ∆H = -197.61 kJ·mol-1
② 2Au(s) + 4CN-(aq)+ H2O2(aq) = 2Au(CN)2-(aq) + 2OH-(aq) ∆H = -386.93 kJ·mol-1
则2Au(s)+ 4CN-(aq)+ H2O(l) + 1/2O2(g) = 2Au(CN)2-(aq) + 2OH-(aq)的∆H =_______ 。
(2)下图是步骤2中金的溶解速率与温度的关系。80℃以后溶解速率降低的原因是___________ 。

(3)步骤4的目的是_________________ 。
(4)步骤5置换的总反应是:
2Au(CN)2- + 3Zn + 4CN- + 2H2O = 2Au + 2Zn(CN)42- + ZnO22- + 2H2↑
则以下说法正确的是________ (填字母序号)。
A 步骤5进行时要先脱氧,否则会增加锌的用量
B 若溶液中c(CN-)过小,会生成Zn(CN)2,减缓置换速率
C 实际生产中加入适量Pb(NO3)2的目的是形成原电池加快置换速率
(5)脱金贫液(主要含有CN-)会破坏环境,影响人类健康,可通过化学方法转化为无毒废水净化排放。碱性条件下,用Cl2将贫液中的CN-氧化成无毒的CO2和N2,该反应的离子方程式为_______________ 。

资料:
① Zn +
 O2 + H2O = Zn(OH)2
O2 + H2O = Zn(OH)2② Zn2+(aq)
 Zn(CN)2(s)
Zn(CN)2(s)  Zn(CN)42-(aq)
Zn(CN)42-(aq)(1)步骤2中发生的反应有:
① 2Au(s) + 4CN-(aq) + 2H2O(l) + O2(g) = 2Au(CN)2-(aq) + 2OH-(aq) + H2O2(aq) ∆H = -197.61 kJ·mol-1
② 2Au(s) + 4CN-(aq)+ H2O2(aq) = 2Au(CN)2-(aq) + 2OH-(aq) ∆H = -386.93 kJ·mol-1
则2Au(s)+ 4CN-(aq)+ H2O(l) + 1/2O2(g) = 2Au(CN)2-(aq) + 2OH-(aq)的∆H =
(2)下图是步骤2中金的溶解速率与温度的关系。80℃以后溶解速率降低的原因是

(3)步骤4的目的是
(4)步骤5置换的总反应是:
2Au(CN)2- + 3Zn + 4CN- + 2H2O = 2Au + 2Zn(CN)42- + ZnO22- + 2H2↑
则以下说法正确的是
A 步骤5进行时要先脱氧,否则会增加锌的用量
B 若溶液中c(CN-)过小,会生成Zn(CN)2,减缓置换速率
C 实际生产中加入适量Pb(NO3)2的目的是形成原电池加快置换速率
(5)脱金贫液(主要含有CN-)会破坏环境,影响人类健康,可通过化学方法转化为无毒废水净化排放。碱性条件下,用Cl2将贫液中的CN-氧化成无毒的CO2和N2,该反应的离子方程式为
您最近一年使用:0次
解题方法
4 . 二氧化氯( )具有强氧化性,
)具有强氧化性, 协同氨法同时脱硫脱硝具有高脱除率。
协同氨法同时脱硫脱硝具有高脱除率。
(1) 单独参与脱硝过程中发生以下反应:
单独参与脱硝过程中发生以下反应:



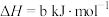


则反应 的
的
________ 
(2) 的浓度、吸收液
的浓度、吸收液 对脱硫脱硝效率的影响分别如图所示,
对脱硫脱硝效率的影响分别如图所示,
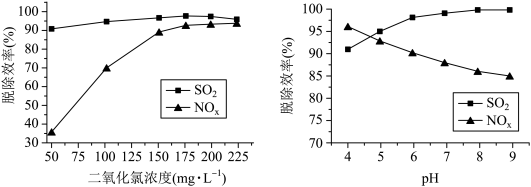
①最适宜的 浓度为
浓度为________  ;
;
② 时,随着
时,随着 的增大,
的增大, 的脱除率下降,其可能的原因是
的脱除率下降,其可能的原因是__________
③ 时,
时, 会发生歧化反应:
会发生歧化反应: ,当有
,当有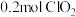 完全反应时,转移电子数目为
完全反应时,转移电子数目为________  ;歧化反应生成的
;歧化反应生成的 也可以作为氧化剂进行脱硝反应,写出碱性条件下
也可以作为氧化剂进行脱硝反应,写出碱性条件下 将
将 氧化为
氧化为 的离子方程式
的离子方程式______________ 。
(3)工业上以不锈钢材料为阴极,表面覆盖金属氧化物的石墨为阳极,电解 溶液制备
溶液制备 。写出阳极产生
。写出阳极产生 的电极反应式
的电极反应式________ ;此方法的缺点是所得产品纯度不高, 气体中所含的杂质可能有
气体中所含的杂质可能有_____________ 。
 )具有强氧化性,
)具有强氧化性, 协同氨法同时脱硫脱硝具有高脱除率。
协同氨法同时脱硫脱硝具有高脱除率。(1)
 单独参与脱硝过程中发生以下反应:
单独参与脱硝过程中发生以下反应:


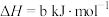


则反应
 的
的

(2)
 的浓度、吸收液
的浓度、吸收液 对脱硫脱硝效率的影响分别如图所示,
对脱硫脱硝效率的影响分别如图所示,
①最适宜的
 浓度为
浓度为 ;
;②
 时,随着
时,随着 的增大,
的增大, 的脱除率下降,其可能的原因是
的脱除率下降,其可能的原因是③
 时,
时, 会发生歧化反应:
会发生歧化反应: ,当有
,当有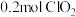 完全反应时,转移电子数目为
完全反应时,转移电子数目为 ;歧化反应生成的
;歧化反应生成的 也可以作为氧化剂进行脱硝反应,写出碱性条件下
也可以作为氧化剂进行脱硝反应,写出碱性条件下 将
将 氧化为
氧化为 的离子方程式
的离子方程式(3)工业上以不锈钢材料为阴极,表面覆盖金属氧化物的石墨为阳极,电解
 溶液制备
溶液制备 。写出阳极产生
。写出阳极产生 的电极反应式
的电极反应式 气体中所含的杂质可能有
气体中所含的杂质可能有
您最近一年使用:0次
名校
解题方法
5 . 绿水青山是习总书记构建美丽中国的伟大设想,研究碳、氮、硫等大气污染物和水污染物的处理对建设美丽中国有重要意义。
(1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)=2NO2(g) ΔH1=-112.4 kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) ΔH2=-234 kJ·mol-1
③N2(g)+O2(g)=2NO(g) ΔH3=+179.2 kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式_______________________ 。
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g) N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
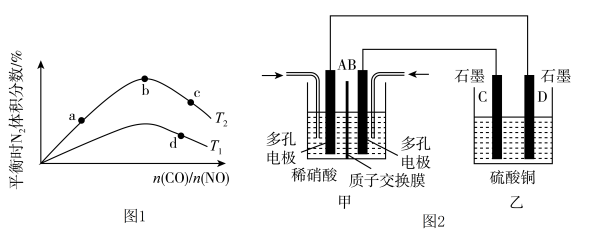
①b点时,平衡体系中C、N原子个数之比接近________________ ;
②a、b、c三点CO的转化率从大到小的顺序为_____________________ ;
③a、c、d三点的平衡常数从大到小的顺序为_________________ 。
④若n(CO)/n(NO)=0.8,反应达平衡时,N2的体积分数为25%,则CO的转化率为________ 。
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极的电极反应式为___________________ 。
(4)已知:25 ℃时,H2C2O4的电离常数Ka1=5.9×10-2,Ka2=6.4×10-5,25 ℃时,0.1 mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为________________________ ,若向该溶液中加入一定量NaOH固体,使c(HC2O4- )=c(C2O42- ),则此时溶液呈________ (填“酸性”“碱性”或“中性”)。
(1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)=2NO2(g) ΔH1=-112.4 kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) ΔH2=-234 kJ·mol-1
③N2(g)+O2(g)=2NO(g) ΔH3=+179.2 kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)
 N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
①b点时,平衡体系中C、N原子个数之比接近
②a、b、c三点CO的转化率从大到小的顺序为
③a、c、d三点的平衡常数从大到小的顺序为
④若n(CO)/n(NO)=0.8,反应达平衡时,N2的体积分数为25%,则CO的转化率为
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极的电极反应式为
(4)已知:25 ℃时,H2C2O4的电离常数Ka1=5.9×10-2,Ka2=6.4×10-5,25 ℃时,0.1 mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为
您最近一年使用:0次
名校
解题方法
6 . (1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)=2NO2(g) △H1=-112.3kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) △H2=-234kJ·mol-1
③N2(g)+O2(g)=2NO(g) △H3=+179.5kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式___ 。
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g) N2(g)+2CO2(g) △H=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
N2(g)+2CO2(g) △H=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。

①b点时,平衡体系中C、N原子个数之比接近___ ;
②a、b、c三点CO的转化率从大到小的顺序为___ ;a、c、d三点的平衡常数从大到小的顺序为___ 。
③若n(CO)/n(NO)=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为__ 。
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极处通入的气体为____ (填化学式);A电极的电极反应式为____ ;一段时间后,若乙中需加0.2molCu(OH)2使溶液复原,则转移的电子数为___ 。
(4)已知:25℃时,H2C2O4的电离常数Ka1=5.9×10—2,Ka2=6.4×10-5,则25℃时,0.1mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为____ ,若向该溶液中加入一定量NaOH固体,使c(HC2O4-)=c(C2O42-),则此时溶液呈___ (填“酸性”“碱性”或“中性”)。
已知:①2NO(g)+O2(g)=2NO2(g) △H1=-112.3kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) △H2=-234kJ·mol-1
③N2(g)+O2(g)=2NO(g) △H3=+179.5kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)
 N2(g)+2CO2(g) △H=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
N2(g)+2CO2(g) △H=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
①b点时,平衡体系中C、N原子个数之比接近
②a、b、c三点CO的转化率从大到小的顺序为
③若n(CO)/n(NO)=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极处通入的气体为
(4)已知:25℃时,H2C2O4的电离常数Ka1=5.9×10—2,Ka2=6.4×10-5,则25℃时,0.1mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为
您最近一年使用:0次
2019-10-31更新
|
229次组卷
|
2卷引用:山东省实验中学2020届高三第一次诊断性考试化学试题
解题方法
7 . 脱除工业废气中的氮氧化物(主要是指NO和NO2)可以净化空气、改善环境,是环境保护的主要课题。
(1)早期是利用NH3还原法,可将NOx还原为N2进行脱除。
已知:①4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905.9 kJ/mol
4NO(g)+6H2O(g) △H=-905.9 kJ/mol
②N2(g)+O2(g) 2NO(g) △H=+180 kJ/mol
2NO(g) △H=+180 kJ/mol
③H2O(g) H2O(l) △H=-44 kJ/mol
H2O(l) △H=-44 kJ/mol
写出常温下,NH3还原NO反应的热化学方程式:____________ 。
(2)以漂粉精溶液为吸收剂可以有效脱除烟气中的NO。
①漂粉精溶液的主要成分是Ca(ClO)2,若吸收过程中,消耗的Ca(ClO)2与吸收的NO的物质的量之比为3:4,则脱除后NO转化为____________ 。
②某一兴趣小组研究不同温度下相同浓度漂粉精溶液对NO脱除率的影响,结果如图所示:

图中,40~60℃ NO脱除率上升可能的原因为____________ ;60~80℃ NO脱除率下降可能的原因为____________ 。
(3)过硫酸钠(Na2S2O8)氧化去除NO
第一步:NO在碱性环境中被Na2S2O8氧化为NaNO2
第二步: NaNO2继续被氧化为NaNO3,反应为NO2-+S2O82-+2OH- NO3-+2SO42-+H2O。不同温度下,平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度(指第二步反应的初始浓度)的关系如图所示:
NO3-+2SO42-+H2O。不同温度下,平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度(指第二步反应的初始浓度)的关系如图所示:

①a、b、c、d四点平衡常数K由大到小的顺序为____________ ,原因是____________ 。
②若a点(0.1,40%)时,NO2-的初始浓度为a mol·L-1,平衡时pH=13,则65℃时,第二步反应的平衡常数K=____________ 。(用含a的代数式表示)
(4)利用新型材料光催化脱除NO法如图所示:

某电化小组将过程A、B设计成酸性电解池反应,则该反应中阴极反应为_______ 。
(1)早期是利用NH3还原法,可将NOx还原为N2进行脱除。
已知:①4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) △H=-905.9 kJ/mol
4NO(g)+6H2O(g) △H=-905.9 kJ/mol ②N2(g)+O2(g)
 2NO(g) △H=+180 kJ/mol
2NO(g) △H=+180 kJ/mol ③H2O(g)
 H2O(l) △H=-44 kJ/mol
H2O(l) △H=-44 kJ/mol写出常温下,NH3还原NO反应的热化学方程式:
(2)以漂粉精溶液为吸收剂可以有效脱除烟气中的NO。
①漂粉精溶液的主要成分是Ca(ClO)2,若吸收过程中,消耗的Ca(ClO)2与吸收的NO的物质的量之比为3:4,则脱除后NO转化为
②某一兴趣小组研究不同温度下相同浓度漂粉精溶液对NO脱除率的影响,结果如图所示:

图中,40~60℃ NO脱除率上升可能的原因为
(3)过硫酸钠(Na2S2O8)氧化去除NO
第一步:NO在碱性环境中被Na2S2O8氧化为NaNO2
第二步: NaNO2继续被氧化为NaNO3,反应为NO2-+S2O82-+2OH-
 NO3-+2SO42-+H2O。不同温度下,平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度(指第二步反应的初始浓度)的关系如图所示:
NO3-+2SO42-+H2O。不同温度下,平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度(指第二步反应的初始浓度)的关系如图所示:
①a、b、c、d四点平衡常数K由大到小的顺序为
②若a点(0.1,40%)时,NO2-的初始浓度为a mol·L-1,平衡时pH=13,则65℃时,第二步反应的平衡常数K=
(4)利用新型材料光催化脱除NO法如图所示:

某电化小组将过程A、B设计成酸性电解池反应,则该反应中阴极反应为
您最近一年使用:0次
解题方法
8 . X、Y、Z、W、G是元素周期表中原子序数依次增大的五种元素。X元素是元素周期表中核电荷数最小的元素。Y的一种核素常用于考古,其一种同素异形体为自然界最硬的物质。ZX3气体溶于水呈碱性。W的外围电子排布是3s1。G2+离子的M层d轨道只有5个电子。请回答下列问题:
(1)W在元素周期表中的位置是______ ;W和Z形成的化合物水溶液呈碱性,用离子方程式表示其原因_____ 。
(2)Z原子的第一电离能比氧原子的____ (填“大”或“小”);G的基态原子电子排布式是__________
(3)X与Y可形成多种化合物,其中一种化合物的分子式是X6Y6,分子中只有σ键,该分子的结构简式是_________ ;该化合物中Y的杂化轨道类型是________ 。
(4)G的最高价氧化物对应水化物的钾盐,在酸性条件下,常用于测定溶液中Fe2+的含量,该反应的离子方程式是____________
(5)可用YX4还原ZOx以消除其污染。已知:
YX4(g) +4ZO2(g)=4ZO(g)+YO2(g)+2X2O(g) △H=-574 kJ·mol-1
YX4(g)+4ZO(g)=2Z2(g)十YO2(g) +2X2O(g) △H = -1160kJ·mol-1
试写出用YX4还原ZO2至Z2的热化学方程式________ 。
(1)W在元素周期表中的位置是
(2)Z原子的第一电离能比氧原子的
(3)X与Y可形成多种化合物,其中一种化合物的分子式是X6Y6,分子中只有σ键,该分子的结构简式是
(4)G的最高价氧化物对应水化物的钾盐,在酸性条件下,常用于测定溶液中Fe2+的含量,该反应的离子方程式是
(5)可用YX4还原ZOx以消除其污染。已知:
YX4(g) +4ZO2(g)=4ZO(g)+YO2(g)+2X2O(g) △H=-574 kJ·mol-1
YX4(g)+4ZO(g)=2Z2(g)十YO2(g) +2X2O(g) △H = -1160kJ·mol-1
试写出用YX4还原ZO2至Z2的热化学方程式
您最近一年使用:0次
名校
解题方法
9 . (1)在一定条件下氨气和氧气能发生反应生成氮气和水蒸气:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H
查阅资料可得有关的化学键键能数据如下:
由此计算上述反应的反应热△H=___________ kJ·mol-1。
(2)已知:N2(g)+O2(g)=2NO(g) K1
N2(g)+3H2(g)=2NH3(g) K2
2H2(g)+O2(g)=2H2O(g) K3
注:K1、K2、K3分别为上述三个反应的平衡常数
回答下列问题:
①氨催化氧化反应(生成气态水)的平衡常数K为___________ (用K1、K2、K3表示)。
②一定条件下,将4molNH3和5.2molO2混合于容积为4L的恒容密闭容器中发生催化氧化反应,经过10s后达到平衡,测得NO的浓度为0.4mol/L则0到10s内,用NH3表示该反应的平均反应速率为___________ ,O2的转化率为___________ (用百分数表示,且保留小数点后一位),该反应的平衡常数为___________ (列出计算式即可)。
③若上述反应第一次达到平衡时,保持其他条件不变的情况下,只是将容器的体积扩大一倍,假定在25s后达到新的平衡。请在下图中用曲线表示15~30s这个阶段体系中NH3的浓度随时间变化的趋势。__________
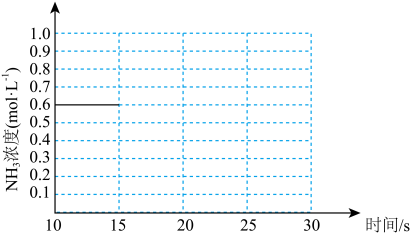
(3)下列有关该反应的说法正确的是___________ (填字母)。
A.恒温恒容,再充入4molNH3和5.2molO2,再次达到平衡时,NH3的转化率增大
B.恒温恒容,当容器内的密度保持不变时,反应达到了平衡
C.当混合气体的平均摩尔质量不变时,反应达到了平衡
D.当2v正(NO)=3v逆(H2O)时,反应达到了平衡
(4)工业上常用氨水吸收SO2,可生成(NH4)2SO3,请判断常温下(NH4)2SO3溶液的酸碱性并通过计算说明判断依据:_______________________________________________________ 。(已知:NH3·H2O的Kb=1.8×10-5;H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8)
查阅资料可得有关的化学键键能数据如下:
| 化学键 | N≡N | H-O | N-H | O=O |
| E/ (kJ·mol-1) | 946 | 463 | 391 | 496 |
由此计算上述反应的反应热△H=
(2)已知:N2(g)+O2(g)=2NO(g) K1
N2(g)+3H2(g)=2NH3(g) K2
2H2(g)+O2(g)=2H2O(g) K3
注:K1、K2、K3分别为上述三个反应的平衡常数
回答下列问题:
①氨催化氧化反应(生成气态水)的平衡常数K为
②一定条件下,将4molNH3和5.2molO2混合于容积为4L的恒容密闭容器中发生催化氧化反应,经过10s后达到平衡,测得NO的浓度为0.4mol/L则0到10s内,用NH3表示该反应的平均反应速率为
③若上述反应第一次达到平衡时,保持其他条件不变的情况下,只是将容器的体积扩大一倍,假定在25s后达到新的平衡。请在下图中用曲线表示15~30s这个阶段体系中NH3的浓度随时间变化的趋势。

(3)下列有关该反应的说法正确的是
A.恒温恒容,再充入4molNH3和5.2molO2,再次达到平衡时,NH3的转化率增大
B.恒温恒容,当容器内的密度保持不变时,反应达到了平衡
C.当混合气体的平均摩尔质量不变时,反应达到了平衡
D.当2v正(NO)=3v逆(H2O)时,反应达到了平衡
(4)工业上常用氨水吸收SO2,可生成(NH4)2SO3,请判断常温下(NH4)2SO3溶液的酸碱性并通过计算说明判断依据:
您最近一年使用:0次
2019-02-07更新
|
473次组卷
|
3卷引用:【市级联考】山西省晋中市2019届高三上学期1月高考适应性考试理科综合化学试题
名校
解题方法
10 . (1)①Na2CO3俗称纯碱,其水溶液呈碱性,原因是________________________ (用离子方程式解释);
②常温下,0.050 0 mol/L硫酸溶液的pH=__________ ;
③用0.010 0 mol/L氢氧化钠溶液滴定未知浓度的盐酸,酚酞作指示剂,滴定终点时,溶液的颜色由无色变为__________ (填“蓝色”或“浅红色”),且半分钟内保持不变。
(2)①已知H2与O2反应生成1 mol H2O(g)时放出241.8 kJ的热量,请完成该反应的热化学方程式:2H2(g)+O2(g)===2H2O(g) ΔH=__________ kJ/mol;
②已知:C(石墨,s)===C(金刚石,s) ΔH>0,则稳定性石墨比金刚石________ (填“强”或“弱”)。
(3)在某恒容密闭容器中进行可逆反应FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH>0,平衡常数表达式为K= 。
。
①反应达到平衡后,向容器中通入CO,化学平衡向__________ (填“正反应”或“逆反应”)方向移动;
②若降低温度,平衡常数K__________ (填“增大”“减小”或“不变”);
③查阅资料得知1 100 ℃时K=0.263。某时刻测得容器中c(CO2)=0.025 mol/L,c(CO)=0.10 mol/L,此时刻反应__________ (填“达到”或“未达到”)平衡状态。
(4)电化学是研究化学能与电能相互转化的装置、过程和效率的科学。
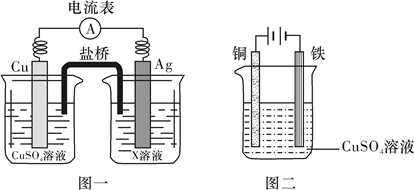
①根据氧化还原反应2Ag+(aq)+Cu(s)===2Ag(s)+Cu2+(aq),设计的原电池如图一所示,X溶液是__________ (填“CuSO4”或“AgNO3”)溶液;
②图二装置在铁件上镀铜,铁作阴极,则阴极上的电极反应式是__________________________ 。
②常温下,0.050 0 mol/L硫酸溶液的pH=
③用0.010 0 mol/L氢氧化钠溶液滴定未知浓度的盐酸,酚酞作指示剂,滴定终点时,溶液的颜色由无色变为
(2)①已知H2与O2反应生成1 mol H2O(g)时放出241.8 kJ的热量,请完成该反应的热化学方程式:2H2(g)+O2(g)===2H2O(g) ΔH=
②已知:C(石墨,s)===C(金刚石,s) ΔH>0,则稳定性石墨比金刚石
(3)在某恒容密闭容器中进行可逆反应FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH>0,平衡常数表达式为K=
 。
。①反应达到平衡后,向容器中通入CO,化学平衡向
②若降低温度,平衡常数K
③查阅资料得知1 100 ℃时K=0.263。某时刻测得容器中c(CO2)=0.025 mol/L,c(CO)=0.10 mol/L,此时刻反应
(4)电化学是研究化学能与电能相互转化的装置、过程和效率的科学。

①根据氧化还原反应2Ag+(aq)+Cu(s)===2Ag(s)+Cu2+(aq),设计的原电池如图一所示,X溶液是
②图二装置在铁件上镀铜,铁作阴极,则阴极上的电极反应式是
您最近一年使用:0次



