1 . Ⅰ.钢铁容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一、可采用电化学防护技术减缓海水中钢铁设施的腐蚀,下图是钢铁桥墩部分防护原理示意图。
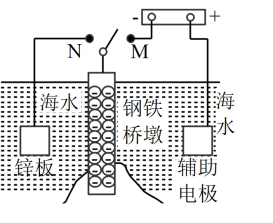
(1)K 与 M 连接时钢铁桥墩的电化学防护方法为___________ 。
(2)K与N连接时,钢铁桥墩为___________ 极(填"正"、"负"、"阴"或"阳"),电极反应式为___________ 。
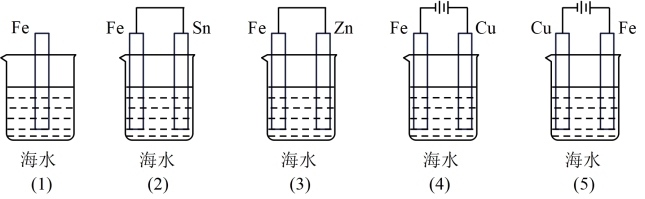
(3)下列各情况中,Fe片腐蚀由快到慢的顺序是___________ 。
(4)已知:2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s) ΔH = +234.1 kJ/mol
C(s)+O2(g)=CO2(g) ΔH = -393.5 kJ/mol。
根据以上信息,则Fe(s)与O2(g)反应生成Fe2O3(s)的热化学方程式是__________ 。
Ⅱ.经研究发现青铜器的腐蚀竟然都跟原电池有关。如图为青铜器在潮湿环境中发生电化学腐蚀的示意图。
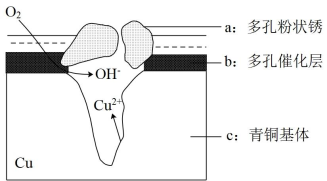
(1)腐蚀过程中,负极是___________ (填图中字母"a"或"b"或"c");
(2)环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为___________ 。
(3)若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为___________ L(标准状况)。

(1)K 与 M 连接时钢铁桥墩的电化学防护方法为
(2)K与N连接时,钢铁桥墩为
(3)下列各情况中,Fe片腐蚀由快到慢的顺序是

(4)已知:2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s) ΔH = +234.1 kJ/mol
C(s)+O2(g)=CO2(g) ΔH = -393.5 kJ/mol。
根据以上信息,则Fe(s)与O2(g)反应生成Fe2O3(s)的热化学方程式是
Ⅱ.经研究发现青铜器的腐蚀竟然都跟原电池有关。如图为青铜器在潮湿环境中发生电化学腐蚀的示意图。

(1)腐蚀过程中,负极是
(2)环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为
(3)若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为
您最近一年使用:0次
2021-06-17更新
|
180次组卷
|
2卷引用:黑龙江省鹤岗市第一中学2020-2021学年高一6月月考化学试题
2 . (1)在恒容的密闭容器中,气体X与气体Y反应可生成气体Z,反应过程中,X、Y、Z三种气体的浓度(c)随时间(t)的变化关系如图_______ ,若t0=10s,用X表示的该反应速率为_______ ;若向容器中充入He,该反应速率_______ (填“加快”或“减慢”或“不变”)
(2)一种新型催化剂用于NO和CO的反应:2NO+2CO⇌2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。
①a=_______ 。
②能验证温度对化学反应速率规律的是实验_______ (填实验序号)。
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线_______ (填“甲”或“乙”)。_______ (任写一条)。
(3)已知:P(s,白磷)=P(s,黑磷),每1molP(s,白磷)发生反应,放出39.3kJ的热量,P(s,白磷)=P(s,红磷),每1molP(s,白磷)发生反应,放出17.6kJ的热量,由此推知,其中最稳定的磷单质是_______ (填“黑磷”或“红磷”)。
(4)丙烷氧气燃料电池在碱性电解质环境中放电时丙烷在_______ (填“正”或“负”)极发生的电极反应式为_______ ,电路中每转移0.4mol电子,标准状况下消耗O2的体积是_______ L。

(2)一种新型催化剂用于NO和CO的反应:2NO+2CO⇌2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。
| 实验编号 | t(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.2×10−3 | 5.80×10−3 | 82 |
| Ⅱ | 280 | 1.2×10−3 | b | 124 |
| Ⅲ | 350 | a | 5.80×10−3 | 82 |
②能验证温度对化学反应速率规律的是实验
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线

(3)已知:P(s,白磷)=P(s,黑磷),每1molP(s,白磷)发生反应,放出39.3kJ的热量,P(s,白磷)=P(s,红磷),每1molP(s,白磷)发生反应,放出17.6kJ的热量,由此推知,其中最稳定的磷单质是
(4)丙烷氧气燃料电池在碱性电解质环境中放电时丙烷在
您最近一年使用:0次
2021-06-15更新
|
377次组卷
|
4卷引用:四川省广安友谊中学高2020-2021学年高一下学期6月月考化学试题
四川省广安友谊中学高2020-2021学年高一下学期6月月考化学试题天津市第四十三中学2020-2021学年高一下学期期末考试化学试题(已下线)重难点04 化学反应速率及平衡图表问题的分析 平衡状态的判断-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(天津专用)(已下线)专题03 化学反应的速率与限度-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(天津专用)
解题方法
3 . 断开1molAB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称A-B键的键能E:
请回答下列问题:
(1)如图表示某反应的能量变化关系,则此反应_______ (填“吸热”或“放热”)反应,其中∆H=_______ (用含有a、b的关系式表示)

(2)若图中表示反应2H2(g)+O2(g)=2H2O(g) ∆H=-241.8kJ·mol-1,x=_______ ;若忽略温度和压强对反应热的影响,当反应中有1mol电子转移时,反应的热量变化为_______ 。
(3)处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S。
已知:2CO(g)+O2(g)=2CO2(g) ∆H=-283.0kJ·mol-1
S(s)+O2(g)=SO2(g) ∆H=-296.0kJ·mol-1
写出CO和SO2转化为单质硫的反应热化学方程式是_______ 。
| 化学键 | H—H | Cl—Cl | O=O | C—Cl | C—H | O—H | H—Cl |
| E/KJ·mol-1 | 436 | 247 | x | 330 | 413 | 463 | 431 |
(1)如图表示某反应的能量变化关系,则此反应

(2)若图中表示反应2H2(g)+O2(g)=2H2O(g) ∆H=-241.8kJ·mol-1,x=
(3)处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S。
已知:2CO(g)+O2(g)=2CO2(g) ∆H=-283.0kJ·mol-1
S(s)+O2(g)=SO2(g) ∆H=-296.0kJ·mol-1
写出CO和SO2转化为单质硫的反应热化学方程式是
您最近一年使用:0次
4 . 已知: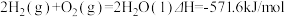 ①
①
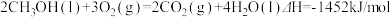 ②
②
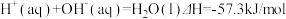
下列说法正确的是
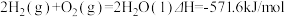 ①
①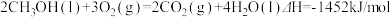 ②
②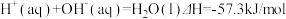
下列说法正确的是
| A.H2(g)的燃烧热为571.6kJ/mol |
| B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 |
C.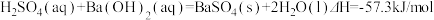 |
D.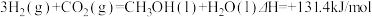 |
您最近一年使用:0次
2021-06-14更新
|
309次组卷
|
3卷引用:四川省南充西南大学实验学校2020-2021学年高一下学期6月月考化学试题
四川省南充西南大学实验学校2020-2021学年高一下学期6月月考化学试题(已下线)第一章 第三节 化学反应热的计算(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)辽宁省大石桥市第三高级中学等三校2022-2023学年高一下学期5月期中联考化学试题
5 . 分别填空(1)已知下列热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1
写出FeO(s)被CO还原成Fe和CO2的热化学方程式___________
(2)书写下列物质的电子式:NH4Cl___________ HClO___________ Ca(OH)2 ___________ Na2O2 ___________
(3)将Mg、Cu组成的2.64g混合物投入适量稀硝酸中恰好完全反应,并收集还原产物NO气体(还原产物只有一种)。然后向反应后的溶液中加入一定量NaOH溶液,金属离子恰好沉淀完全,沉淀质量为4.68g,则反应过程中收集到NO气体(标况下)体积为___________
(4)在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出 650kJ的热量,反应的热化学方程式为___________
(5)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为___________
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1
写出FeO(s)被CO还原成Fe和CO2的热化学方程式
(2)书写下列物质的电子式:NH4Cl
(3)将Mg、Cu组成的2.64g混合物投入适量稀硝酸中恰好完全反应,并收集还原产物NO气体(还原产物只有一种)。然后向反应后的溶液中加入一定量NaOH溶液,金属离子恰好沉淀完全,沉淀质量为4.68g,则反应过程中收集到NO气体(标况下)体积为
(4)在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出 650kJ的热量,反应的热化学方程式为
(5)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为
您最近一年使用:0次
解题方法
6 . 根据能量变化示意图,下列说法不正确的是
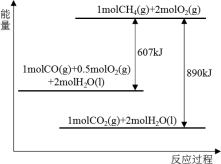

| A.2molCO(g)与1molO2(g)完全反应生成2molCO2(g)时要释放566kJ的能量 |
| B.1molCH4(g)与2molO2(g)具有的总能量高于1molCO2(g)与2molH2O(l) |
| C.1molCH4(g)完全燃烧生成气态水时释放的能量小于890kJ |
| D.16kg液化天然气完全燃烧释放的能量为890000kJ |
您最近一年使用:0次
解题方法
7 . 计算
(1)焦炭与CO、CO2、H2均是重要的化工原料。由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.58 kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.19 kJ·mol-1
反应Ⅲ:CO(g)+2H2(g)=CH3OH(g) ΔH3
则反应Ⅲ的ΔH3=___________ 。
(2)低能耗高效率的合成氨技术开发是实现氨燃料化利用的基础。探索新型合成氨技术是研究热点之一。回答下列问题:
哈伯合成氨在较高温度下以氢气做氢源,氢气可由天然气制备。CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
下表列出了几种化学键的键能:【CO的结构 】
】
298 K时,上述反应的ΔH=___________ 。
(1)焦炭与CO、CO2、H2均是重要的化工原料。由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.58 kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.19 kJ·mol-1
反应Ⅲ:CO(g)+2H2(g)=CH3OH(g) ΔH3
则反应Ⅲ的ΔH3=
(2)低能耗高效率的合成氨技术开发是实现氨燃料化利用的基础。探索新型合成氨技术是研究热点之一。回答下列问题:
哈伯合成氨在较高温度下以氢气做氢源,氢气可由天然气制备。CH4(g)+H2O(g)
 CO(g)+3H2(g)
CO(g)+3H2(g)下表列出了几种化学键的键能:【CO的结构
 】
】| 化学键 | H-H | C-H | H-O |  |
| 键能kJ/mol | 436 | 413 | 467 | 1072 |
您最近一年使用:0次
8 . 氨气是一种重要的化学物质,可用于制取化肥和硝酸等。
(1)工业合成氨的热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=-92 kJ/mol
2NH3(g) △H=-92 kJ/mol
表中a为___________ 。
(2)合成氨原料中的H2可用CO在高温下与水蒸气反应制得。已知在25℃、101 kPa 下:
I. 2C(石墨,s)+O2(g)=2CO(g) △H1=- 222 kJ/mol
II.2H2(g)+O2(g)=2H2O(g) △H2=- 242 kJ/mol
III. C(石墨,s)+ O2(g)=CO2(g) △H3=- 394kJ/mol
①25℃、101 kPa 下CO与水蒸气反应转化为H2的热化学方程式为___________ 。
②根据反应I、II、III,下列说法正确的是___________ (填选项字母)。
a.由反应II可以推知:2H2(g)+O2(g)=2H2O(l) △H4,则△H4小于△H2
b.反应III的反应热等于O2分子中化学键断裂时所吸收的总能量与CO2分子中化学键形成时所释放的总能量的差
c.下图可表示反应I的反应过程和能量的关系
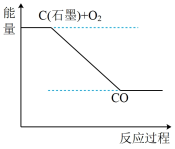 。
。
(1)工业合成氨的热化学方程式为:N2(g)+3H2(g)
 2NH3(g) △H=-92 kJ/mol
2NH3(g) △H=-92 kJ/mol| N-H | H-H | N≡N | |
| 断开1 mol化学键需要吸收的能量/kJ | a | 436 | 946 |
(2)合成氨原料中的H2可用CO在高温下与水蒸气反应制得。已知在25℃、101 kPa 下:
I. 2C(石墨,s)+O2(g)=2CO(g) △H1=- 222 kJ/mol
II.2H2(g)+O2(g)=2H2O(g) △H2=- 242 kJ/mol
III. C(石墨,s)+ O2(g)=CO2(g) △H3=- 394kJ/mol
①25℃、101 kPa 下CO与水蒸气反应转化为H2的热化学方程式为
②根据反应I、II、III,下列说法正确的是
a.由反应II可以推知:2H2(g)+O2(g)=2H2O(l) △H4,则△H4小于△H2
b.反应III的反应热等于O2分子中化学键断裂时所吸收的总能量与CO2分子中化学键形成时所释放的总能量的差
c.下图可表示反应I的反应过程和能量的关系
 。
。
您最近一年使用:0次
9 . 下列与化学反应能量变化相关的叙述正确的是
| A.ΔH﹥0表示放热反应,ΔH﹤0表示吸热反应 |
| B.热化学方程式的化学计量数可以表示分子数或原子数,因此必须是整数 |
| C.根据盖斯定律,可计算某些难以直接测量的反应热 |
| D.同温同压下,H2( g)+Cl2(g)=2HCl (g),在光照和点燃条件的△H不同 |
您最近一年使用:0次
10 . Ⅰ.氨是工业生产硝酸的重要原料,请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题:

(1)工业用甲烷制取氢气作为合成氨的原料,已知以下的热化学反应方程式:
①2CO(g)+O2(g)=2CO2(g)∆H=-566kJ/mol
②2H2(g)+O2(g)=2H2O(g)∆H=-484kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)∆H=-890kJ/mol
则:CH4(g)+CO2(g)=2CO(g)+2H2(g)∆H=__ kJ/mol。
(2)一定温度下,将N2与H2以体积比1:2置于2L的密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g),下列能说明反应达到平衡状态的是
2NH3(g),下列能说明反应达到平衡状态的是___ 。
A.体系压强保持不变
B.混合气体颜色保持不变
C.N2与H2的物质的量之比保持不变
D.每消耗2molNH3的同时消耗1molN2
(3)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用氨转化法处理:已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为__ 。
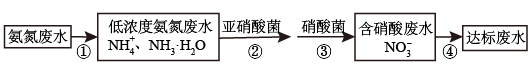
Ⅱ.氮肥厂的废水直接排放会造成污染,目前氨氮废水处理方法主要有吹脱法、化学沉淀法、生物硝化反硝化法等。某氮肥厂的氨氮废水中氮元素多以NH 和NH3•H2O的形式存在。该厂技术团队设计该废水处理方案流程如图:
和NH3•H2O的形式存在。该厂技术团队设计该废水处理方案流程如图:
(4)检验某溶液中是否含有NH 的方法
的方法___ (写出所需试剂、操作及现象)。
(5)过程②、③:在微生物亚硝酸菌和硝酸菌作用下实现NH →NO
→NO →NO
→NO 的转化,称为硝化反应。1molNH
的转化,称为硝化反应。1molNH 可被
可被___ L(标准状况)O2最终氧化成NO 。
。
(6)过程④:在一定条件下向废水中加入甲醇(CH3OH)实现HNO2→N2转化,称为反硝化反应。此过程中甲醇(C元素-2价)转化为CO2,写出此过程的化学方程式___ 。

(1)工业用甲烷制取氢气作为合成氨的原料,已知以下的热化学反应方程式:
①2CO(g)+O2(g)=2CO2(g)∆H=-566kJ/mol
②2H2(g)+O2(g)=2H2O(g)∆H=-484kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)∆H=-890kJ/mol
则:CH4(g)+CO2(g)=2CO(g)+2H2(g)∆H=
(2)一定温度下,将N2与H2以体积比1:2置于2L的密闭容器中发生反应:N2(g)+3H2(g)
 2NH3(g),下列能说明反应达到平衡状态的是
2NH3(g),下列能说明反应达到平衡状态的是A.体系压强保持不变
B.混合气体颜色保持不变
C.N2与H2的物质的量之比保持不变
D.每消耗2molNH3的同时消耗1molN2
(3)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用氨转化法处理:已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为
Ⅱ.氮肥厂的废水直接排放会造成污染,目前氨氮废水处理方法主要有吹脱法、化学沉淀法、生物硝化反硝化法等。某氮肥厂的氨氮废水中氮元素多以NH
 和NH3•H2O的形式存在。该厂技术团队设计该废水处理方案流程如图:
和NH3•H2O的形式存在。该厂技术团队设计该废水处理方案流程如图:
(4)检验某溶液中是否含有NH
 的方法
的方法(5)过程②、③:在微生物亚硝酸菌和硝酸菌作用下实现NH
 →NO
→NO →NO
→NO 的转化,称为硝化反应。1molNH
的转化,称为硝化反应。1molNH 可被
可被 。
。(6)过程④:在一定条件下向废水中加入甲醇(CH3OH)实现HNO2→N2转化,称为反硝化反应。此过程中甲醇(C元素-2价)转化为CO2,写出此过程的化学方程式
您最近一年使用:0次



