1 . 反应2H2(g)+O2(g)=2H2O(1) ΔH=-571.6 kJ·mol-1 过程中的能量变化关系如图。下列说法错误的是

| A.ΔH1>△H2 |
| B.ΔH1+ΔH2+ΔH3=ΔH4=-571.6kJ·mol-1 |
C.2mol水蒸气转化为液态水能够释放出的能量为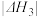 kJ kJ |
| D.若将上述反应设计成原电池,则当氢失4mol电子时能够产生571.6kJ的电能 |
您最近一年使用:0次
2021-03-14更新
|
496次组卷
|
6卷引用:辽宁省大连市一0三中学2020-2021学年高一4月月考化学试题
辽宁省大连市一0三中学2020-2021学年高一4月月考化学试题福建省福州市2021届高考3月毕业班质量检测(一模)化学试题(已下线)押山东卷第07题 化学反应与能量-备战2021年高考化学临考题号押题(山东卷)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)云南省大理州实验中学2021-2022学年高二上学期化学期末考试题
20-21高一下·全国·课时练习
名校
解题方法
2 . 氢能是最具前景的清洁能源之一,目前水分解制氢技术及贮氢材料的开发应用都取得了很大进展。已知:2H2(g)+ O2(g)=2H2O(1)∆H=-571.6kJ·mol-1。下列说法错误的是
| A.1mol H2O(l)分解制得1molH2需要吸收571.6kJ的能量 |
| B.氢气作为新能源具有热值高、无污染、资源丰富、可再生等优点 |
| C.贮氢材料具有能大量、快速和高效率地吸收和释放氢气的特点 |
| D.利用太阳能光催化分解水制氢是一种理想的制氢手段 |
您最近一年使用:0次
2021-03-09更新
|
273次组卷
|
3卷引用:江苏省沭阳县修远中学2020-2021学年高一下学期第一次月考化学试题
江苏省沭阳县修远中学2020-2021学年高一下学期第一次月考化学试题(已下线)6.2.2 燃料燃烧释放的能量 氢燃料的应用前景(练习)-2020-2021学年下学期高一化学同步精品课堂(苏教版2019必修第二册)江苏省淮安市涟水县第一中学2021-2022学年高一下学期第一次阶段检测化学试题
名校
3 . (1)已知下列热化学方程式:
a.H2(g)+ O2(g)═H2O(l);△H=-285.8kJ•mol-1
O2(g)═H2O(l);△H=-285.8kJ•mol-1
b.H2(g)+ O2(g)═H2O(g);△H=-241.8kJ•mol-1
O2(g)═H2O(g);△H=-241.8kJ•mol-1
c.CO(g)═C(s)+ O2(g);△H=+110.5kJ•mol-1
O2(g);△H=+110.5kJ•mol-1
d.C(s)+O2(g)═CO2(g);△H=-393.5kJ•mol-1
回答下列问题:
①上述反应中属于吸热反应的是________
②CO的燃烧热△H=________ 。表示CO燃烧热的热化学方程式为________ 。
③燃烧10g H2生成液态水,放出的热量为________ 。
(2)可以用反应的△H和△S的正、负来判断该反应自发进行的可能性和自发进行的条件。函数△G就是一个判断的依据:△G=△H-T△S式中T为反应的温度(开尔文温度,没有负值)。
①当一个反应的△G___________ 0(填“>”、“<”或“=”)时,反应一定能自发进行。
②当△H<0,△S<0,温度___________ (填“较高”或“较低”)时能自发反应。
a.H2(g)+
 O2(g)═H2O(l);△H=-285.8kJ•mol-1
O2(g)═H2O(l);△H=-285.8kJ•mol-1b.H2(g)+
 O2(g)═H2O(g);△H=-241.8kJ•mol-1
O2(g)═H2O(g);△H=-241.8kJ•mol-1c.CO(g)═C(s)+
 O2(g);△H=+110.5kJ•mol-1
O2(g);△H=+110.5kJ•mol-1d.C(s)+O2(g)═CO2(g);△H=-393.5kJ•mol-1
回答下列问题:
①上述反应中属于吸热反应的是
②CO的燃烧热△H=
③燃烧10g H2生成液态水,放出的热量为
(2)可以用反应的△H和△S的正、负来判断该反应自发进行的可能性和自发进行的条件。函数△G就是一个判断的依据:△G=△H-T△S式中T为反应的温度(开尔文温度,没有负值)。
①当一个反应的△G
②当△H<0,△S<0,温度
您最近一年使用:0次
2020-12-19更新
|
119次组卷
|
2卷引用:广西钦州市第四中学2020-2021学年高一下学期4月月考化学试题1
名校
解题方法
4 . 二甲醚(CH3OCH3)被称为“21 世纪的清洁燃料”。利用甲醇脱水可制得二甲醚,反应方程式如下: 2CH3OH(g)  CH3OCH3(g) + H2O(g) ΔH1
CH3OCH3(g) + H2O(g) ΔH1
(1)二甲醚亦可通过合成气反应制得,相关热化学方程式如下:
2H2(g)+ CO(g) CH3OH(g) ΔH2
CH3OH(g) ΔH2
CO(g)+ H2O(g) CO2(g)+ H2(g) ΔH3
CO2(g)+ H2(g) ΔH3
3H2(g)+ 3CO(g) CH3OCH3(g)+ CO2 (g) ΔH4
CH3OCH3(g)+ CO2 (g) ΔH4
则ΔH1=____________ (用含有ΔH2、ΔH3、ΔH4的关系式表示)。
(2)经查阅资料,上述反应平衡状态下 Kp的计算式为: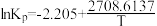 (Kp为以分压表示的平衡常数,T 为热力学温度)。且催化剂吸附 H2O(g)的量会受压强影响,从而进一步影响催化效率。)
(Kp为以分压表示的平衡常数,T 为热力学温度)。且催化剂吸附 H2O(g)的量会受压强影响,从而进一步影响催化效率。)
① 在一定温度范围内,随温度升高,CH3OH(g)脱水转化为二甲醚的倾向______________ (填“增大”、“不变”或“减小”)。
② 某温度下(此时 Kp=100),在密闭容器中加入CH3OH,反应到某时刻测得各组分的分压如下:
此时正、逆反应速率的大小:v正______ v逆 (填“>”、 “<”或“=”)。
③ 200℃时,在密闭容器中加入一定量甲醇 CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为__________ (填标号)。
A < B
B  C
C  ~
~ D
D  E >
E >
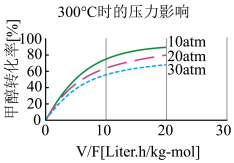
④ 300℃时,使 CH3OH(g)以一定流速通过催化剂,V/F (按原料流率的催化剂量)、压强对甲醇转化率影响如图所示。请解释甲醇转化率随压强(压力)变化的规律和产生这种变化的原因,规律,原因_________ 。
 CH3OCH3(g) + H2O(g) ΔH1
CH3OCH3(g) + H2O(g) ΔH1(1)二甲醚亦可通过合成气反应制得,相关热化学方程式如下:
2H2(g)+ CO(g)
 CH3OH(g) ΔH2
CH3OH(g) ΔH2CO(g)+ H2O(g)
 CO2(g)+ H2(g) ΔH3
CO2(g)+ H2(g) ΔH33H2(g)+ 3CO(g)
 CH3OCH3(g)+ CO2 (g) ΔH4
CH3OCH3(g)+ CO2 (g) ΔH4则ΔH1=
(2)经查阅资料,上述反应平衡状态下 Kp的计算式为:
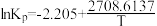 (Kp为以分压表示的平衡常数,T 为热力学温度)。且催化剂吸附 H2O(g)的量会受压强影响,从而进一步影响催化效率。)
(Kp为以分压表示的平衡常数,T 为热力学温度)。且催化剂吸附 H2O(g)的量会受压强影响,从而进一步影响催化效率。)① 在一定温度范围内,随温度升高,CH3OH(g)脱水转化为二甲醚的倾向
② 某温度下(此时 Kp=100),在密闭容器中加入CH3OH,反应到某时刻测得各组分的分压如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 分压/MPa | 0.50 | 0.50 | 0.50 |
③ 200℃时,在密闭容器中加入一定量甲醇 CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为
A <
 B
B  C
C  ~
~ D
D  E >
E >
④ 300℃时,使 CH3OH(g)以一定流速通过催化剂,V/F (按原料流率的催化剂量)、压强对甲醇转化率影响如图所示。请解释甲醇转化率随压强(压力)变化的规律和产生这种变化的原因,规律,原因

您最近一年使用:0次
2020-11-26更新
|
90次组卷
|
2卷引用:江西省高安中学2020-2021学年高一上学期第一次月考(A)化学试题
名校
5 . 已知:①2C(s)+O2(g)=2CO(g)△H1;②2CO(g)+O2(g)=2CO2(g)△H2。下列说法中正确的是
| A.碳的燃烧热为0.5△H1kJ/mol |
| B.②为能表示CO燃烧热的热化学方程式 |
| C.碳的燃烧热△H=0.5(△H1+△H2) |
| D.碳的燃烧热小于CO的燃烧热 |
您最近一年使用:0次
2020-11-03更新
|
108次组卷
|
3卷引用:内蒙古自治区乌拉特前旗第一中学2020-2021学年高一下学期4月月考化学试题
名校
解题方法
6 . 以太阳能为热源,热化学硫碘循环分解水是一种高效、环保的制氢方法,其流程如图所示。
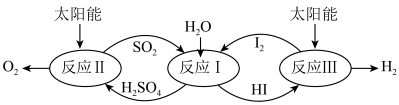
相关反应的热化学方程式为:
反应Ⅰ:SO2(g)+I2(g)+2H2O(l)=2HI(aq)+H2SO4(aq) H1=-213kJ•mol-1
反应Ⅱ:H2SO4(aq)=SO2(g)+H2O(l)+ O2(g) H2=+327kJ•mol-1
O2(g) H2=+327kJ•mol-1
反应Ⅲ:2HI(aq)=H2(g)+I2(g) H3=+172kJ•mol-1
下列说法不正确的是

相关反应的热化学方程式为:
反应Ⅰ:SO2(g)+I2(g)+2H2O(l)=2HI(aq)+H2SO4(aq) H1=-213kJ•mol-1
反应Ⅱ:H2SO4(aq)=SO2(g)+H2O(l)+
 O2(g) H2=+327kJ•mol-1
O2(g) H2=+327kJ•mol-1反应Ⅲ:2HI(aq)=H2(g)+I2(g) H3=+172kJ•mol-1
下列说法不正确的是
| A.该过程实现了太阳能到化学能的转化 |
| B.SO2和I2对总反应起到了催化作用 |
| C.总反应的热化学方程式为2H2O(l)=2H2(g)+O2(g) H=+286kJ•mol-1 |
| D.该过程降低了水分解制氢的活化能,但总反应的H不变 |
您最近一年使用:0次
2020-10-12更新
|
2825次组卷
|
28卷引用:安徽省怀宁中学2020-2021学年高一下学期第一次月考化学试题
安徽省怀宁中学2020-2021学年高一下学期第一次月考化学试题【全国百强校】内蒙古自治区赤峰二中2018-2019学年高一下学期第二次月考化学试题山东省聊城第三中学2021-2022学年高二上学期第三次质量检测化学试题 湖北省仙桃中学2022-2023学年高一上学期10月月考化学试题河南省实验中学2020届高三12月月考化学试题北京市2020届高三12月月考(新高考选考模式)化学试题山东省济南市历城第二中学2021届高三10月份学情检测化学试题(已下线)押山东卷第07题 化学反应与能量-备战2021年高考化学临考题号押题(山东卷)(已下线)高中化学《新教材变化解读与考法剖析》第一章 化学反应的热效应(人教版2019选择性必修1)北京市第三十一中学2021-2022学年高二上学期期中考试化学试题山东省聊城市第二中学2022-2023学年高二上学期第一次月考化学试题北京市北京师范大学燕化附中2022-2023学年高二上学期10月月考化学试题山东省临沂市平邑县第一中学2022-2023学年高二上学期10月月考化学试题湖南省衡阳市第八中学2022-2023学年高二下学期5月月考化学试题湖南省南雅中学2023-2024学年高二上学期第一次月考化学试题江西省宜春市上高二中2023-2024学年高二上学期第一次月考化学试题福建省厦门市集美中学2023-2024学年高二上学期10月第一次月考化学试题【区级联考】北京市海淀区2019届高三第一学期上学期期末考试化学试题【全国百强校】浙江省学军中学2019届高三下学期4月选考模拟冲刺化学试题(已下线)考点24 元素与理论综合——《备战2020年高考精选考点专项突破题集》2019年秋高三化学复习强化练习—— 盖斯定律及其应用北京市2020届高三质量监测化学试题(已下线)考点06 化学能与热能-2020年高考化学命题预测与模拟试题分类精编人教版(2019)高二化学选择性必修1第一章 化学反应的热效应 过模拟 2年模拟精编精练湖北省部分省重点中学2020-2021学年高二上学期期中联考化学试题湖北省部分重点中学2020-2021学年高二上学期期中考试化学试题(已下线)2023年北京卷高考真题变式题(选择题11-14)河北省唐山市丰润区2023-2024学年高二上学期期中考试化学试题
7 . 甲烷液化可获得工业原料甲醇,反应原理是:
①CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH1=+206.4kJ·mol-1
②CO(g)+H2O(g)===CO2(g)+H2(g) ΔH2=-41.0kJ·mol-1
③CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH3=-49.0kJ·mol-1
下列说法正确的是
①CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH1=+206.4kJ·mol-1
②CO(g)+H2O(g)===CO2(g)+H2(g) ΔH2=-41.0kJ·mol-1
③CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH3=-49.0kJ·mol-1
下列说法正确的是
A.反应①中的能量变化如图所示 |
| B.反应②使用催化剂,能降低该反应的活化能和ΔH2 |
| C.合成过程中应向原料气中添加H2 |
| D.CO(g)+2H2(g)===CH3OH(g) ΔH=-90.0kJ·mol-1 |
您最近一年使用:0次
2020-08-31更新
|
101次组卷
|
2卷引用:河南省商水县第二高中2020-2021学年高一下学期月考化学试题
12-13高二上·陕西·期中
名校
解题方法
8 . 已知热化学方程式:
① C2H2(g) + O2(g) = 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ•mol-1
O2(g) = 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ•mol-1
② C(s)+ O2(g) = CO2(g) △H2=-393.5 kJ•mol-1
③ H2(g)+ O2(g) = H2O(l) △H3 = -285.8 kJ·mol-1
O2(g) = H2O(l) △H3 = -285.8 kJ·mol-1
则反应④ 2C(s)+ H2(g) = C2H2(g)的△H为
① C2H2(g) +
 O2(g) = 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ•mol-1
O2(g) = 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ•mol-1② C(s)+ O2(g) = CO2(g) △H2=-393.5 kJ•mol-1
③ H2(g)+
 O2(g) = H2O(l) △H3 = -285.8 kJ·mol-1
O2(g) = H2O(l) △H3 = -285.8 kJ·mol-1则反应④ 2C(s)+ H2(g) = C2H2(g)的△H为
| A.+228.2 kJ·mol-1 | B.-228.2 kJ·mol-1 |
| C.+1301.0 kJ·mol-1 | D.+621.7 kJ·mol-1 |
您最近一年使用:0次
2020-05-31更新
|
642次组卷
|
29卷引用:广东省江门市第二中学2020-2021学年高一下学期第一次考试化学试题
广东省江门市第二中学2020-2021学年高一下学期第一次考试化学试题(已下线)2012-2013学年广东陆丰碣石中学高二第二次月考化学试卷陕西省黄陵中学2016-2017学年高一(重点班)下学期期末考试化学试题河南省信阳市商城县高级中学2017-2018学年高二上学期第一次月考化学试题黑龙江省饶河县高级中学2017-2018学年高二上学期第一次月考化学试题安徽省滁州市明光中学2018-2019学年高一下学期期中考试化学试题四川省北大附中成都为明学校2019-2020学年高二9月月考化学试题福建省漳平市第一中学2019-2020学年高二上学期第一次月考化学试题陕西省渭南市临渭区尚德中学2020届高三上学期第三次月考化学试题云南省普洱市景东彝族自治县第一中学2019-2020学年高一下学期期中考试化学试题内蒙古乌兰察布市集宁一中2019-2020学年高一下学期期中考试化学试题青海省西宁市海湖中学2020-2021学年高二上学期第一阶段测试化学试题陕西省咸阳市实验中学2020-2021学年高二上学期第二次月考化学试题江西省鹰潭市第一中学2019—2020学年高一下学期期末考试化学试题青海省西宁市海湖中学2020-2021学年高二下学期开学考试化学试题云南省水富县云天化中学2020-2021学年高二下学期期中考试化学试题内蒙古霍林郭勒市第一中学2021-2022学年高二上学期期中考试化学试题吉林市第二中学2022-2023学年高二上学期9月月考化学试题(已下线)2011-2012学年陕西师大附中高二年级第一学期期中考试化学试卷(已下线)2015届黑龙江省牡丹江第一高中高二上学期期中考试化学(理)试卷宁夏吴忠中学2017-2018学年高二下学期开学考试化学试题西藏自治区日喀则市南木林高级中学2018-2019学年高二上学期期中考试化学试题高二人教版选修4 第一章 第三节 化学反应热的计算重庆市云阳县2019-2020学年高二上学期期中考试化学试题(已下线)1.1.3 反应焓变的计算 练习——【高中新教材同步备课】鲁科版高中化学选择性必修1黑龙江省牡丹江市阳明区2022-2023学年高三上学期第四次阶段考试化学试题四川省成都市简阳市阳安中学2022-2023学年高二上学期期中考试化学试题甘肃省天水市秦安县第一中学2022-2023学年高二上学期期末考试化学试题广西南宁市西乡塘区南宁高新技术产业开发区桂鼎学校2022-2023学年高二上学期11月期中化学试题
名校
解题方法
9 . (1)在25 ℃、101 kPa的条件下,
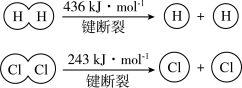
请回答下列有关问题:
①由H+H→H2,当生成1 mol H2时,要________ (填“吸收”或“放出”,下同)436 kJ的能量;由Cl2→Cl+Cl,当断裂1 mol Cl2中的共价键时,要________ 243 kJ的能量。
②对于反应H2(g)+Cl2(g)=2HCl(g),测得生成2 molHCl(g)时,反应过程中放出183 kJ的热量,则断开 1 mol H—Cl 键所需的能量是________ kJ。
③有两个反应:a.H2(g)+Cl2(g) 2HCl(g),b.H2(g)+Cl2(g)
2HCl(g),b.H2(g)+Cl2(g) 2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量
2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量________ (填“相等”或“不相等”)。
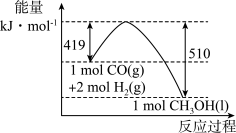
(2)根据图示的能量转化关系判断,生成16 g CH3OH(l)________ (填“吸收”或“放出”)________ kJ能量。

请回答下列有关问题:
①由H+H→H2,当生成1 mol H2时,要
②对于反应H2(g)+Cl2(g)=2HCl(g),测得生成2 molHCl(g)时,反应过程中放出183 kJ的热量,则断开 1 mol H—Cl 键所需的能量是
③有两个反应:a.H2(g)+Cl2(g)
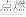 2HCl(g),b.H2(g)+Cl2(g)
2HCl(g),b.H2(g)+Cl2(g)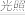 2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量
2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量
(2)根据图示的能量转化关系判断,生成16 g CH3OH(l)
您最近一年使用:0次
2020-04-15更新
|
761次组卷
|
5卷引用:河北省张家口宣化一中2020-2021学年高一下学期4月月考化学试题
名校
解题方法
10 . S(单斜)和S(正交)是硫的两种同素异形体。已知:
①S(单斜,s)+O2(g)=SO2(g) △H1=-297.16 kJ·mol-1
②S(正交,s)+O2(g)=SO2(g) △H2=-296.83 kJ·mol-1
③S(单斜,s)=S(正交,s) △H3
下列说法正确的是
①S(单斜,s)+O2(g)=SO2(g) △H1=-297.16 kJ·mol-1
②S(正交,s)+O2(g)=SO2(g) △H2=-296.83 kJ·mol-1
③S(单斜,s)=S(正交,s) △H3
下列说法正确的是
| A.△H3=+0.33 kJ·mol-1 |
| B.单斜硫转化为正交硫的反应是放热反应 |
| C.正交硫比单斜硫稳定 |
| D.①式表示断裂1 mol O2中的共价键所吸收的能量比形成1 mol SO2中的共价键所放出的能量少297.16 kJ |
您最近一年使用:0次
2020-04-13更新
|
171次组卷
|
2卷引用:山东省安丘一中2020-2021学年高一下学期4月份质量检测化学试题



