(1)已知2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ/mol,趣味实验“大象牙膏”的实验原理是H2O2溶液在KI催化作用下分解,反应的机理可表示为:
i.H2O2(l)+I-(aq)= H2O(l)+IO-(aq) △H1 = +a kJ/moL(a > 0)
ii.H2O2(l)+_______。
则ii中反应机理用热化学方程式表示为
(2)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① |  溶液 溶液 | 无 |
| ② | 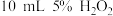 溶液 溶液 | 无 |
| ③ | 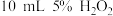 溶液 溶液 | 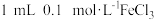 溶液 溶液 |
| ④ | 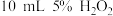 溶液 溶液 少量 HCl溶液 少量 HCl溶液 | 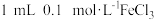 溶液 溶液 |
| ⑤ | 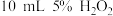 溶液 溶液 少量 NaOH溶液 少量 NaOH溶液 | 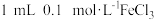 溶液 溶液 |
 较稳定,不易分解,为达到实验目的,你对原方案的改进是
较稳定,不易分解,为达到实验目的,你对原方案的改进是Ⅱ.
 实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图,结合图分析实验,能够得出什么实验结论?
实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图,结合图分析实验,能够得出什么实验结论?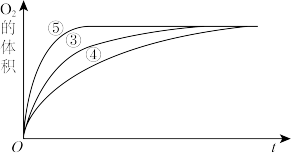
Ⅲ.为比较
 和
和 对
对 分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是
分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是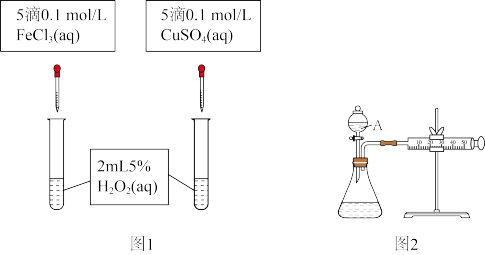
①写出
 在
在 作用下发生反应的化学方程式:
作用下发生反应的化学方程式: 
②利用图1实验,可通过观察产生气泡的快慢定性比较得出结论
 有同学提出将
有同学提出将 改为
改为 更为合理,其理由是
更为合理,其理由是 ③若利用图2实验可进行定理分析,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是
④将
 粉末加入50mL
粉末加入50mL  溶液中,在标准状况下放出气体的体积和时间的关系如图3所示,解释反应速率变化的原因:
溶液中,在标准状况下放出气体的体积和时间的关系如图3所示,解释反应速率变化的原因:  初始物质的量浓度为
初始物质的量浓度为 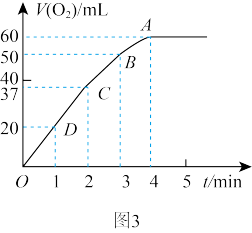
(1)有下列反应:Fe+Cu2+=Fe2++Cu;2Fe3++Cu=2Fe2++Cu2+;在Cu2+、Fe2+、Fe3+中,其氧化性由强到弱顺序为
(2)根据反应MnO2+4HCl
 MnCl2+Cl2↑+2H2O,回答下列问题:
MnCl2+Cl2↑+2H2O,回答下列问题:①反应中n(还原剂):n(氧化剂)=
②该反应中盐酸的作用是
A.只氧化性 B.只有酸性 C.只有还原性 D.有氧化性也有酸性 E.有还原性也有酸性
③在方程式上用单线桥表示上述反应电子转移的方向和数目
MnO2+4HCl=MnCl2+Cl2↑+2H2O
④配平方程式:
______MnO
 +______C2O
+______C2O +______H+=______Mn2++______CO2↑+______H2O
+______H+=______Mn2++______CO2↑+______H2OII.有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。
(3)在101kPa下,1g氢气完全燃烧生成液态水放出142.9kJ的热量,请回答下列问题。
①氢气燃烧热的热化学方程式为
②若1mol氢气完全燃烧生成1mol气态水放出241kJ的热量,已知H-O键能为463kJ•mol-1,O=O键能为498kJ•mol-1,计算H-H键能为
(4)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)=MgH2(s) △H1=-74.5kJ•mol-1;
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) △H2=-64.4kJ•mol-1;
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) △H3。
则△H3=
I.固硫技术:通过加入固硫剂,将硫元素以固体形式留在煤燃烧的残渣中。石灰石是常用的固硫剂,固硫过程中涉及的部分反应如下:
①CaCO3(s)
 CaO(s)+CO2(g) △H1=+178.30kJ/mol
CaO(s)+CO2(g) △H1=+178.30kJ/mol②CaO(s)+SO2(g)+0.5O2(g)
 CaSO4(s) △H2=-501.92kJ/mol
CaSO4(s) △H2=-501.92kJ/mol③CO(g)+0.5O2(g)
 CO2(g) △H3
CO2(g) △H3④CaSO4(s)+CO(g)
 CaO(s)+SO2(g)+CO2(g) △H4=+218.92kJ/mol
CaO(s)+SO2(g)+CO2(g) △H4=+218.92kJ/mol(1)温度升高,反应①的化学平衡常数
(2)△H3=
(3)在煤燃烧过程中常鼓入稍过量的空气以提高固硫率(燃烧残渣中硫元素的质量占燃煤中硫元素总质量的百分比),结合反应②、③、④分析其原因:
II.电化学脱硫技术是一种温和的净化技术,其基本原理为利用阳极反应产生的羟基自由基(·OH,氧元素为-1价)将燃煤中的含硫物质氧化除去。
(4)将煤打成煤浆加入电解槽的目的是
(5)补全用羟基自由基除去煤中二硫化亚铁(FeS2)的反应的离子方程式:
FeS2+·OH=Fe3++SO
 +H2O+_____。
+H2O+_____。(6)对某含FeS2的煤样品进行电解脱硫,测得一定时间内随溶液起始pH的改变脱硫率(溶于水中的硫元素质量占煤样中硫元素总质量的百分比)的变化如图所示。

pH大于1.5后脱硫率下降的可能原因有:随着pH的升高,反应物的氧化性或还原性降低;
 。
。(1)某次实验需要使用
 的
的 溶液,欲用
溶液,欲用 固体配制该溶液,实验中需要称量
固体配制该溶液,实验中需要称量 晶体,下图不需要的仪器是
晶体,下图不需要的仪器是 (填“>”或“<”)
(填“>”或“<”)
(2)“84消毒液”在存放中会变质,实验室中可用淀粉
 试纸判断某“84消毒液”是否完全变质,若试纸
试纸判断某“84消毒液”是否完全变质,若试纸 能将
能将 氧化为
氧化为 ,若用
,若用 上述所配溶液,能恰好氧化
上述所配溶液,能恰好氧化 溶液,则
溶液,则
(3)已知:①

②

写出在溶液中
 分解生成
分解生成 的热化学方程式:
的热化学方程式:(4)在不同温度时,测得84消毒液
 值(
值( 表示水溶液中物质的氧化性或还原性强弱。
表示水溶液中物质的氧化性或还原性强弱。 值越大,氧化性越强)随时间的变化曲线如图所示:
值越大,氧化性越强)随时间的变化曲线如图所示:
试分析,
 值在不同温度下变化不同的原因可能是
值在不同温度下变化不同的原因可能是5 . 煤的洁净技术(包括固硫技术和脱硫技术两类)可有效降低燃煤废气中SO2的含量,已成为我国解决环境问题的主导技术之一。
I.固硫技术:通过加入固硫剂,将硫元素以固体形式留在煤燃烧的残渣中。石灰石是常用的固硫剂,固硫过程中涉及的部分反应如下:
①CaCO3(s)⇌CaO(s)+CO2(g) ∆H1= +178.30kJ/mol
②CaO(s)+SO2(g)+0.5O2(g)⇌CaSO4(s) ∆H2= -501.92 kJ/mol
③CO(g) + 0.5O2(g)⇌CO2(g) ∆H3
④CaSO4(s) + CO(g)⇌CaO(s) + SO2(g) + CO2(g) ∆H4= +218.92kJ/mol
(1)温度升高,反应①的化学平衡常数
(2)∆H3=
(3)在煤燃烧过程中常鼓入稍过量的空气以提高固硫率(燃烧残渣中硫元素的质量占燃煤中硫元素总质量的百分比),结合反应②、③、④分析其原因:
II.电化学脱硫技术是一种温和的净化技术,其基本原理为利用阳极反应产生的羟基自由基(·OH,氧元素为-1价)将燃煤中的含硫物质氧化除去,其装置示意图如图所示。
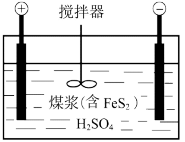
(4)将煤打成煤浆加入电解槽的目的是
(5)阳极的电极反应式为
(6)用羟基自由基除去煤中二硫化亚铁(FeS2)的反应的离子方程式为(补全并配平):FeS2+·OH =Fe3++SO + H2O +_______
+ H2O +_______
(7)利用上述装置对某含FeS2的煤样品进行电解脱硫,测得一定时间内随溶液起始pH的改变脱硫率(溶于水中的硫元素质量占煤样中硫元素总质量的百分比)的变化如图所示。pH大于1.5后脱硫率下降的可能原因有:随着pH的升高,反应物的氧化性或还原性降低;
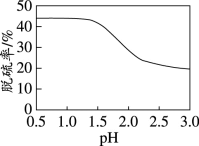
(1)双氧水的强氧化性使其对大多数病菌和病毒具有消杀功能。用3%医用双氧水对不传染病房喷洒消毒时,地板上有气泡冒出,该气体是
(2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢。知0.4mol液态肼与足量的液态过氧化氢反应,生成氮气和水蒸气,并放出256.652kJ的热量。该反应的热化学方程式为
(3)双氧水能将碱性废水中的CN-转化成碳酸盐和一种对环境无污染的气体,CN-的电子式为
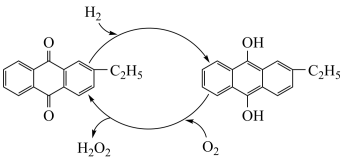
(4)如图是工业上制备过氧化氢最常见的方法,写出实际发生反应的总方程式
(5)如图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。

①Ir—Ru惰性电极吸附O2生成H2O2,其电极反应式是
②处理废氨水中溶质(以NH3计)的质量是34g,理论上电路中转移电子数为
 CH3OH(g)。
CH3OH(g)。已知:①CO(g)+1/2O2(g)=CO2(g)
 H1
H1 ②H2(g)+1/2O2(g)=H2O(g) ΔH2
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH3
回答下列问题:
(1)CO(g)+2H2(g)
 CH3OH(g)的平衡常数K表达式
CH3OH(g)的平衡常数K表达式(2)若在绝热、恒容的密闭容器中充入1 mol CO、2 mol H2,发生CO(g)+2H2(g)
 CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是
CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是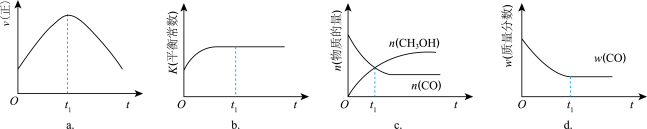
(3)T1℃时,在一个体积为5 L的恒容容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.8,则5 min内用H2表示的反应速率为v(H2)=
 CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=(4)为了提高燃料的利用率可以将甲醇设计为燃料电池,写出KOH作电解质溶液时,甲醇燃料电池的负极反应式:
(5)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:
(1)土壤中的微生物可将H2S经两步反应氧化成
 ,两步反应的能量变化示意图如图:
,两步反应的能量变化示意图如图: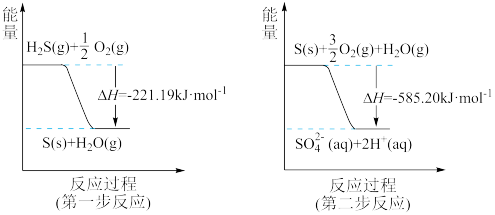
1molH2S(g)全部氧化为
 (aq)的热化学方程式为
(aq)的热化学方程式为(2)标准摩尔生成焓是指在25℃和101kPa时,最稳定的单质生成1mol化合物的焓变。已知25℃和101kPa时下列反应:
①
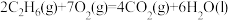

②
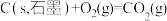

③

写出乙烷(C2H6)标准摩尔生成焓的焓变
 =
= 、
、 、
、 的式子表示)。
的式子表示)。(3)全钒液流二次电池是利用不同价态的含钒离子在酸性条件下发生反应,其电池结构如图1所示。已知酸性溶液中钒以VO
 (黄色)、V2+(紫色)、VO2+(蓝色)、V3+(绿色)的形式存在。放电过程中,电池的正极反应式为
(黄色)、V2+(紫色)、VO2+(蓝色)、V3+(绿色)的形式存在。放电过程中,电池的正极反应式为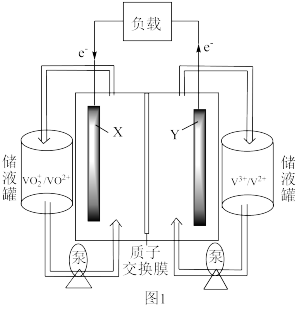
(4)我国某科研团队设计了一种电解装置,将CO2和NaCl高效转化为CO和NaClO,原理如图2所示:

通入CO2气体的一极为
(1)已知:2Cu2S(s) +3O2(g)= 2Cu2O(s)+2SO2(g) △H1=—768.2 kJ·mol-1;
2Cu2O(s) +Cu2S(s)=6Cu(s)+SO2(g) △H2=+116.0kJ ·mol-1。
则Cu2S(s) +O2(g)=2Cu(s)+ SO2(g) △H=
(2)某兴趣小组同学如图装置进行实验,观察到两极均有气体产生,Y极溶液逐渐变成紫红色,停止实验后观察到铁电极明显变细,电解液仍澄清。查阅资料知,高铁酸根离子(FeO
 )在溶液中呈紫红色。
)在溶液中呈紫红色。
①电解过程中,X极溶液的pH
②电解过程中,Y极发生的电极反应为4OH—-4e—=2H2O+O2↑和
(3)已知常温下:
| 弱电解质 | H2S | H2CO3 | H2SO3 | CH3COOH | NH3· H2O |
| 电离常数 | Ka1=1.1 ×10 -7 Ka2=1.3 ×10-13 | Ka1=4.5 ×10-7 Ka2=4.7 ×10-11 | Ka1=1.4 ×10-2 Ka2=6.0 ×10-8 | Ka=1.8 ×10-5 | Kb=1.8 ×10-5 |
①浓度均为0.1mol·L-1的Na2S溶液、NaHCO3和Na2CO3溶液,碱性由强到弱的顺序是
②S2-、HS-、CO
 、HCO
、HCO 四种离子结合H+能力由大到小的顺序是
四种离子结合H+能力由大到小的顺序是③NaHSO3的水解常数Kh=
④CH3COONH4溶液显
 (aq)+2H+(aq)=H2O(l)+CO2(g) ΔH1<0, HCO
(aq)+2H+(aq)=H2O(l)+CO2(g) ΔH1<0, HCO (aq)+H+ (aq) =H2O(l) +CO2(g) ΔH2>0。回答下列问题:
(aq)+H+ (aq) =H2O(l) +CO2(g) ΔH2>0。回答下列问题:(1)乙同学认为该实验不一定能得到甲同学的结论,你支持谁的观点?
(2)查阅资料:
反应I :CO
 (aq) +2H+ (aq)=H2O(l) +CO2(g) ΔH1=-12.14kJ·mol-1;
(aq) +2H+ (aq)=H2O(l) +CO2(g) ΔH1=-12.14kJ·mol-1;反应II :HCO
 (aq) +H+ (aq)=H2O(l) +CO2(g) ΔH2= +12.64 kJ·mol-1
(aq) +H+ (aq)=H2O(l) +CO2(g) ΔH2= +12.64 kJ·mol-1①则反应III:CO
 (aq)+ H+ (aq)=HCO
(aq)+ H+ (aq)=HCO (aq) ΔH3=
(aq) ΔH3= ②向V mLc mol·L-1碳酸钠溶液中,逐滴加入2V mL c mol·L-1稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是
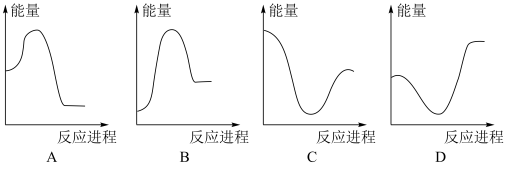
(3)该化学兴趣小组用如图所示装置设计了实验,验证碳酸钠、碳酸氢钠分别与稀盐酸反应的热效应。
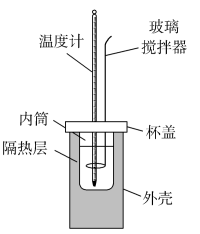
表格一:
| 试剂1 | 试剂2混合前温度/°C | 混合后温度/°C |
| 0.5 g Na2CO3 | 40mL HCl 19.0 | 21.7 |
| 0.5 g NaHCO3 | 40 mL HCl 19.0 | 18.1 |
| 试剂1 | 试剂2混合前温度/°C | 溶解后温度/°C | 静置后的温度/°C | 试剂3混合前温度/°C | 混合后温度/°C |
| 0.5gNa2CO3 | 10mLH2O19.0 | 22.3 | 19.0 | 10mLH2O19.0 | 19.0 |
| 0.5gNaHCO3 | 10mLH2O19.0 | 17.5 | 19.0 | 10mLH2O19.0 | 19.0 |
| 试剂1 | 试剂2混合前温度/°C | 溶解后温度/°C | 静置后的温度/°C | 试剂3混合前温度/°C | 混合后温度/°C |
| 0.5gNa2CO3 | 10mLH2O19.0 | 22.3 | 19.0 | 10mLHCl19.0 | 20.5 |
| 0.5gNaHCO3 | 10mLH2O19.0 | 17.5 | 19.0 | 10mLHCl19.0 | 18.3 |
①实验中玻璃搅拌器的使用方法是
②表格二对应实验得出的结论是
③反应IV:Na2CO3(s)+2H+(aq)=2Na+(aq)+H2O(l)+CO2(g) ΔH4;
反应V:NaHCO3(s)+H+(aq)=Na+(aq)+H2O(l)+CO2(g) ΔH5
则ΔH1



