名校
解题方法
1 . 已知:2H2O(l)=2H2(g)+O2(g) ΔH=+571.6kJ·mol-1。以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的图示与过程如下:
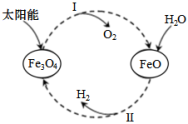
过程I:……
过程II:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH=+129.2kJ·mol﹣1
下列说法错误的是

过程I:……
过程II:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH=+129.2kJ·mol﹣1
下列说法错误的是
| A.该过程I能量转化形式是太阳能→化学能 |
B.过程I热化学方程式为:Fe3O4(s)=3FeO(s)+ O2(g) ΔH=﹣156.6kJ·mol﹣1 O2(g) ΔH=﹣156.6kJ·mol﹣1 |
| C.氢气的燃烧热为ΔH=﹣285.8 kJ·mol﹣1 |
| D.铁氧化合物循环制H2具有成本低、产物易分离等优点 |
您最近一年使用:0次
2021-02-02更新
|
325次组卷
|
4卷引用:湖北省咸宁市通城二中2020-2021学年高二上学期期末考试化学试题
湖北省咸宁市通城二中2020-2021学年高二上学期期末考试化学试题(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)云南省下关第一中学2022-2023学年高二下学期5月期中考试化学试题
2 . 化学在生产生活中有广泛的应用,请用所学的知识填空:
(1)氢氧燃料电池具有启动快、效率高等优点,其能量密度高于铅蓄电池。若电解液为 KOH 溶液,则氢氧燃料电池的负极反应式为______ 。
(2)泡沫灭火器内盛有 Al2(SO4)3、NaHCO3溶液,写出其反应的离子方程式______ 。
(3)金属铍(Be)是高效率的火箭燃料,燃烧时放出巨大的能量,已知 1 g 铍完全燃烧放出的热量为 62. 70 kJ,则表示铍的燃烧热的热化学方程式为: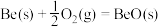 ∆H=
∆H=______ kJ·mol-1.
(4)FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的最后一步是在常温下调节溶液 pH=5,此时 c(Fe3+)=______ mol·L-1(已知:Ksp[Fe(OH)3]= 4.0×10-38)。
(1)氢氧燃料电池具有启动快、效率高等优点,其能量密度高于铅蓄电池。若电解液为 KOH 溶液,则氢氧燃料电池的负极反应式为
(2)泡沫灭火器内盛有 Al2(SO4)3、NaHCO3溶液,写出其反应的离子方程式
(3)金属铍(Be)是高效率的火箭燃料,燃烧时放出巨大的能量,已知 1 g 铍完全燃烧放出的热量为 62. 70 kJ,则表示铍的燃烧热的热化学方程式为:
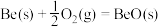 ∆H=
∆H=(4)FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的最后一步是在常温下调节溶液 pH=5,此时 c(Fe3+)=
您最近一年使用:0次
3 . 生活中离不开化学。运用化学知识回答下列问题。
(1)氢气、丙烷是重要的燃料,计算等质量的氢气完全燃烧产生的热量是丙烷完全燃烧产生的热量的______ 倍(精确到小数点后二位)。(已知:氢气、丙烷的燃烧热分别为:286kJ• ,2217. 6 kJ•
,2217. 6 kJ• )
)
(2)NH4Al(SO4)2在食品加工中是一种合法的食品添加剂,它还是一种净水剂,其净水的理由是______ (用化学用语回答)。
(3)龋齿是有机酸使牙齿中的Ca5(PO4)3(OH)溶解造成的。使用含氟牙膏会使其转化为Ca5(PO4)3F抵抗酸的腐蚀,含氟牙膏能使牙断中Ca5(PO4)3(OH)转化为Ca5(PO4)3F的理由足:溶解度Ca5(PO4)3(OH)______ Ca5(PO4)3F(填“﹥”或“﹤”)。
(4)目前民用电池的主要成分是碱性锌锰电池,该电池的总反应式为:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,该电池放电时,负极的电极反应式为______ 。
(1)氢气、丙烷是重要的燃料,计算等质量的氢气完全燃烧产生的热量是丙烷完全燃烧产生的热量的
 ,2217. 6 kJ•
,2217. 6 kJ• )
)(2)NH4Al(SO4)2在食品加工中是一种合法的食品添加剂,它还是一种净水剂,其净水的理由是
(3)龋齿是有机酸使牙齿中的Ca5(PO4)3(OH)溶解造成的。使用含氟牙膏会使其转化为Ca5(PO4)3F抵抗酸的腐蚀,含氟牙膏能使牙断中Ca5(PO4)3(OH)转化为Ca5(PO4)3F的理由足:溶解度Ca5(PO4)3(OH)
(4)目前民用电池的主要成分是碱性锌锰电池,该电池的总反应式为:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,该电池放电时,负极的电极反应式为
您最近一年使用:0次
4 . 下列关于焓变△H的描述错误的是
| A.△H会影响化学反应的方向 |
| B.化学键断裂和形成的能量变化影响化学反应的ΔH |
| C.加热条件下发生的化学反应ΔH均大于零 |
| D.由热化学方程式H2(g)+1/2O2(g)=H2O(l)△H=-285.8kJ/mol可知该反应条件下氢气的燃烧热△H=-285.8kJ/mol |
您最近一年使用:0次
2021-01-27更新
|
121次组卷
|
2卷引用:四川省遂宁市2020-2021学年高二上学期期末教学水平监测化学试题
5 . 汽车在行驶过程中有如下反应发生:
ⅰ.N2(g)+O2(g) ⇌2NO(g)ΔH=+180.7 kJ·mol-1
ⅱ.2NO(g)+2CO(g) ⇌N2(g)+2CO2(g)ΔH=-746.5 kJ·mol-1
(1)能表示CO燃烧热的热化学方程式为___________ 。
(2)反应ⅱ在___________ (填“较高”或“较低”)温度下能自发进行。
(3)T温度时,向10 L恒容密闭容器中充入2 molNO和2molCO发生反应ⅱ,5min时达到平衡,测得0~5min内该反应速率v(N2)=0.016 mol·L-1·min-1
①T温度时,该反应的平衡常数K=___________ 。
②平衡时容器内压强与起始时容器内压强之比为___________ 。
(4)一定条件下,向起始容积为5 L的恒压密闭容器中充入1 mol N2和1 mol O2发生反应ⅰ。O2的平衡转化率[α(O2)]与温度(T)的关系如图1所示;正反应的平衡常数(K正)与温度(T)的关系如图2所示。
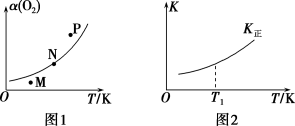
①图1中,M、N、P三点所对应的状态下,v正>v逆的是___________ (填字母),理由为___________ 。
②T1温度时,K正=1,则O2的平衡转化率为___________ (保留三位有效数字)。
ⅰ.N2(g)+O2(g) ⇌2NO(g)ΔH=+180.7 kJ·mol-1
ⅱ.2NO(g)+2CO(g) ⇌N2(g)+2CO2(g)ΔH=-746.5 kJ·mol-1
(1)能表示CO燃烧热的热化学方程式为
(2)反应ⅱ在
(3)T温度时,向10 L恒容密闭容器中充入2 molNO和2molCO发生反应ⅱ,5min时达到平衡,测得0~5min内该反应速率v(N2)=0.016 mol·L-1·min-1
①T温度时,该反应的平衡常数K=
②平衡时容器内压强与起始时容器内压强之比为
(4)一定条件下,向起始容积为5 L的恒压密闭容器中充入1 mol N2和1 mol O2发生反应ⅰ。O2的平衡转化率[α(O2)]与温度(T)的关系如图1所示;正反应的平衡常数(K正)与温度(T)的关系如图2所示。

①图1中,M、N、P三点所对应的状态下,v正>v逆的是
②T1温度时,K正=1,则O2的平衡转化率为
您最近一年使用:0次
6 . 下列依据热化学方程式得出的结论正确的是
A.若  ,则 ,则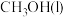 的燃烧热为 的燃烧热为 |
B.若  ,则红磷比白磷稳定 ,则红磷比白磷稳定 |
C.已知  ,则 ,则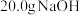 固体与稀盐酸完全中和,放出 固体与稀盐酸完全中和,放出 的热量 的热量 |
D.已知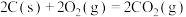  , ,  ,则 ,则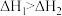 |
您最近一年使用:0次
2021-01-10更新
|
523次组卷
|
7卷引用:辽宁省沈阳市郊联体2020-2021学年高二上学期期末考试化学试题
名校
解题方法
7 . Ⅰ.已知下列热化学方程式:
①2H2(g)+O2(g)=2H2O(l) △H=-570kJ/mol
②2H2O(g)=2H2(g)+O2(g) △H=+483.6kJ/mol
③2CO(g)=2C(s)+O2(g) △H=+220.8kJ/mol
④2C(s)+2O2(g)=2CO2(g) △H=-787kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是______ (填写序号)。
(2)H2的燃烧热为______ 。
(3)燃烧10gH2生成液态水,放出的热量为______ 。
(4)C(s)的燃烧热的热化学方程式为______
(5)已知:1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6kJ的热量,由此推知H2SO4与NaOH发生中和反应,写出该中和热的热化学方程式为______ 。
Ⅱ.已知:工业上制二甲醚是在一定温度(230~280℃)、压强(2.0~10.0MPa)和催化剂作用下进行的,反应器中发生了下列反应:
CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.7kJ·mol-1 ①
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1 ②
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 ③
(6)反应器中的总反应可表示为3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g),计算该反应的ΔH=______ 。
①2H2(g)+O2(g)=2H2O(l) △H=-570kJ/mol
②2H2O(g)=2H2(g)+O2(g) △H=+483.6kJ/mol
③2CO(g)=2C(s)+O2(g) △H=+220.8kJ/mol
④2C(s)+2O2(g)=2CO2(g) △H=-787kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是
(2)H2的燃烧热为
(3)燃烧10gH2生成液态水,放出的热量为
(4)C(s)的燃烧热的热化学方程式为
(5)已知:1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6kJ的热量,由此推知H2SO4与NaOH发生中和反应,写出该中和热的热化学方程式为
Ⅱ.已知:工业上制二甲醚是在一定温度(230~280℃)、压强(2.0~10.0MPa)和催化剂作用下进行的,反应器中发生了下列反应:
CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.7kJ·mol-1 ①
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1 ②
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 ③
(6)反应器中的总反应可表示为3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g),计算该反应的ΔH=
您最近一年使用:0次
8 . 下列各组物质的燃烧热相等的是
| A.碳和一氧化碳 | B.1moL 和2moL 和2moL |
C.3moL 和1moL 和1moL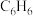 | D.淀粉和纤维素 |
您最近一年使用:0次
名校
解题方法
9 .  在
在 、101kP下,1g硫粉完全燃烧放出9kJ的热量,写出表示该反应燃烧热的热化学方程式为
、101kP下,1g硫粉完全燃烧放出9kJ的热量,写出表示该反应燃烧热的热化学方程式为___________
 和
和 通过灼热的炭层,生成HCl和
通过灼热的炭层,生成HCl和 ,当有2mol电子转移时反应释放出145kJ热量,写出该反应的热化学方程式:
,当有2mol电子转移时反应释放出145kJ热量,写出该反应的热化学方程式:___________ 。
 已知拆开
已知拆开 键,
键,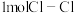 键,
键,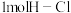 键,分别需要的能量是436kJ、243kJ、431kJ,则
键,分别需要的能量是436kJ、243kJ、431kJ,则 与
与 反应生成HCl的热化学方程式为
反应生成HCl的热化学方程式为 ___________ 。
 已知:
已知: ,
,
写出碳和氧气生成一氧化碳的热化学方程式:___________
 同一反应的生成物状态不同时反应热不同,如
同一反应的生成物状态不同时反应热不同,如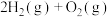 =
= ①,
①,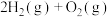 =
= ②,则
②,则
___________  填“
填“ ”、“
”、“ ”或“
”或“ ”,下同
”,下同 。
。
 在
在 、101kP下,1g硫粉完全燃烧放出9kJ的热量,写出表示该反应燃烧热的热化学方程式为
、101kP下,1g硫粉完全燃烧放出9kJ的热量,写出表示该反应燃烧热的热化学方程式为 和
和 通过灼热的炭层,生成HCl和
通过灼热的炭层,生成HCl和 ,当有2mol电子转移时反应释放出145kJ热量,写出该反应的热化学方程式:
,当有2mol电子转移时反应释放出145kJ热量,写出该反应的热化学方程式: 已知拆开
已知拆开 键,
键,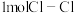 键,
键,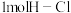 键,分别需要的能量是436kJ、243kJ、431kJ,则
键,分别需要的能量是436kJ、243kJ、431kJ,则 与
与 反应生成HCl的热化学方程式为
反应生成HCl的热化学方程式为  已知:
已知: ,
,
写出碳和氧气生成一氧化碳的热化学方程式:
 同一反应的生成物状态不同时反应热不同,如
同一反应的生成物状态不同时反应热不同,如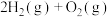 =
= ①,
①,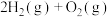 =
= ②,则
②,则
 填“
填“ ”、“
”、“ ”或“
”或“ ”,下同
”,下同 。
。
您最近一年使用:0次
2020-12-23更新
|
218次组卷
|
2卷引用:福建师范大学第二附属中学2019-2020学年高二上学期期中考试化学(选考)试题
10 . 0.5 mol CH4完全燃烧生成CO2和H2O时,放出445 kJ的热量,写出CH4燃烧热的热化学方程式:___________ 。
您最近一年使用:0次



