名校
解题方法
1 . 甲醇是一种重要的基础化工原料,也是一种很有前景的燃料。利用工业废气中的CO2、CO与H2反应都可以制得甲醇。某温度下,在一恒容密闭容器中进行反应:CO(g)+2H2 (g) CH3OH(g) △H=−90.14kJ·mol−l
CH3OH(g) △H=−90.14kJ·mol−l
1.该反应平衡常数的表达式为_____ 。
2.若压强、投料比对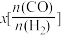 的百分含量的影响如图所示。则图中曲线所示的压强关系:p1_____p2。
的百分含量的影响如图所示。则图中曲线所示的压强关系:p1_____p2。
3.若反应各物质起始浓度分别为c(CO)=1.0mol·L−l,c(H2)=2.4mol·L−l,5min后达到平衡,[CO]=0.5mol·L−l,则5min内H2的平均反应速率为_____ 。
4.若反应物的起始浓度分别为c(CO)=4.0mol·L−l,c(H2)=amol·L−l,达平衡后[CH3OH]=2.0mol·L−l,a=_____ 。
5.下列能说明该反应达到平衡状态的是
6.利用CO2和H2的混合气在催化剂M存在的条件下制甲醇的催化过程如图所示,反应物、产物均为气态物质。若生成1molCH3OH放出热量48.97kJ。写出其反应的热化学方程式:_____ 。 CO(g)+H2O(g),其△H=
CO(g)+H2O(g),其△H=_____ kJ·mol−l,则从化学反应的自发性角度分析,温度应控制在_____ (填“高温”或“低温”)下才有利于主反应进行。
 CH3OH(g) △H=−90.14kJ·mol−l
CH3OH(g) △H=−90.14kJ·mol−l1.该反应平衡常数的表达式为
2.若压强、投料比对
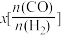 的百分含量的影响如图所示。则图中曲线所示的压强关系:p1_____p2。
的百分含量的影响如图所示。则图中曲线所示的压强关系:p1_____p2。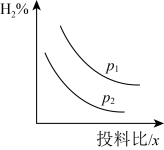
| A.> | B.< | C.= | D.无法确定 |
4.若反应物的起始浓度分别为c(CO)=4.0mol·L−l,c(H2)=amol·L−l,达平衡后[CH3OH]=2.0mol·L−l,a=
5.下列能说明该反应达到平衡状态的是
| A.容器内气体压强不再改变 |
| B.容器内气体密度不再改变 |
| C.c(H2)与c(CH3OH)的比值保持不变 |
| D.单位时间内有2molH2消耗的同时有1molCH3OH生成 |
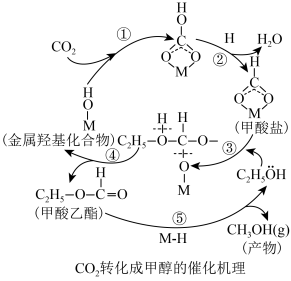
 CO(g)+H2O(g),其△H=
CO(g)+H2O(g),其△H=
您最近一年使用:0次
名校
解题方法
2 . 已知, 生产甲醇过程主要发生以下反应:
生产甲醇过程主要发生以下反应:
反应I.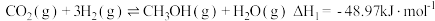
反应II.
反应III.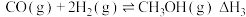
(1)反应III中, H=
H=_____________  ,该反应在
,该反应在_______ 条件下能自发进行。
A.在低温条件下自发进行 B.在高温条件下自发进行
C.在任何条件下都能自发进行 D.在任何条件下都不能自发进行
(2)反应III中, 的平衡转化率与温度的关系如图所示:
的平衡转化率与温度的关系如图所示: 两点压强大小关系是pA
两点压强大小关系是pA_____________ pB(填“ 、
、 、
、 ”)。
”)。
② 三点平衡常数
三点平衡常数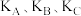 的大小关系为
的大小关系为_____________ 。 时,由D点到A点过程中正、逆反应速率之间的关系:v正
时,由D点到A点过程中正、逆反应速率之间的关系:v正_____________ v逆。(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
(3)完成下列问题。
①向某恒温恒压密闭容器中充入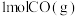 和
和 ,下列能说明反应III达到平衡的是
,下列能说明反应III达到平衡的是_______ 。
A.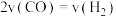
B.两种反应物转化率的比值不再改变
C.容器内混合气体的平均相对分子质量不再改变
D.容器内混合气体的密度不再改变
②在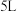 恒容密闭容器中充入
恒容密闭容器中充入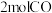 和
和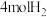 ,在
,在 和
和 条件下经
条件下经 达到平衡状态。在该条件下,v(H2)=
达到平衡状态。在该条件下,v(H2)=_______ 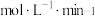 。
。
(4)已知: 的选择性
的选择性 ,不考虑催化剂活性温度,为同时提高
,不考虑催化剂活性温度,为同时提高 的平衡转化率和甲醇的选择性,应选择的反应条件是
的平衡转化率和甲醇的选择性,应选择的反应条件是_______ ,说明其原因_____________________ 。
A.低温低压 B.低温高压 C.高温高压 D.高温低压
 生产甲醇过程主要发生以下反应:
生产甲醇过程主要发生以下反应:反应I.
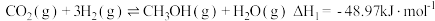
反应II.

反应III.
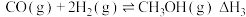
(1)反应III中,
 H=
H= ,该反应在
,该反应在A.在低温条件下自发进行 B.在高温条件下自发进行
C.在任何条件下都能自发进行 D.在任何条件下都不能自发进行
(2)反应III中,
 的平衡转化率与温度的关系如图所示:
的平衡转化率与温度的关系如图所示: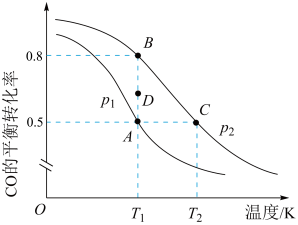
 两点压强大小关系是pA
两点压强大小关系是pA 、
、 、
、 ”)。
”)。②
 三点平衡常数
三点平衡常数 的大小关系为
的大小关系为 时,由D点到A点过程中正、逆反应速率之间的关系:v正
时,由D点到A点过程中正、逆反应速率之间的关系:v正 ”、“
”、“ ”或“
”或“ ”)。
”)。(3)完成下列问题。
①向某恒温恒压密闭容器中充入
 和
和 ,下列能说明反应III达到平衡的是
,下列能说明反应III达到平衡的是A.
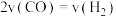
B.两种反应物转化率的比值不再改变
C.容器内混合气体的平均相对分子质量不再改变
D.容器内混合气体的密度不再改变
②在
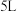 恒容密闭容器中充入
恒容密闭容器中充入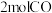 和
和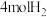 ,在
,在 和
和 条件下经
条件下经 达到平衡状态。在该条件下,v(H2)=
达到平衡状态。在该条件下,v(H2)=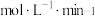 。
。(4)已知:
 的选择性
的选择性 ,不考虑催化剂活性温度,为同时提高
,不考虑催化剂活性温度,为同时提高 的平衡转化率和甲醇的选择性,应选择的反应条件是
的平衡转化率和甲醇的选择性,应选择的反应条件是A.低温低压 B.低温高压 C.高温高压 D.高温低压
您最近一年使用:0次
3 . Ⅰ.甲醇是一种理想的储氢载体,我国科学家研发的全球首套太阳能燃料合成项目被称为“液态阳光”计划,可利用太阳能电解水产生H2,再将CO2与H2转化为甲醇,以实现碳中和。
(1)下列关于甲醇(CH3OH)的说法中,正确的是___________
Ⅱ.已知,CO2生产甲醇过程主要发生以下反应:
反应Ⅰ.CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ∆H1= −48.97kJ·mol−1
CH3OH(g) + H2O(g) ∆H1= −48.97kJ·mol−1
反应Ⅱ.CO2(g) + H2(g) CO(g) + H2O(g) ∆H2= +41.17 kJ·mol−1
CO(g) + H2O(g) ∆H2= +41.17 kJ·mol−1
反应Ⅲ.CO(g) + 2H2(g) CH3OH(g) ∆H3
CH3OH(g) ∆H3
(2)反应Ⅲ中,①活化能E(正)___________ E (逆) (填“>”、“<”或“=”);
②该反应在___________ 条件下能自发进行;
A.在高温条件下自发进行 B.在低温条件下自发进行
C.在任何条件下都能自发进行 D.在任何条件下都不能自发进行
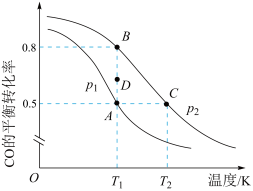
(3)反应III中,CO的平衡转化率与温度的关系如图所示:___________ 。T1时,由D点到B点过程中,正、逆反应速率之间的关系:v正 ___________ v逆。(填“>”、“<”或“=”)
②向某恒温恒压密闭 容器中充入1mol CO(g)和2mol H2(g),下列能说明反应III达到平衡的是___________ ;
A.容器内混合气体的密度不再改变
B.容器内混合气体的平均相对分子质量不再改变
C.两种反应物转化率的比值不再改变
D.v正(CO)=2 v逆(H2)
③在2L恒容密闭 容器中充入2mol CO和4mol H2,在p2和T1条件下经10min达到平衡状态。在该条件下,v(H2)=___________ mol·L−1·min−1。
(4)在CO2加氢合成甲醇的体系中,①下列说法不正确的是___________ ;
A.若在绝热恒容 容器,反应I的平衡常数K保持不变,说明反应I、II都已达平衡
B.若气体的平均相对分子质量不变,说明反应I、II都已达平衡
C.体系达平衡后,若压缩体积,反应I平衡正向移动,反应II平衡不移动
D.选用合适的催化剂可以提高甲醇在单位时间内的产量
②已知:CH3OH的选择性=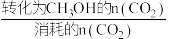 ×100%,不考虑催化剂活性温度,为同时提高CO2的平衡转化率和甲醇的选择性,应选择的反应条件是
×100%,不考虑催化剂活性温度,为同时提高CO2的平衡转化率和甲醇的选择性,应选择的反应条件是___________ ,并说明其原因
A.高温高压 B.高温低压 C.低温低压 D.低温高压
原因:___________
(5)我国科学家设计了离子液体电还原CO2合成CH3OH工艺,写出碱性条件下CO2生成甲醇的电极反应式___________ 。
(1)下列关于甲醇(CH3OH)的说法中,正确的是___________
| A.甲醇在一定条件下可被氧化生成CO2 | B.甲醇储氢符合“相似相溶”原理 |
C.甲醇官能团的电子式: | D.甲醇分子是含有极性键的非极性分子 |
Ⅱ.已知,CO2生产甲醇过程主要发生以下反应:
反应Ⅰ.CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g) ∆H1= −48.97kJ·mol−1
CH3OH(g) + H2O(g) ∆H1= −48.97kJ·mol−1 反应Ⅱ.CO2(g) + H2(g)
 CO(g) + H2O(g) ∆H2= +41.17 kJ·mol−1
CO(g) + H2O(g) ∆H2= +41.17 kJ·mol−1反应Ⅲ.CO(g) + 2H2(g)
 CH3OH(g) ∆H3
CH3OH(g) ∆H3(2)反应Ⅲ中,①活化能E(正)
②该反应在
A.在高温条件下自发进行 B.在低温条件下自发进行
C.在任何条件下都能自发进行 D.在任何条件下都不能自发进行
(3)反应III中,CO的平衡转化率与温度的关系如图所示:
②向某
A.容器内混合气体的密度不再改变
B.容器内混合气体的平均相对分子质量不再改变
C.两种反应物转化率的比值不再改变
D.v正(CO)=2 v逆(H2)
③在2L
(4)在CO2加氢合成甲醇的体系中,①下列说法不正确的是
A.若在
B.若气体的平均相对分子质量不变,说明反应I、II都已达平衡
C.体系达平衡后,若压缩体积,反应I平衡正向移动,反应II平衡不移动
D.选用合适的催化剂可以提高甲醇在单位时间内的产量
②已知:CH3OH的选择性=
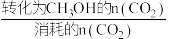 ×100%,不考虑催化剂活性温度,为同时提高CO2的平衡转化率和甲醇的选择性,应选择的反应条件是
×100%,不考虑催化剂活性温度,为同时提高CO2的平衡转化率和甲醇的选择性,应选择的反应条件是A.高温高压 B.高温低压 C.低温低压 D.低温高压
原因:
(5)我国科学家设计了离子液体电还原CO2合成CH3OH工艺,写出碱性条件下CO2生成甲醇的电极反应式
您最近一年使用:0次
名校
解题方法
4 . 尿素[CO(NH2)2]是一种重要的氮肥。工业上以CO2和NH3为原料合成尿素,在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g) H2NCOONH4(s)(氨基甲酸铵) △H1=-272kJ•mol-1
H2NCOONH4(s)(氨基甲酸铵) △H1=-272kJ•mol-1
反应II:H2NCOONH4(s) CO(NH2)2(s)+H2O(g) △H2=+138kJ•mol-1
CO(NH2)2(s)+H2O(g) △H2=+138kJ•mol-1
总反应III:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) △H3
CO(NH2)2(s)+H2O(g) △H3
(1)反应I的熵变△S______ 0(填“>”“=”或“<”),反应III的△H3=______ 。
(2)下列关于尿素合成的说法正确的是______ 。
研究反应I的逆反应对提高尿素产率有重要意义。某研究学习小组把一定量的氨基甲酸铵固体放入容积为2L的密闭容器中,在T℃下分解:CO(NH2)2(s) 2NH3(g)+CO2(g),t1时达到化学平衡。c(CO2)随时间t变化曲线如图所示。
2NH3(g)+CO2(g),t1时达到化学平衡。c(CO2)随时间t变化曲线如图所示。______ 。
(4)T℃时,该反应的化学平衡常数K的值为_______ 。
(5)在0—t1时间内该化学反应速率v(NH3)=______ 。
(6)若其他条件不变,t2时将容器体积压缩到1L,t3时达到新的平衡。请在图中画出t2~t4时间内c(CO2)随时间t变化的曲线______ 。
反应I:2NH3(g)+CO2(g)
 H2NCOONH4(s)(氨基甲酸铵) △H1=-272kJ•mol-1
H2NCOONH4(s)(氨基甲酸铵) △H1=-272kJ•mol-1反应II:H2NCOONH4(s)
 CO(NH2)2(s)+H2O(g) △H2=+138kJ•mol-1
CO(NH2)2(s)+H2O(g) △H2=+138kJ•mol-1总反应III:2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) △H3
CO(NH2)2(s)+H2O(g) △H3(1)反应I的熵变△S
(2)下列关于尿素合成的说法正确的是
| A.及时分离出尿素可促使反应II向正反应方向移动 |
| B.从合成塔出来的混合气体分离出水蒸气后可以循环使用 |
| C.保持容积不变,充入惰性气体增大压强,可提高总反应Ⅲ的反应速率 |
D.保持压强不变,降低氨碳比[ ]可提高反应I中NH3的平衡转化率 ]可提高反应I中NH3的平衡转化率 |
研究反应I的逆反应对提高尿素产率有重要意义。某研究学习小组把一定量的氨基甲酸铵固体放入容积为2L的密闭容器中,在T℃下分解:CO(NH2)2(s)
 2NH3(g)+CO2(g),t1时达到化学平衡。c(CO2)随时间t变化曲线如图所示。
2NH3(g)+CO2(g),t1时达到化学平衡。c(CO2)随时间t变化曲线如图所示。
| A.混合气体的平均摩尔质量不变 | B.密闭容器中总压强不变 |
| C.密闭容器中混合气体的密度不变 | D.密闭容器中氨气的体积分数不变 |
(4)T℃时,该反应的化学平衡常数K的值为
(5)在0—t1时间内该化学反应速率v(NH3)=
(6)若其他条件不变,t2时将容器体积压缩到1L,t3时达到新的平衡。请在图中画出t2~t4时间内c(CO2)随时间t变化的曲线
您最近一年使用:0次
名校
解题方法
5 . 合成氨是目前转化空气中氮最有效的工业方法,其反应历程和能量变化的简图如图:(图中ad表示物质吸附在催化剂表面时的状态) 2NH3(g)的△H=
2NH3(g)的△H=______ kJ•mol-1,对总反应速率影响较大的是步骤_______ 。(填写编号)
(2)若改变某一条件,使合成氨的化学反应速率加快,下列解释正确的是_______ 。
(3)下列关于硫酸工业和合成氨工业说法错误的是_______ 。
合成氨厂的CO2可用于合成重要化工原料CH3OH,主要反应为:3H2(g)+CO2(g) CH3OH(g)+H2O(g)。向两个容积固定为2L的密闭容器中分别充入比例相同,但总量不同的H2和CO2气体,H2的平衡转化率与初始充入物质的量(n)、反应温度(T)的关系如图所示。
CH3OH(g)+H2O(g)。向两个容积固定为2L的密闭容器中分别充入比例相同,但总量不同的H2和CO2气体,H2的平衡转化率与初始充入物质的量(n)、反应温度(T)的关系如图所示。_______ mol•L-1•min-1。
(5)由图可判断该反应是_______ (选填“吸热”或“放热”)反应,在______ (填“较高”或“较低”)温度下有利于该反应自发进行。
(6)判断图中n1、n2相对大小:n1______ n2。(选填“<”或“>”)
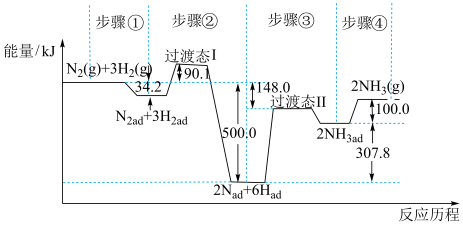
 2NH3(g)的△H=
2NH3(g)的△H=(2)若改变某一条件,使合成氨的化学反应速率加快,下列解释正确的是
| A.升高温度,使单位体积内活化分子百分数增加 |
| B.增加反应物的浓度,使活化分子百分数增加 |
| C.使用催化剂,能降低反应活化能,使单位体积内活化分子数增加 |
| D.增大压强,能降低反应的活化能,使单位体积内活化分子数增加 |
(3)下列关于硫酸工业和合成氨工业说法错误的是
| A.都采用了高压 | B.都使用了催化剂 |
| C.生产流程中都有造气和净化 | D.都使用了热交换器 |
合成氨厂的CO2可用于合成重要化工原料CH3OH,主要反应为:3H2(g)+CO2(g)
 CH3OH(g)+H2O(g)。向两个容积固定为2L的密闭容器中分别充入比例相同,但总量不同的H2和CO2气体,H2的平衡转化率与初始充入物质的量(n)、反应温度(T)的关系如图所示。
CH3OH(g)+H2O(g)。向两个容积固定为2L的密闭容器中分别充入比例相同,但总量不同的H2和CO2气体,H2的平衡转化率与初始充入物质的量(n)、反应温度(T)的关系如图所示。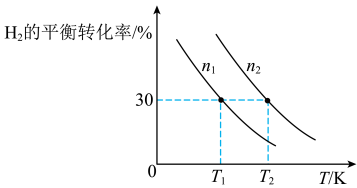
(5)由图可判断该反应是
(6)判断图中n1、n2相对大小:n1
您最近一年使用:0次
名校
解题方法
6 . 反应I可用于在国际空间站中处理二氧化碳,同时伴有副反应II发生。
主反应I: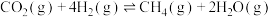
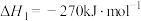
副反应II: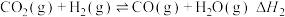
(1)几种化学键的键能如表所示:
表中
___________ 。
(2)为了进一步研究上述两个反应,某小组在三个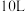 的刚性容器中,分别充入
的刚性容器中,分别充入 和
和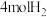 ,在三种不同实验条件(见下表)下进行两个反应,反应体系的总压强(p)随时间变化情况如图所示:
,在三种不同实验条件(见下表)下进行两个反应,反应体系的总压强(p)随时间变化情况如图所示:
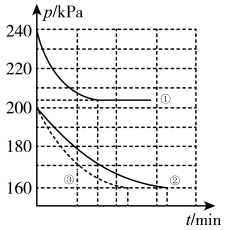
①T1___________ T2 (选填编号)。
a.大于 b.等于 c.小于 d.无法确定
②曲线(3)对应的实验编号是___________ (选填编号)。
a.1 b.2 c.3 d.无法确定
③若在曲线II的条件下, 达到平衡时生成
达到平衡时生成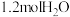 ,则
,则 内反应的平均速率
内反应的平均速率
___________  ,计算出反应II的平衡常数
,计算出反应II的平衡常数
___________ (用最简分式表示)。
(3)在一定条件下反应I存在: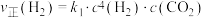 或
或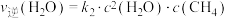 ,反应I的平衡常数
,反应I的平衡常数
___________ (用含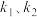 的代数式表示)。
的代数式表示)。
(4)向一定量久置的氢氧化钠溶液中通入二氧化碳,可以使用酸碱指示剂确定溶液的酸碱性。请写出下列指示剂的变色范围:甲基橙:___________ ;酚酞:___________ 。
主反应I:
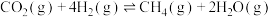
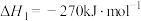
副反应II:
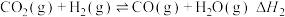
(1)几种化学键的键能如表所示:
| 化学键 |  |  |  |  |
键能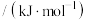 | 413 | 436 | 463 |  |

(2)为了进一步研究上述两个反应,某小组在三个
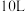 的刚性容器中,分别充入
的刚性容器中,分别充入 和
和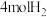 ,在三种不同实验条件(见下表)下进行两个反应,反应体系的总压强(p)随时间变化情况如图所示:
,在三种不同实验条件(见下表)下进行两个反应,反应体系的总压强(p)随时间变化情况如图所示:| 实验编号 | 1 | 2 | 3 |
温度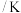 |  |  |  |
催化剂比表面积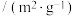 | 80 | 120 | 120 |

①T1
a.大于 b.等于 c.小于 d.无法确定
②曲线(3)对应的实验编号是
a.1 b.2 c.3 d.无法确定
③若在曲线II的条件下,
 达到平衡时生成
达到平衡时生成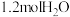 ,则
,则 内反应的平均速率
内反应的平均速率
 ,计算出反应II的平衡常数
,计算出反应II的平衡常数
(3)在一定条件下反应I存在:
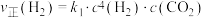 或
或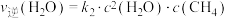 ,反应I的平衡常数
,反应I的平衡常数
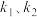 的代数式表示)。
的代数式表示)。(4)向一定量久置的氢氧化钠溶液中通入二氧化碳,可以使用酸碱指示剂确定溶液的酸碱性。请写出下列指示剂的变色范围:甲基橙:
您最近一年使用:0次
名校
7 . Ⅰ.亚硫酰氯( )又称氯化亚砜,沸点
)又称氯化亚砜,沸点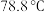 ,遇水强烈水解,是一种重要的脱水剂。
,遇水强烈水解,是一种重要的脱水剂。
(1) 属于___________。
属于___________。
(2)已知 分子中S为中心原子,其中心原子的杂化方式和分子结构分别为___________。
分子中S为中心原子,其中心原子的杂化方式和分子结构分别为___________。
(3) 的两种水解产物均是有刺激性气味的气体,其中一种产物属于强电解质。写出该产物分子的电子式
的两种水解产物均是有刺激性气味的气体,其中一种产物属于强电解质。写出该产物分子的电子式___________ 。检验另一产物的实验方法为___________ 。
(4) 作脱水剂时可使含结晶水的盐变成无水盐。设计简单实验证明其脱水性
作脱水剂时可使含结晶水的盐变成无水盐。设计简单实验证明其脱水性___________ 。
Ⅱ.工业上利用尾气 与
与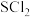 、反应合成氯化亚砜。发生如下反应:
、反应合成氯化亚砜。发生如下反应:
 反应①
反应①
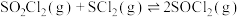 反应②
反应②
 时,在
时,在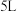 密闭容器中,充入一定量的、
密闭容器中,充入一定量的、 和
和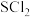 ,测得初始压强为p0,反应过程中容器内总压强(p)随时间(t)变化如下图所示,起始各组分及达平衡时
,测得初始压强为p0,反应过程中容器内总压强(p)随时间(t)变化如下图所示,起始各组分及达平衡时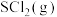 的物质的量如下表。
的物质的量如下表。
(5)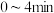 内,二氯亚砜的平均反应速率
内,二氯亚砜的平均反应速率
___________  。
。 时
时 的转化率为
的转化率为___________ 。
(6) 时,上述反应②的
时,上述反应②的
___________ 。
 )又称氯化亚砜,沸点
)又称氯化亚砜,沸点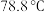 ,遇水强烈水解,是一种重要的脱水剂。
,遇水强烈水解,是一种重要的脱水剂。(1)
 属于___________。
属于___________。| A.分子晶体 | B.离子晶体 | C.共价晶体 | D.金属晶体 |
 分子中S为中心原子,其中心原子的杂化方式和分子结构分别为___________。
分子中S为中心原子,其中心原子的杂化方式和分子结构分别为___________。A. ,角形 ,角形 | B. ,三角锥形 ,三角锥形 |
C. ,平面三角形 ,平面三角形 | D. ,四面体形 ,四面体形 |
 的两种水解产物均是有刺激性气味的气体,其中一种产物属于强电解质。写出该产物分子的电子式
的两种水解产物均是有刺激性气味的气体,其中一种产物属于强电解质。写出该产物分子的电子式(4)
 作脱水剂时可使含结晶水的盐变成无水盐。设计简单实验证明其脱水性
作脱水剂时可使含结晶水的盐变成无水盐。设计简单实验证明其脱水性Ⅱ.工业上利用尾气
 与
与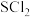 、反应合成氯化亚砜。发生如下反应:
、反应合成氯化亚砜。发生如下反应: 反应①
反应①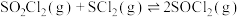 反应②
反应② 时,在
时,在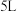 密闭容器中,充入一定量的、
密闭容器中,充入一定量的、 和
和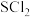 ,测得初始压强为p0,反应过程中容器内总压强(p)随时间(t)变化如下图所示,起始各组分及达平衡时
,测得初始压强为p0,反应过程中容器内总压强(p)随时间(t)变化如下图所示,起始各组分及达平衡时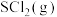 的物质的量如下表。
的物质的量如下表。
| 物质 |  |  | 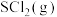 | 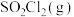 |  |
起始 | 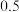 | 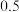 | 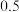 | 0 | 0 |
平衡 | 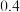 |
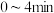 内,二氯亚砜的平均反应速率
内,二氯亚砜的平均反应速率
 。
。 时
时 的转化率为
的转化率为(6)
 时,上述反应②的
时,上述反应②的
您最近一年使用:0次
名校
解题方法
8 . 尿素是一种很好用的保湿成分,它存在于肌肤的角质层当中,属于肌肤天然保湿因子NMF的主要成分。工业上以氨气和二氧化碳为原料合成尿素,反应分为如下两步:
反应①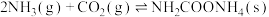
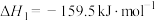
反应②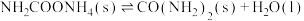

(1)下列反应与反应②的热效应相同的是___________。
(2)下图能表示上述两步反应能量变化的是___________。
(3)恒温恒容时,将2mol 和1mol
和1mol  充入2L反应器中合成尿素,经10min测得反应器内气体压强变为起始的80%(已知此时尿素为固态。水为液态),则从反应开始至10min时,
充入2L反应器中合成尿素,经10min测得反应器内气体压强变为起始的80%(已知此时尿素为固态。水为液态),则从反应开始至10min时, 的平均反应速率
的平均反应速率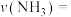
___________ (写出计算过程)。
(4)若将2mol 和1mol
和1mol  充入一容积可变的容器中进行,初始体积固定为V,10min后达到平衡时,
充入一容积可变的容器中进行,初始体积固定为V,10min后达到平衡时, 随时间变化如图所示:
随时间变化如图所示:
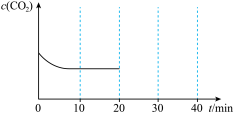
20min时压缩容器,使体积变为0.5V并保持不变,30min时达到新平衡,请在图中大致画出20min~40min内 随时间t变化的曲线
随时间t变化的曲线___________ 。
(5)实际生产中,为节约成本并提高反应②的生产效率,尿素合成工厂通常将反应②的发生场所设置在反应①的发生场所附近,请说明理由:___________ 。
反应①
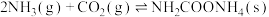
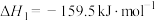
反应②
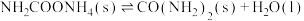

(1)下列反应与反应②的热效应相同的是___________。
| A.木炭与高温水蒸气反应 | B.镁条与稀盐酸反应 |
| C.小苏打与柠檬酸钠反应 | D.氢气与氯气反应 |
(2)下图能表示上述两步反应能量变化的是___________。
A.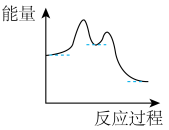 | B.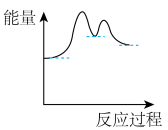 | C. | D.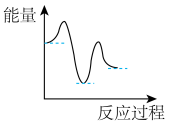 |
(3)恒温恒容时,将2mol
 和1mol
和1mol  充入2L反应器中合成尿素,经10min测得反应器内气体压强变为起始的80%(已知此时尿素为固态。水为液态),则从反应开始至10min时,
充入2L反应器中合成尿素,经10min测得反应器内气体压强变为起始的80%(已知此时尿素为固态。水为液态),则从反应开始至10min时, 的平均反应速率
的平均反应速率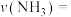
(4)若将2mol
 和1mol
和1mol  充入一容积可变的容器中进行,初始体积固定为V,10min后达到平衡时,
充入一容积可变的容器中进行,初始体积固定为V,10min后达到平衡时, 随时间变化如图所示:
随时间变化如图所示:
20min时压缩容器,使体积变为0.5V并保持不变,30min时达到新平衡,请在图中大致画出20min~40min内
 随时间t变化的曲线
随时间t变化的曲线(5)实际生产中,为节约成本并提高反应②的生产效率,尿素合成工厂通常将反应②的发生场所设置在反应①的发生场所附近,请说明理由:
您最近一年使用:0次
9 . Ⅰ.1909年哈伯在实验室中首次利用氮气与氧气反应合成氨,实现了人工固氮。
(1)一定条件下,氨的平衡含量如下表,哈伯选用的条件是550℃、10MPa,而非200℃、10MPa,主要原因是____________
Ⅱ.在其它条件不变时,不同温度(200℃、400℃、600℃)、压强下,平衡混合物中 的物质的量分数的变化情况如下图所示:
的物质的量分数的变化情况如下图所示:
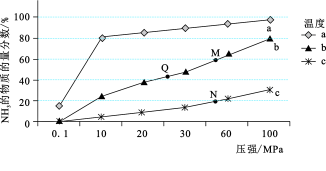
(2)曲线a对应的温度是___________ ;M、N、Q点平衡常数K的大小关系是___________ 。
Ⅲ.最新“人工固氮”的研究报道:常温常压、光照条件下, 在催化剂表面与某物质发生反应,相应的平衡常数表达式为
在催化剂表面与某物质发生反应,相应的平衡常数表达式为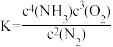 。
。
(3)写出上述反应的化学方程式___________ 。
(4)已知该反应的平衡常数K与温度的关系如图,则此反应的正反应___________ 。(填“吸热“放热”或“不能确定”)
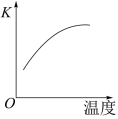
(5)常温下,如果上述反应在体积不变的密闭容器发生,当反应达到平衡时,下列描述正确的是___________。
Ⅳ.工业上,在催化剂条件下,用 作为还原剂将烟气中的
作为还原剂将烟气中的 还原成无害的氮气和水,反应方程式可表示为:
还原成无害的氮气和水,反应方程式可表示为: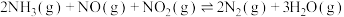 。
。
(6)一定条件下,在容积为 的密闭容器内反应,
的密闭容器内反应, 时达到平衡,生成
时达到平衡,生成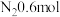 ,则平均反应速率
,则平均反应速率
___________ 。
(7) 的平衡转化率
的平衡转化率 与反应温度
与反应温度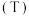 和压强
和压强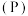 的关系如下图所示,根据图像判断:
的关系如下图所示,根据图像判断: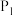
___________ 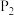 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(8)温度不变,将容器体积压缩至原来的一半,再次达到新平衡, 的浓度为原来的1.6倍,此时
的浓度为原来的1.6倍,此时 的体积分数相比原平衡状态下
的体积分数相比原平衡状态下___________ 。(填“增大”、“减小”或“保持不变”)
(9)体系的颜色变化能否作为判断上述反应达到平衡的依据,并说明其理由是___________ 。
(1)一定条件下,氨的平衡含量如下表,哈伯选用的条件是550℃、10MPa,而非200℃、10MPa,主要原因是
| 温度/℃ | 压强 | 氨的平衡含量 |
| 200 | 10 |  |
| 550 | 10 |  |
Ⅱ.在其它条件不变时,不同温度(200℃、400℃、600℃)、压强下,平衡混合物中
 的物质的量分数的变化情况如下图所示:
的物质的量分数的变化情况如下图所示:
(2)曲线a对应的温度是
Ⅲ.最新“人工固氮”的研究报道:常温常压、光照条件下,
 在催化剂表面与某物质发生反应,相应的平衡常数表达式为
在催化剂表面与某物质发生反应,相应的平衡常数表达式为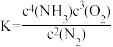 。
。(3)写出上述反应的化学方程式
(4)已知该反应的平衡常数K与温度的关系如图,则此反应的正反应

(5)常温下,如果上述反应在体积不变的密闭容器发生,当反应达到平衡时,下列描述正确的是___________。
| A.容器中气体的平均分子量不随时间而变化 |
B.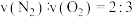 |
| C.容器中气体的密度不随时间而变化 |
| D.再次通入稀有气体,平衡逆向移动 |
Ⅳ.工业上,在催化剂条件下,用
 作为还原剂将烟气中的
作为还原剂将烟气中的 还原成无害的氮气和水,反应方程式可表示为:
还原成无害的氮气和水,反应方程式可表示为: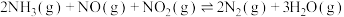 。
。(6)一定条件下,在容积为
 的密闭容器内反应,
的密闭容器内反应, 时达到平衡,生成
时达到平衡,生成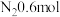 ,则平均反应速率
,则平均反应速率
(7)
 的平衡转化率
的平衡转化率 与反应温度
与反应温度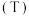 和压强
和压强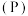 的关系如下图所示,根据图像判断:
的关系如下图所示,根据图像判断: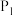
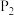 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(8)温度不变,将容器体积压缩至原来的一半,再次达到新平衡,
 的浓度为原来的1.6倍,此时
的浓度为原来的1.6倍,此时 的体积分数相比原平衡状态下
的体积分数相比原平衡状态下(9)体系的颜色变化能否作为判断上述反应达到平衡的依据,并说明其理由是
您最近一年使用:0次
名校
10 . 室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:① ;②
;② 。反应体系中组分M、Z的浓度随时间变化情况如图所示。
。反应体系中组分M、Z的浓度随时间变化情况如图所示。
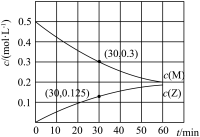
(1) 时间段内,
时间段内, 的平均反应速率为
的平均反应速率为___________ 。
(2)其中,反应①的速率可以表示为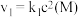 ,反应②的速率可以表示为
,反应②的速率可以表示为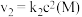 (
(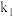 、
、 为速率常数)。下列说法正确的是___________。
为速率常数)。下列说法正确的是___________。
 ;②
;② 。反应体系中组分M、Z的浓度随时间变化情况如图所示。
。反应体系中组分M、Z的浓度随时间变化情况如图所示。
(1)
 时间段内,
时间段内, 的平均反应速率为
的平均反应速率为(2)其中,反应①的速率可以表示为
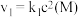 ,反应②的速率可以表示为
,反应②的速率可以表示为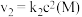 (
(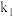 、
、 为速率常数)。下列说法正确的是___________。
为速率常数)。下列说法正确的是___________。A.反应开始后,系统中 和 和 的浓度之比保持不变 的浓度之比保持不变 |
B.如果反应能进行到底,则反应结束时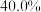 的M能转化为 的M能转化为 |
C.该温度下,两个反应的 与 与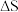 一定都小于0 一定都小于0 |
D.该温度下,两个反应 |
您最近一年使用:0次



