1 . 完成下列问题。
(1)化学键的键能是形成(或断裂)1 mol化学键时释放(或吸收)的能量。以下是部分共价键键能的数据:H-S:364 kJ·mol-1,S-S:266 kJ·mol-1,S=O:522 kJ·mol-1,H-O:463 kJ·mol-1,试根据这些数据计算下列反应的反应热:2H2S(g)+SO2(g)= 3S(s)+2H2O(l) ΔH=-Q kJ·mol-1,反应产物中的S实为S8,实际分子是一个八元环状分子(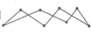 ),则Q=
),则Q=______ 。
(2)已知反应aA(g)+bB(g) cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物的量浓度随时间变化的曲线如图所示。_____ 。
②经测定,前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为______ 。
③若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L-1·s-1,乙:v(B)=0.12 mol·L-1·s-1,丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为_______ 。
(3)向某容积不变的密闭容器中充入一定量的NO2,发生反应2NO2(g) N2O4(g) ΔH<0,达到平衡后,若分别单独改变下列条件,下列判断正确的是_____。
N2O4(g) ΔH<0,达到平衡后,若分别单独改变下列条件,下列判断正确的是_____。
(4)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应:
Ⅰ.CH4(g)+H2O(g) CO(g)+3H2(g) Ⅱ.CO(g)+H2O(g)
CO(g)+3H2(g) Ⅱ.CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
①下列操作中,能提高CH4(g)平衡转化率的是____ (填标号)。
A.增加CH4 (g)用量 B.恒温恒压下通入惰性气体
C.移除CO(g) D.加入催化剂
②恒温恒压条件下,1 mol CH4 (g)和1 mol H2O(g)反应达平衡时,CH4 (g)的转化率为α,CO2(g)的物质的量为b mol,则反应Ⅰ的平衡常数Kx=____ [写出含有α、b的计算式;对于反应mA(g)+nB(g) pC(g)+qD(g),Kx=
pC(g)+qD(g),Kx=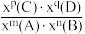 ,x为物质的量分数]。
,x为物质的量分数]。
(1)化学键的键能是形成(或断裂)1 mol化学键时释放(或吸收)的能量。以下是部分共价键键能的数据:H-S:364 kJ·mol-1,S-S:266 kJ·mol-1,S=O:522 kJ·mol-1,H-O:463 kJ·mol-1,试根据这些数据计算下列反应的反应热:2H2S(g)+SO2(g)= 3S(s)+2H2O(l) ΔH=-Q kJ·mol-1,反应产物中的S实为S8,实际分子是一个八元环状分子(
 ),则Q=
),则Q=(2)已知反应aA(g)+bB(g)
 cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物的量浓度随时间变化的曲线如图所示。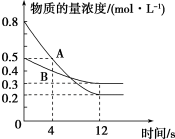
②经测定,前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为
③若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L-1·s-1,乙:v(B)=0.12 mol·L-1·s-1,丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为
(3)向某容积不变的密闭容器中充入一定量的NO2,发生反应2NO2(g)
 N2O4(g) ΔH<0,达到平衡后,若分别单独改变下列条件,下列判断正确的是_____。
N2O4(g) ΔH<0,达到平衡后,若分别单独改变下列条件,下列判断正确的是_____。| A.升高温度,混合气体的颜色变浅 |
| B.通入NO2,化学平衡常数增大 |
| C.通入NO2,重新达到平衡后混合气体的平均相对分子质量增大 |
| D.增大压强,平衡向正反应方向移动,混合气体的颜色变浅 |
Ⅰ.CH4(g)+H2O(g)
 CO(g)+3H2(g) Ⅱ.CO(g)+H2O(g)
CO(g)+3H2(g) Ⅱ.CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)①下列操作中,能提高CH4(g)平衡转化率的是
A.增加CH4 (g)用量 B.恒温恒压下通入惰性气体
C.移除CO(g) D.加入催化剂
②恒温恒压条件下,1 mol CH4 (g)和1 mol H2O(g)反应达平衡时,CH4 (g)的转化率为α,CO2(g)的物质的量为b mol,则反应Ⅰ的平衡常数Kx=
 pC(g)+qD(g),Kx=
pC(g)+qD(g),Kx=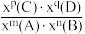 ,x为物质的量分数]。
,x为物质的量分数]。
您最近一年使用:0次
名校
解题方法
2 . 根据化学反应速率和化学反应限度的知识回答下列问题:
Ⅰ.某温度时,在2 L容器中发生A、B两种物质间的转化反应,AB物质的量随时间变化的曲线如图所示:___________ 。
(2)反应开始至4 min时,A的平均反应速率为___________ 。
(3)4 min时,反应是否达平衡状态?___________ (填“是”或“否”),8 min时,v正___________ v逆。(填“>”“<”或“=”)
Ⅱ.氢气是合成氨的重要原料,合成氨反应的化学方程式为N2(g)+3H2(g) ⇌2NH3(g),该反应为放热反应,且每生成2 mol NH3,放出92.4 kJ的热量。当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。___________ 。
(5)在一定温度下,向一个容积为1 L的容器中通入2 mol氮气和
8 mol氢气及固体催化剂,使之反应。已知平衡时容器内气体的压强为起始时的80%。
①N2的转化率为___________ 。
②反应达到平衡时,放出的热量___________ (填字母,下同)。
A.小于92.4 kJ B.等于92.4 kJ
C.大于92.4 kJ D.可能大于、小于或等于92.4 kJ
(6)若该反应在绝热条件下进行,下列能证明反应已达化学平衡的为___________ 。
A.混合气体的平均相对分子质量
B.体系的温度不变
C.N2、H2、NH3的分子数之比为1:3:2
D.混合气体的密度不变
E.断开3 mol H-H键的同时断开2 mol N-H键
(7)反应达到平衡后,保持其他条件不变,t0时刻升高温度,请在图中画出 改变条件后至达到新平衡时v正、v逆的变化曲线并注明v正、v逆(在答题卡做答)__________
Ⅰ.某温度时,在2 L容器中发生A、B两种物质间的转化反应,AB物质的量随时间变化的曲线如图所示:
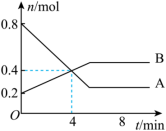
(2)反应开始至4 min时,A的平均反应速率为
(3)4 min时,反应是否达平衡状态?
Ⅱ.氢气是合成氨的重要原料,合成氨反应的化学方程式为N2(g)+3H2(g) ⇌2NH3(g),该反应为放热反应,且每生成2 mol NH3,放出92.4 kJ的热量。当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。

(5)在一定温度下,向一个容积为1 L的容器中通入2 mol氮气和
8 mol氢气及固体催化剂,使之反应。已知平衡时容器内气体的压强为起始时的80%。
①N2的转化率为
②反应达到平衡时,放出的热量
A.小于92.4 kJ B.等于92.4 kJ
C.大于92.4 kJ D.可能大于、小于或等于92.4 kJ
(6)若该反应在绝热条件下进行,下列能证明反应已达化学平衡的为
A.混合气体的平均相对分子质量
B.体系的温度不变
C.N2、H2、NH3的分子数之比为1:3:2
D.混合气体的密度不变
E.断开3 mol H-H键的同时断开2 mol N-H键
(7)反应达到平衡后,保持其他条件不变,t0时刻升高温度,请在图中画出 改变条件后至达到新平衡时v正、v逆的变化曲线并注明v正、v逆(在答题卡做答)

您最近一年使用:0次
2024-04-30更新
|
281次组卷
|
2卷引用:宁夏石嘴山市第三中学2023-2024学年高一下学期4月期中考试化学试题
3 . 化石燃料的燃烧、汽车尾气的排放和硝酸工业尾气中普遍含有的NOx是污染大气的主要成分之一,需要回收处理并加以利用。
(1)为减轻汽车尾气中NO和CO对环境的污染,可在汽车排气管上安装催化转化器,主要发生的反应是:2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH。
N2(g)+2CO2(g) ΔH。
已知断裂1mol相应化学键需要的能量如表:
则ΔH为___________ 。
(2)已知:CH4(g)+4NO2(g)=CO2(g)+2H2O(l)+4NO(g) ΔH=-654kJ·mol-1
CH4(g)+4NO(g)=CO2(g)+2H2O(l)+2N2(g) ΔH=-1240kJ·mol-1
H2O(g)=H2O(l) ΔH=-44kJ·mol-1
CH4将NO2还原为N2并生成水蒸气的热化学方程式为___________ 。
(3)燃煤烟气脱硝的反应之一为 2NO2(g) + 4CO(g) N2(g)+ 4CO2(g),在一定温度下,向2 L恒容密闭容器中充入4. 0 mol NO2,测得相关数据如下:
N2(g)+ 4CO2(g),在一定温度下,向2 L恒容密闭容器中充入4. 0 mol NO2,测得相关数据如下:
0~2 min内该反应的平均速率为v(N2)=___________ , 8分钟时反应达到平衡,则NO2的平衡转化率=___________ ;n值可能为___________ (填字母)。
A.3.2 B.3.36 C.3.3 D.3.1
(4)NH3催化还原氮氧化物技术(SCR)是目前应用最广泛的烟气氮氧化物脱除技术,反应原理如图所示:
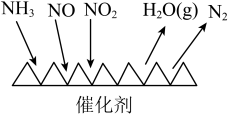
用Fe作催化剂时,在氨气足量的情况下,当c(NO2):c(NO)=1:1时,脱氮率最佳,按最佳脱氮率,每生成2mol N2,转移电子数目为___________ 。
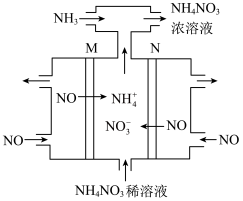
(5)除上述方法外,还可用电解法将NO转变为NH4NO3,其工作原理如下图,N极的电极反应式为___________ ,通入NH3的主要原因是___________ 。
(1)为减轻汽车尾气中NO和CO对环境的污染,可在汽车排气管上安装催化转化器,主要发生的反应是:2NO(g)+2CO(g)
 N2(g)+2CO2(g) ΔH。
N2(g)+2CO2(g) ΔH。已知断裂1mol相应化学键需要的能量如表:
| 化学键 | C≡O | N≡O | N≡N | C=O |
| 键能/(kJ·mol-1) | 1072 | 630 | 946 | 799 |
(2)已知:CH4(g)+4NO2(g)=CO2(g)+2H2O(l)+4NO(g) ΔH=-654kJ·mol-1
CH4(g)+4NO(g)=CO2(g)+2H2O(l)+2N2(g) ΔH=-1240kJ·mol-1
H2O(g)=H2O(l) ΔH=-44kJ·mol-1
CH4将NO2还原为N2并生成水蒸气的热化学方程式为
(3)燃煤烟气脱硝的反应之一为 2NO2(g) + 4CO(g)
 N2(g)+ 4CO2(g),在一定温度下,向2 L恒容密闭容器中充入4. 0 mol NO2,测得相关数据如下:
N2(g)+ 4CO2(g),在一定温度下,向2 L恒容密闭容器中充入4. 0 mol NO2,测得相关数据如下:| 时间 | 0 min | 2 min | 4 min | 6 min | 8min | 10 min |
| n(NO2)/mol | 4.0 | 3.6 | n | 3.1 | 3.0 | 3.0 |
A.3.2 B.3.36 C.3.3 D.3.1
(4)NH3催化还原氮氧化物技术(SCR)是目前应用最广泛的烟气氮氧化物脱除技术,反应原理如图所示:

用Fe作催化剂时,在氨气足量的情况下,当c(NO2):c(NO)=1:1时,脱氮率最佳,按最佳脱氮率,每生成2mol N2,转移电子数目为
(5)除上述方法外,还可用电解法将NO转变为NH4NO3,其工作原理如下图,N极的电极反应式为

您最近一年使用:0次
2024-02-13更新
|
99次组卷
|
2卷引用:宁夏银川市育才中学2023-2024学年高三上学期1月期末理科综合化学试题
4 . 已知:A(g)+3B(g) 2C(g) ΔH<0,有甲乙两个容积为0.5L的密闭容器,向甲中加入1molA和3molB,5min时达到平衡,放出热量为Q1kJ;相同条件下,向乙中加入2molC,达到平衡时吸收热量为Q2kJ。已知Q2=3Q1,下列说法正确的是
2C(g) ΔH<0,有甲乙两个容积为0.5L的密闭容器,向甲中加入1molA和3molB,5min时达到平衡,放出热量为Q1kJ;相同条件下,向乙中加入2molC,达到平衡时吸收热量为Q2kJ。已知Q2=3Q1,下列说法正确的是
 2C(g) ΔH<0,有甲乙两个容积为0.5L的密闭容器,向甲中加入1molA和3molB,5min时达到平衡,放出热量为Q1kJ;相同条件下,向乙中加入2molC,达到平衡时吸收热量为Q2kJ。已知Q2=3Q1,下列说法正确的是
2C(g) ΔH<0,有甲乙两个容积为0.5L的密闭容器,向甲中加入1molA和3molB,5min时达到平衡,放出热量为Q1kJ;相同条件下,向乙中加入2molC,达到平衡时吸收热量为Q2kJ。已知Q2=3Q1,下列说法正确的是| A.甲中达平衡时,用B的浓度变化表示5min内的平均反应速率为0.15 mol・L-1・min-1 |
B.乙中的热化学方程式为2C(g) A(g)+3B(g):ΔH= A(g)+3B(g):ΔH=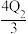 kJ/mol kJ/mol |
| C.乙中达到平衡后,再加入0.25molA、0.75molB、1.5molC,平衡不移动 |
| D.乙中平衡时C的转化率为75% |
您最近一年使用:0次
名校
5 . 已知反应:2NO(g)+2H2(g)  N2(g)+2H2O(g)生成N2的速率与NO、H2的初始浓度的关系为v=kcx(NO)•cy(H2),k为速率常数。在800℃时测得的相关数据如表所示。
N2(g)+2H2O(g)生成N2的速率与NO、H2的初始浓度的关系为v=kcx(NO)•cy(H2),k为速率常数。在800℃时测得的相关数据如表所示。
下列说法中不正确的是
 N2(g)+2H2O(g)生成N2的速率与NO、H2的初始浓度的关系为v=kcx(NO)•cy(H2),k为速率常数。在800℃时测得的相关数据如表所示。
N2(g)+2H2O(g)生成N2的速率与NO、H2的初始浓度的关系为v=kcx(NO)•cy(H2),k为速率常数。在800℃时测得的相关数据如表所示。| 实验数据 | 初始浓度(mol·L-1) | 生成N2的初始速率(mol·L-1·s-1) | |
| c(NO) | c(H2) | ||
| 1 | 2.00×10-3 | 6.00×10-3 | 1.92×10-3 |
| 2 | 1.00×10-3 | 6.00×10-3 | 4.80×10-4 |
| 3 | 2.00×10-3 | 3.00×10-3 | 9.60×10-4 |
| A.关系式中x=2、y=1 |
| B.800℃时,k的值为8×104 |
| C.反应体系的二种物质中,H2(g)的浓度对反应速率影响更大 |
| D.当其他条件不变时,升高温度,速率常数将增大 |
您最近一年使用:0次
名校
6 . 目前我团分别在治理大气污染和新能源使用上都取得长足的进步。
(1)在大气污染治理上,目前我国用甲烷还原氨氧化物NO),使其排放量减少10%。已知:
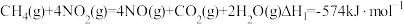

则甲烷直接将NO2还原为N2的热化学方程式为___________ 。
(2)在新能源使用上,正在研究利用甲烷合成甲醇这个清洁能源,该反应为: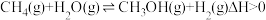 ,将一定量的CH4和一定量H2O(g)通入10L容器中,若改变起始量,CH4的平衡转化率如表所示:
,将一定量的CH4和一定量H2O(g)通入10L容器中,若改变起始量,CH4的平衡转化率如表所示:
①假设100℃时若按甲投料反应达到平衡所需的时间为5min,则用甲烷表示该反应的平均反应速率为___________ mol·L-1min-1。
②在不改变其他外界条件下a1、a2的相对大小顺序为:al___________ a2(填“>” “=”或“<”)。
③欲提高CH4转化率且不改变该反应的平衡常数的方法是___________ (填字母序号)。
A.c(CH4)增大 B.分离出产品CH3OH
C.升高温度 D.容器体积缩小一半
(3)工业上常利用CH4来吸收CO2生成CO和H2,再用H2和CO合成甲醇,如在恒容密闭容器中通入物质的量浓度均为1.0mol/L的CH4与CO2,在一定条件下仅发生反应: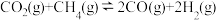 ,测得CH4的平衡转化率与温度及压强的关系如图所示:
,测得CH4的平衡转化率与温度及压强的关系如图所示:
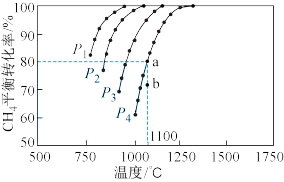
则:①该反应的ΔH___________ (填“<”“=”或“>”)0。
②计算a点的平衡常数K=___________ 。
(1)在大气污染治理上,目前我国用甲烷还原氨氧化物NO),使其排放量减少10%。已知:
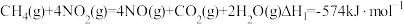

则甲烷直接将NO2还原为N2的热化学方程式为
(2)在新能源使用上,正在研究利用甲烷合成甲醇这个清洁能源,该反应为:
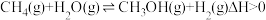 ,将一定量的CH4和一定量H2O(g)通入10L容器中,若改变起始量,CH4的平衡转化率如表所示:
,将一定量的CH4和一定量H2O(g)通入10L容器中,若改变起始量,CH4的平衡转化率如表所示:| 甲 | 乙 | ||
| 起始物质的量 | n(CH4)/mol | 5 | 5 |
| n(H2O)/ mol | 10 | 5 | |
| CH4的平衡转化率/% | a1=50 | a2 | |
②在不改变其他外界条件下a1、a2的相对大小顺序为:al
③欲提高CH4转化率且不改变该反应的平衡常数的方法是
A.c(CH4)增大 B.分离出产品CH3OH
C.升高温度 D.容器体积缩小一半
(3)工业上常利用CH4来吸收CO2生成CO和H2,再用H2和CO合成甲醇,如在恒容密闭容器中通入物质的量浓度均为1.0mol/L的CH4与CO2,在一定条件下仅发生反应:
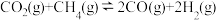 ,测得CH4的平衡转化率与温度及压强的关系如图所示:
,测得CH4的平衡转化率与温度及压强的关系如图所示:
则:①该反应的ΔH
②计算a点的平衡常数K=
您最近一年使用:0次
名校
解题方法
7 . 回答下列问题:
(1)甲醇气相脱水制甲醚的反应为:2CH3OH(g) CH3OCH3(g)+H2O(g),200℃时,向恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,测得CH3OH(g)的浓度随时间(t)的变化如表:
CH3OCH3(g)+H2O(g),200℃时,向恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,测得CH3OH(g)的浓度随时间(t)的变化如表:
①10~30min内,用CH3OCH3(g)表示该反应的平均速率为_______ 。
②该反应在200℃时的平衡常数Kp=_______ (以分压表示,分压=总压×物质的量分数)。
③200℃时,向该容器中投入三种成分的浓度如表:
该时刻,正、逆反应速率的大小关系为:v正(CH3OH)_______ v逆(CH3OH)(填“>”“<”或“=”)
(2)室温下,探究 NH4HCO3溶液的性质。
①室温时,NH4HCO3溶液显_______ (填“酸性”、“碱性”或“中性”)。
②将浓度均为0.1mol/L的NH4HCO3溶液与Ba(OH)2溶液等体积混合,产生白色沉淀和刺激性气味的气体,则白色沉淀的化学式为_______ 。
③向1mol/L的NH4HCO3溶液中加入0.1mol/L的AlCl3溶液,发生剧烈的反应,则反应的现象为_______ 。
(3)由重晶石矿 (主要成分是 , 还含有
, 还含有  等杂质)可制得氯化钡晶体,某兴趣小组设计实验流程如下。
等杂质)可制得氯化钡晶体,某兴趣小组设计实验流程如下。

①浸取将固体由块状变为粉末状,可以加快浸取的速率。将固体由块状变为粉末状的仪器名称为:_______ 。
②为提高产品产率, 结晶得到的氯化钡晶体常用_______ 进行洗涤。
(1)甲醇气相脱水制甲醚的反应为:2CH3OH(g)
 CH3OCH3(g)+H2O(g),200℃时,向恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,测得CH3OH(g)的浓度随时间(t)的变化如表:
CH3OCH3(g)+H2O(g),200℃时,向恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,测得CH3OH(g)的浓度随时间(t)的变化如表:| t/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| c(CH3OH)/(mol•L-1) | 1.00 | 0.65 | 0.50 | 0.36 | 0.27 | 0.20 | 0.20 |
②该反应在200℃时的平衡常数Kp=
③200℃时,向该容器中投入三种成分的浓度如表:
| 物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| c/(mol•L-1) | 0.54 | 0.68 | 0.68 |
(2)室温下,探究 NH4HCO3溶液的性质。
| NH3•H2O | H2CO3 |
| Kb=1.8×10-5 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
②将浓度均为0.1mol/L的NH4HCO3溶液与Ba(OH)2溶液等体积混合,产生白色沉淀和刺激性气味的气体,则白色沉淀的化学式为
③向1mol/L的NH4HCO3溶液中加入0.1mol/L的AlCl3溶液,发生剧烈的反应,则反应的现象为
(3)由重晶石矿 (主要成分是
 , 还含有
, 还含有  等杂质)可制得氯化钡晶体,某兴趣小组设计实验流程如下。
等杂质)可制得氯化钡晶体,某兴趣小组设计实验流程如下。
①浸取将固体由块状变为粉末状,可以加快浸取的速率。将固体由块状变为粉末状的仪器名称为:
②为提高产品产率, 结晶得到的氯化钡晶体常用
您最近一年使用:0次
名校
解题方法
8 . 中国科学家为实现“碳中和”目标而不断努力,以CO2为原料合成甲烷、乙醇等能源物质具有良好的发展前景。
(1)CO2在固体催化剂表面加氢合成甲烷过程中发生以下两个反应:
主反应:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ∆H1= -156.9kJ·mol-1
副反应:CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H2= +41.1kJ·mol-1
①已知2H2+O2(g)⇌2H2O(g) ∆H3= -483.6kJ·mol-1,1mol液态水完全汽化吸收热量44千焦,则CH4燃烧热∆H=_______
②500℃时,向1L恒容密闭容器中充入4mol CO2和12mol H2,初始压强为p,20min时主、副反应都达到平衡状态,测得c(H2O)=2.6mol·L-1,体系压强为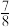 P,则0~20min内,v(CH4)=
P,则0~20min内,v(CH4)= _______ mol·L-1·min-1,平衡时CH4选择性=_______ ( CH4选择性= ×100%,保留3位有效数字),平衡时副反应的Kp=
×100%,保留3位有效数字),平衡时副反应的Kp=_______ (分数表示)。
(2)已知CO2催化加氢合成乙醇的反应为:2CO2(g)+6H2(g)⇌C2H5OH(g)+3H2O(g) ∆H<0,设m为起始时的投料比,即 。
。

①图1中投料比相同,则在T3 、T2、T1中温度最高的为_______ 。
②图2中m1、m2、m3从大到小的顺序为_______ 。
③该反应的Arrhenius经验公式的实验数据如图3中曲线a所示,已知Arhenius经验公式 (Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能Ea=
(Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能Ea=_______ kJ·mol-1。当改变外界条件时,实验数据如图3中的曲线b所示,则实验可能改变的外界条件是_______ 。
(1)CO2在固体催化剂表面加氢合成甲烷过程中发生以下两个反应:
主反应:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ∆H1= -156.9kJ·mol-1
副反应:CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H2= +41.1kJ·mol-1
①已知2H2+O2(g)⇌2H2O(g) ∆H3= -483.6kJ·mol-1,1mol液态水完全汽化吸收热量44千焦,则CH4燃烧热∆H=
②500℃时,向1L恒容密闭容器中充入4mol CO2和12mol H2,初始压强为p,20min时主、副反应都达到平衡状态,测得c(H2O)=2.6mol·L-1,体系压强为
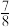 P,则0~20min内,v(CH4)=
P,则0~20min内,v(CH4)=  ×100%,保留3位有效数字),平衡时副反应的Kp=
×100%,保留3位有效数字),平衡时副反应的Kp=(2)已知CO2催化加氢合成乙醇的反应为:2CO2(g)+6H2(g)⇌C2H5OH(g)+3H2O(g) ∆H<0,设m为起始时的投料比,即
 。
。
①图1中投料比相同,则在T3 、T2、T1中温度最高的为
②图2中m1、m2、m3从大到小的顺序为
③该反应的Arrhenius经验公式的实验数据如图3中曲线a所示,已知Arhenius经验公式
 (Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能Ea=
(Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能Ea=
您最近一年使用:0次
名校
解题方法
9 . 25℃时,将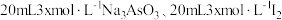 和
和 溶液混合,发生反应:
溶液混合,发生反应: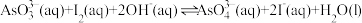 。溶液中
。溶液中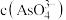 与反应时间
与反应时间 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
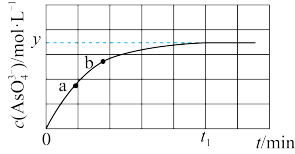
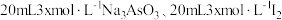 和
和 溶液混合,发生反应:
溶液混合,发生反应: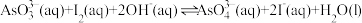 。溶液中
。溶液中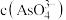 与反应时间
与反应时间 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
A.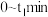 用 用 表示的平均反应速率为 表示的平均反应速率为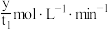 |
B.当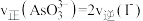 时,反应达到平衡状态 时,反应达到平衡状态 |
| C.a点的逆反应速率小于b点的正反应速率 |
D.平衡时溶液的 ,则该反应的平衡常数 ,则该反应的平衡常数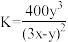 |
您最近一年使用:0次
2022-04-23更新
|
956次组卷
|
10卷引用:宁夏石嘴山市第三中学2022-2023学年高二下学期期末理科化学试题
宁夏石嘴山市第三中学2022-2023学年高二下学期期末理科化学试题浙江省稽阳联谊学校2021-2022学年高三下学期4月联考化学试题(已下线)卷03 小题素养卷-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)(已下线)考点25 化学反应速率与平衡图象-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题10 化学反应速率与平衡-2023年高考化学一轮复习小题多维练(全国通用)河北省石家庄市第二十四中学2021-2022学年高一下学期期末考试化学试题江苏省响水中学2022-2023学年高二(创新班)上学期10月学情分析考试化学试题山东省青岛第十九中学2022-2023学年高二上学期期中考试化学试题湖南省株洲市九方中学2022-2023学年高三上学期第四次月考化学试题(已下线)考点25 化学反应速率与平衡图象(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
解题方法
10 . 碳、氮、硫的化合物在生产生活中广泛存在。请回答:
(1)下列有关碳及其化合物的说法正确的是_______
(2)T温度时在容积为2L的恒容密闭容器中只充入1.00molNO2气体发生反应:2NO(g)+O2(g) 2NO2(g) ∆H<0。不同时刻测得容器中n(NO2)如下表:
2NO2(g) ∆H<0。不同时刻测得容器中n(NO2)如下表:
①升高温度K值_______ (增大、减小),T温度时化学平衡常数K=_______ mol-1·L。
②从0~2s该反应的平均速率v(NO2)=_______ 。
③对可逆反应2NO(g)+O2(g) 2NO2(g) ∆H<0。恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是
2NO2(g) ∆H<0。恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是_______ 。
A.混 合气体的密度不再变化 B.混合气体的压强不再变化
C.氧气的转化率不再变化 D.NO2、O2、NO的物质的量之比为2:1:2
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是_______ (写出主要反应的离子方程式),该溶液中,c(Na+)_______ 2c(SO )+c(HSO
)+c(HSO )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
②在某NaHSO3、Na2SO3混合溶液中HSO 、SO
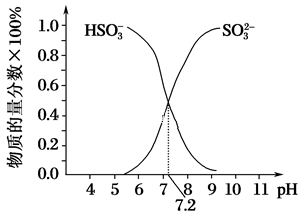
、SO 物质的量分数随pH变化曲线如图所示(部分),根据图示,则SO
物质的量分数随pH变化曲线如图所示(部分),根据图示,则SO 的第一步水解平衡常数=
的第一步水解平衡常数=_______ 。
(1)下列有关碳及其化合物的说法正确的是_______
| A.CO2是导致酸雨的主要气体 |
B.CO2的电子式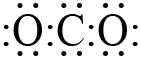 |
| C.金刚石、石墨与C60都是碳的同素异形体 |
| D.在高温条件下,碳能使CO2转变成CO |
 2NO2(g) ∆H<0。不同时刻测得容器中n(NO2)如下表:
2NO2(g) ∆H<0。不同时刻测得容器中n(NO2)如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
①升高温度K值
②从0~2s该反应的平均速率v(NO2)=
③对可逆反应2NO(g)+O2(g)
 2NO2(g) ∆H<0。恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是
2NO2(g) ∆H<0。恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是A.混 合气体的密度不再变化 B.混合气体的压强不再变化
C.氧气的转化率不再变化 D.NO2、O2、NO的物质的量之比为2:1:2
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是
 )+c(HSO
)+c(HSO )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。②在某NaHSO3、Na2SO3混合溶液中HSO
 、SO
、SO 物质的量分数随pH变化曲线如图所示(部分),根据图示,则SO
物质的量分数随pH变化曲线如图所示(部分),根据图示,则SO 的第一步水解平衡常数=
的第一步水解平衡常数=
您最近一年使用:0次



