名校
1 . 丙烯是重要的化工原料,广泛用于合成聚丙烯、丙烯醛等工业领域。回答下列问题:
(1)丙烷无氧脱氢法制备丙烯的反应为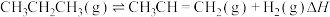 。科学上规定:在298.15K时,由最稳定的单质生成1mol化合物时的焓变,叫作该物质的标准摩尔生成焓(
。科学上规定:在298.15K时,由最稳定的单质生成1mol化合物时的焓变,叫作该物质的标准摩尔生成焓( );最稳定的单质的标准摩尔生成焓为零。
);最稳定的单质的标准摩尔生成焓为零。
已知:部分物质的标准摩尔生成焓数据如表:
则上述反应的
______  。
。
(2)T1℃时,将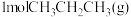 充入某刚性密闭容器中,在催化作用下发生无氧脱氢反应。用压强传感器测出容器内体系压强随时间的变化关系如表所示:
充入某刚性密闭容器中,在催化作用下发生无氧脱氢反应。用压强传感器测出容器内体系压强随时间的变化关系如表所示:
①已知: 。
。 内,用H2的分压变化表示上述脱氢反应的平均速率为
内,用H2的分压变化表示上述脱氢反应的平均速率为______  。
。
②T1℃时,反应的平衡常数
______  。
。 随反应温度升高而
随反应温度升高而______ (填“增大”“减小”或“不变”)。
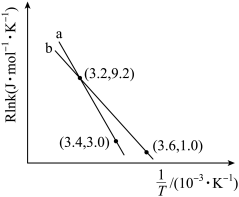
(3)丙烷在有氧气参与的条件下也可以发生脱氢反应: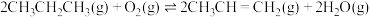 。下列说法正确的是______(填序号)。
。下列说法正确的是______(填序号)。
(4)甲醇催化也可以制取丙烯,其反应为
①该反应的阿伦尼乌斯经验公式的实验数据如图中直线a所示,已知阿伦尼乌斯经验公式为 (
( 为活化能,k为速率常数,R和C为常数)。则该反应的活化能
为活化能,k为速率常数,R和C为常数)。则该反应的活化能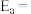
______  。
。______ (填序号)。
a.升高温度 b.增大压强 c.增大
(1)丙烷无氧脱氢法制备丙烯的反应为
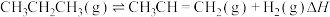 。科学上规定:在298.15K时,由最稳定的单质生成1mol化合物时的焓变,叫作该物质的标准摩尔生成焓(
。科学上规定:在298.15K时,由最稳定的单质生成1mol化合物时的焓变,叫作该物质的标准摩尔生成焓( );最稳定的单质的标准摩尔生成焓为零。
);最稳定的单质的标准摩尔生成焓为零。已知:部分物质的标准摩尔生成焓数据如表:
| 物质 | CH3CH2CH3(g | )CH3CH=CH2(g) |
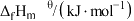 | -104 | 19.8 |

 。
。(2)T1℃时,将
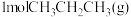 充入某刚性密闭容器中,在催化作用下发生无氧脱氢反应。用压强传感器测出容器内体系压强随时间的变化关系如表所示:
充入某刚性密闭容器中,在催化作用下发生无氧脱氢反应。用压强传感器测出容器内体系压强随时间的变化关系如表所示:时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 100 | 136 | 163 | 178 | 180 | 180 | 180 |
 。
。 内,用H2的分压变化表示上述脱氢反应的平均速率为
内,用H2的分压变化表示上述脱氢反应的平均速率为 。
。②T1℃时,反应的平衡常数

 。
。 随反应温度升高而
随反应温度升高而(3)丙烷在有氧气参与的条件下也可以发生脱氢反应:
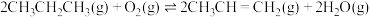 。下列说法正确的是______(填序号)。
。下列说法正确的是______(填序号)。| A.相对于丙烷直接催化脱氢法,有氧气催化脱氢,反应更容易进行 |
| B.相同条件下,氢气、丙烯、丙烷三种气体中,还原性最强的是氢气 |
| C.恒温恒容条件下,当混合气体的密度不再随时间改变时,说明反应达到限度 |
| D.通入更多的氧气,有利于提高丙烷转化率,提高丙烯的产率 |

①该反应的阿伦尼乌斯经验公式的实验数据如图中直线a所示,已知阿伦尼乌斯经验公式为
 (
( 为活化能,k为速率常数,R和C为常数)。则该反应的活化能
为活化能,k为速率常数,R和C为常数)。则该反应的活化能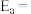
 。
。
a.升高温度 b.增大压强 c.增大

您最近一年使用:0次
2 . 常温常压下向2L的恒温密闭容器中投入2mol A和1mol B,发生可逆反应 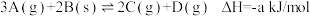 。5min后达平衡,测得容器中n(C)=0.8mol。则下列说法正确的是
。5min后达平衡,测得容器中n(C)=0.8mol。则下列说法正确的是
| A.3v(A)=2v(C)=0.16 mol/(L•min) |
| B.该可逆反应达平衡后,放出0.8a kJ的热能(假设化学能全转化为热能) |
| C.升高温度,该平衡正向速率减小,故平衡逆向移动 |
| D.使用催化剂或缩小容器体积,该平衡均不会移动 |
您最近一年使用:0次
名校
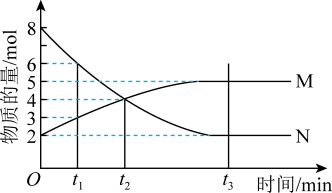
3 . Ⅰ.在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图: 时刻,正逆反应速率大小
时刻,正逆反应速率大小
___________  。(填“>”“=”或“<”)
。(填“>”“=”或“<”)
(2)若 min,计算反应开始至
min,计算反应开始至 时刻用M的浓度变化表示的平均反应速率
时刻用M的浓度变化表示的平均反应速率___________ 。
(3) 时刻化学反应达到平衡,反应物的转化率为
时刻化学反应达到平衡,反应物的转化率为___________ 。
(4)写出反应的化学方程式___________ 。
(5)如果升高温度,则
___________ (填“增大”“减小”或“不变”)。
Ⅱ.某同学设计如下实验方案探究影响锌与稀硫酸反应速率的因素,有关数据如下表所示:
(6)①本实验待测数据可以是___________ ,实验Ⅰ和实验Ⅱ可以探究___________ ,对锌与稀硫酸反应速率的影响。
②实验Ⅲ和实验Ⅳ的目的是___________ 。
(7)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
表中
___________ 。
 时刻,正逆反应速率大小
时刻,正逆反应速率大小
 。(填“>”“=”或“<”)
。(填“>”“=”或“<”)(2)若
 min,计算反应开始至
min,计算反应开始至 时刻用M的浓度变化表示的平均反应速率
时刻用M的浓度变化表示的平均反应速率(3)
 时刻化学反应达到平衡,反应物的转化率为
时刻化学反应达到平衡,反应物的转化率为(4)写出反应的化学方程式
(5)如果升高温度,则

Ⅱ.某同学设计如下实验方案探究影响锌与稀硫酸反应速率的因素,有关数据如下表所示:
| 序号 | 纯锌粉/g | 2.0 硫酸溶液/mL 硫酸溶液/mL | 温度/℃ | 硫酸铜固体/g | 加入蒸馏水/mL |
| Ⅰ | 2.0 | 50.0 | 25 | 0 | 0 |
| Ⅱ | 2.0 | 40.0 | 25 | 0 | 10.0 |
| Ⅲ | 2.0 | 50.0 | 25 | 0.2 | 0 |
| Ⅳ | 2.0 | 50.0 | 25 | 4.0 | 0 |
(6)①本实验待测数据可以是
②实验Ⅲ和实验Ⅳ的目的是
(7)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验序号 | 体积V/mL | ||||
 溶液 溶液 | 水 | KI溶液 |  溶液 溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 |  | 4.0 | 4.0 | 2.0 |
您最近一年使用:0次
名校
4 . 对水样中影响M分解速率的因素进行研究。在相同温度下,M的物质的量浓度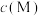 随时间(t)的变化如图所示。下列说法正确的是
随时间(t)的变化如图所示。下列说法正确的是
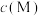 随时间(t)的变化如图所示。下列说法正确的是
随时间(t)的变化如图所示。下列说法正确的是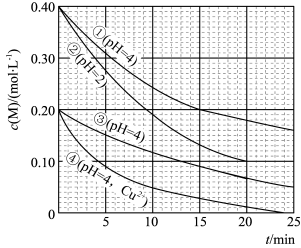
| A.水样pH越大,M的分解速率越大 |
B.水样中添加 ,能减小M的分解速率 ,能减小M的分解速率 |
| C.由①③得,反应物浓度越大,M的分解速率越小 |
D.在0~20min内,②中M的分解速率为0.015 |
您最近一年使用:0次
解题方法
5 . 甲烷和乙炔(CH≡CH)在有机合成中有着广泛的用途。
(1)已知:①
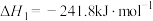
②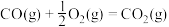

③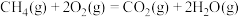
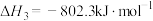
写出甲烷与水蒸气在高温下制备合成气(CO、 )的热化学方程式:
)的热化学方程式:___________ 。
(2)用甲烷在高温下气相裂解制取乙炔和氢气,其反应原理为
 。几种气体平衡时分压(Pa)的对数与温度(K)的关系如图所示。
。几种气体平衡时分压(Pa)的对数与温度(K)的关系如图所示。
___________ (用气体平衡分压代替浓度计算)。
② ℃时,向体积为2L的恒容密闭容器中充入
℃时,向体积为2L的恒容密闭容器中充入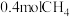 进行上述反应。当反应达到平衡时,测得
进行上述反应。当反应达到平衡时,测得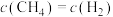 ,则
,则 的转化率为
的转化率为___________ 。若改变温度至 ℃,10s后反应再次达到平衡,测得
℃,10s后反应再次达到平衡,测得 ,则该变化过程中
,则该变化过程中
___________ (填“>”或“<”) 。
。
(3)一定温度下,向体积为2L的恒容密闭容器中充入 (乙炔)和2molHCl发生反应:
(乙炔)和2molHCl发生反应: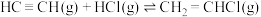
 。测得反应物(
。测得反应物( 或HCl)浓度随时间的变化关系如图所示。
或HCl)浓度随时间的变化关系如图所示。
___________ (填“>”“<”或“=”) 。
。
②15min时仅改变了一个外界条件,改变的条件可能是___________ 。
③0~10min内氯乙烯的平均反应速率
___________  。向密闭容器中充入一定量乙炔和氯化氢,发生上述反应,测得乙炔的平衡转化率与温度、S的关系如图所示。其中
。向密闭容器中充入一定量乙炔和氯化氢,发生上述反应,测得乙炔的平衡转化率与温度、S的关系如图所示。其中 ,则S代表的物理量是
,则S代表的物理量是___________ 。
(1)已知:①

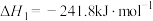
②
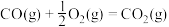

③
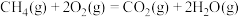
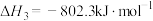
写出甲烷与水蒸气在高温下制备合成气(CO、
 )的热化学方程式:
)的热化学方程式:(2)用甲烷在高温下气相裂解制取乙炔和氢气,其反应原理为

 。几种气体平衡时分压(Pa)的对数与温度(K)的关系如图所示。
。几种气体平衡时分压(Pa)的对数与温度(K)的关系如图所示。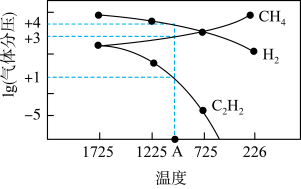

②
 ℃时,向体积为2L的恒容密闭容器中充入
℃时,向体积为2L的恒容密闭容器中充入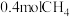 进行上述反应。当反应达到平衡时,测得
进行上述反应。当反应达到平衡时,测得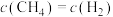 ,则
,则 的转化率为
的转化率为 ℃,10s后反应再次达到平衡,测得
℃,10s后反应再次达到平衡,测得 ,则该变化过程中
,则该变化过程中
 。
。(3)一定温度下,向体积为2L的恒容密闭容器中充入
 (乙炔)和2molHCl发生反应:
(乙炔)和2molHCl发生反应: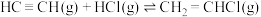
 。测得反应物(
。测得反应物( 或HCl)浓度随时间的变化关系如图所示。
或HCl)浓度随时间的变化关系如图所示。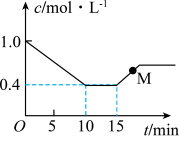

 。
。②15min时仅改变了一个外界条件,改变的条件可能是
③0~10min内氯乙烯的平均反应速率

 。向密闭容器中充入一定量乙炔和氯化氢,发生上述反应,测得乙炔的平衡转化率与温度、S的关系如图所示。其中
。向密闭容器中充入一定量乙炔和氯化氢,发生上述反应,测得乙炔的平衡转化率与温度、S的关系如图所示。其中 ,则S代表的物理量是
,则S代表的物理量是
您最近一年使用:0次
6 . 中国科学家设计构建了结构封装双钯活性位点—纳米“蓄水”膜反应器,实现了 一步无副反应高效稳定制乙醇。回答下列问题:
一步无副反应高效稳定制乙醇。回答下列问题:
(1)已知乙醇、氢气的标准燃烧热 分别为
分别为 、
、 ,则反应
,则反应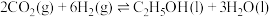 的
的
___________  ,该反应在
,该反应在___________ (填“高温下”“低温下”或“任何温度下均”)有利于自发进行。
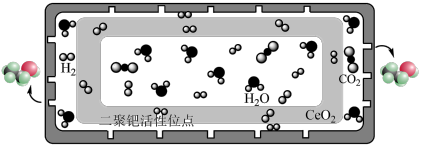
(2)结构封装双钯活性位点—纳米“蓄水”膜反应器结构(如图所示)类似于一个胶囊,胶囊内部封装了二氧化铈载体分散的双钯催化剂,胶囊的壳层具有高选择性、疏水性,可及时分离出产物乙醇。该反应器可使 高效稳定地转化为乙醇,请分析可能原因:
高效稳定地转化为乙醇,请分析可能原因:___________ 。
(3)在一恒压密闭容器中充入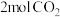 、
、 ,发生主反应I
,发生主反应I 、副反应II
、副反应II 。已知初始压强为
。已知初始压强为 ,反应
,反应 时,测得
时,测得 下,总共生成
下,总共生成 水。甲醇与乙醇的选择性[如
水。甲醇与乙醇的选择性[如 的选择性
的选择性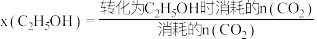 ]随温度和反应时间的变化关系如图。
]随温度和反应时间的变化关系如图。
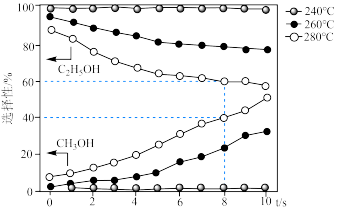
①在 下,当温度为
下,当温度为 时,乙醇的选择性能保持在近
时,乙醇的选择性能保持在近 的水平,但温度为
的水平,但温度为 和
和 时选择性大幅下降,其原因可能为
时选择性大幅下降,其原因可能为___________ 。
② 下,
下, 内
内 的转化率为
的转化率为___________ %,氢气分压的平均变化率为___________  。
。
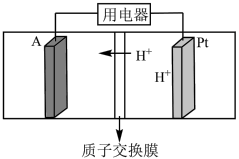
(4)酸性 燃料电池的装置图如图所示,A极输入的物质为
燃料电池的装置图如图所示,A极输入的物质为___________ (填化学式), 极的电极反应式为
极的电极反应式为___________ 。
 一步无副反应高效稳定制乙醇。回答下列问题:
一步无副反应高效稳定制乙醇。回答下列问题:(1)已知乙醇、氢气的标准燃烧热
 分别为
分别为 、
、 ,则反应
,则反应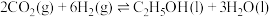 的
的
 ,该反应在
,该反应在(2)结构封装双钯活性位点—纳米“蓄水”膜反应器结构(如图所示)类似于一个胶囊,胶囊内部封装了二氧化铈载体分散的双钯催化剂,胶囊的壳层具有高选择性、疏水性,可及时分离出产物乙醇。该反应器可使
 高效稳定地转化为乙醇,请分析可能原因:
高效稳定地转化为乙醇,请分析可能原因:
(3)在一恒压密闭容器中充入
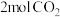 、
、 ,发生主反应I
,发生主反应I 、副反应II
、副反应II 。已知初始压强为
。已知初始压强为 ,反应
,反应 时,测得
时,测得 下,总共生成
下,总共生成 水。甲醇与乙醇的选择性[如
水。甲醇与乙醇的选择性[如 的选择性
的选择性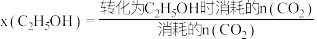 ]随温度和反应时间的变化关系如图。
]随温度和反应时间的变化关系如图。
①在
 下,当温度为
下,当温度为 时,乙醇的选择性能保持在近
时,乙醇的选择性能保持在近 的水平,但温度为
的水平,但温度为 和
和 时选择性大幅下降,其原因可能为
时选择性大幅下降,其原因可能为②
 下,
下, 内
内 的转化率为
的转化率为 。
。(4)酸性
 燃料电池的装置图如图所示,A极输入的物质为
燃料电池的装置图如图所示,A极输入的物质为 极的电极反应式为
极的电极反应式为
您最近一年使用:0次
2024-03-31更新
|
119次组卷
|
2卷引用:2024届陕西省榆林市高三上学期第一次模拟检测理综试题-高中化学
7 . 某化学兴趣小组为了测定化学反应速率,并研究外界条件对化学反应速率的影响,设计并完成了如下实验:
I.甲同学利用下图所示装置(夹持装置略)测定化学反应速率,借助秒表测量量气管内液面不再变化时所需的时间,同时读取量气管在反应前后的液面差,计算该反应的速率。

回答下列问题:
(1)蒸馏烧瓶中发生反应的离子方程式为_______ 。
(2)为了减少气体溶解,试剂X最好选用_______ (填名称)。
(3)实验结束后,读数时应该注意:_______ 、_______ (任填两项),然后再读取数据。
Ⅱ.乙同学设计如下实验探究高锰酸钾的浓度对速率的影响,并测定反应速率。
(4)
_______ 。
(5)利用实验①中数据,计算用 表示的化学反应速率为
表示的化学反应速率为_______  ,通过数据比较可以得出:反应速率①
,通过数据比较可以得出:反应速率①_______ (填“>”、“<”或“=”)②。
(6)实验③最终溶液颜色变浅、但不褪去的原因可能是_______ 。
I.甲同学利用下图所示装置(夹持装置略)测定化学反应速率,借助秒表测量量气管内液面不再变化时所需的时间,同时读取量气管在反应前后的液面差,计算该反应的速率。

回答下列问题:
(1)蒸馏烧瓶中发生反应的离子方程式为
(2)为了减少气体溶解,试剂X最好选用
(3)实验结束后,读数时应该注意:
Ⅱ.乙同学设计如下实验探究高锰酸钾的浓度对速率的影响,并测定反应速率。
| 实验 | 温度/℃ |  溶液的体积/mL 溶液的体积/mL |  溶液的体积/mL 溶液的体积/mL |  的体积/mL 的体积/mL | 水的体积/mL | 溶液褪色的时间/min |
| ① | 25 | 10 | 30 | 20 | 40 | 2.5 |
| ② | 25 | 20 | 30 | 20 | a | 3.0 |
| ③ | 25 | 40 | 30 | 20 | 10 | 溶液颜色变浅,但不褪去 |
(4)

(5)利用实验①中数据,计算用
 表示的化学反应速率为
表示的化学反应速率为 ,通过数据比较可以得出:反应速率①
,通过数据比较可以得出:反应速率①(6)实验③最终溶液颜色变浅、但不褪去的原因可能是
您最近一年使用:0次
名校
解题方法
8 . 反应 在
在 的密闭容器中进行,
的密闭容器中进行, 后
后 的物质的量减小了
的物质的量减小了 ,则对此反应的速率的表示正确的是
,则对此反应的速率的表示正确的是
 在
在 的密闭容器中进行,
的密闭容器中进行, 后
后 的物质的量减小了
的物质的量减小了 ,则对此反应的速率的表示正确的是
,则对此反应的速率的表示正确的是A. | B. |
C. | D. |
您最近一年使用:0次
2024-03-07更新
|
666次组卷
|
2卷引用:陕西省西安市航天中学2023-2024学年高一下学期第一次月考化学试题
名校
解题方法
9 . 从衣食住行到探索浩瀚宇宙,都有氮及其化合物的参与,但同时有毒含氮化合物的排放,也对环境产生污染。如何实现环境保护与资源利用的和谐统一,已成为我们的重要研究课题。
(1)工业上利用N2和H2可以合成NH3,NH3又可以进一步制备火箭燃料肼(N2H4)。
①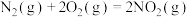 △H1
△H1
② △H2
△H2
③ △H3
△H3
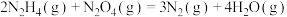 的反应热△H=
的反应热△H=______ (写出表达式)。
(2) N2H4的水溶液呈弱碱性,室温下其电离常数 ,则0.01 mol∙L-1的N2H4水溶液pH等于
,则0.01 mol∙L-1的N2H4水溶液pH等于______ (忽略N2H4的二级电离和H2O的电离,lg4=0.6)。
(3)利用测压法在刚性密闭容器中研究T1℃时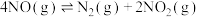 (△H<0)的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如下表所示:
(△H<0)的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如下表所示:
①0~20 min时,v(NO2)=______ MPa∙min-1。
②T1℃时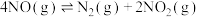 反应的平衡常数Kx=
反应的平衡常数Kx=______ (Kx为以物质的量分数表示的平衡常数)。若升高温度,N2的物质的量分数将______ (填“增大”“减小”或“不变”)。
(4)将等物质的量的NO和CO分别充入盛有催化剂①和②的体积相同的刚性容器,进行反应 △H<0,经过相同时间测得NO的转化率如图所示,图中cd段转化率下降的可能原因是(答2条):
△H<0,经过相同时间测得NO的转化率如图所示,图中cd段转化率下降的可能原因是(答2条):
①________________________________________________ ;
②________________________________________________ 。

(1)工业上利用N2和H2可以合成NH3,NH3又可以进一步制备火箭燃料肼(N2H4)。
①
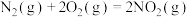 △H1
△H1②
 △H2
△H2③
 △H3
△H3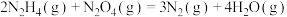 的反应热△H=
的反应热△H=(2) N2H4的水溶液呈弱碱性,室温下其电离常数
 ,则0.01 mol∙L-1的N2H4水溶液pH等于
,则0.01 mol∙L-1的N2H4水溶液pH等于(3)利用测压法在刚性密闭容器中研究T1℃时
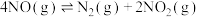 (△H<0)的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如下表所示:
(△H<0)的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如下表所示:| 反应时间/min | 0 | 10 | 20 | 30 | 40 |
| 压强/MPa | 15.00 | 14.02 | 13.20 | 12.50 | 12.50 |
②T1℃时
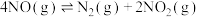 反应的平衡常数Kx=
反应的平衡常数Kx=(4)将等物质的量的NO和CO分别充入盛有催化剂①和②的体积相同的刚性容器,进行反应
 △H<0,经过相同时间测得NO的转化率如图所示,图中cd段转化率下降的可能原因是(答2条):
△H<0,经过相同时间测得NO的转化率如图所示,图中cd段转化率下降的可能原因是(答2条):①
②

您最近一年使用:0次
10 . 体积均为1L的两个恒容密闭容器I、Ⅱ中,均充入2mol CO(g)和2mol NO(g),发生反应: ,相对容器Ⅱ,容器I只改变一个外界条件,测得N2的物质的量与时间关系如图所示。下列叙述正确的是
,相对容器Ⅱ,容器I只改变一个外界条件,测得N2的物质的量与时间关系如图所示。下列叙述正确的是
 ,相对容器Ⅱ,容器I只改变一个外界条件,测得N2的物质的量与时间关系如图所示。下列叙述正确的是
,相对容器Ⅱ,容器I只改变一个外界条件,测得N2的物质的量与时间关系如图所示。下列叙述正确的是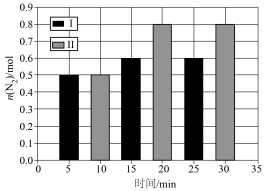
| A.该反应是吸热反应,容器I改变的条件可能是使用了催化剂 |
| B.相对容器Ⅱ,容器I改变的条件可能是升温或者加压 |
| C.容器Ⅱ中NO的平衡转化率为80% |
D.容器Ⅱ中0~10min内,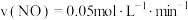 |
您最近一年使用:0次



