1 . 汽车尾气中含有CO和NO等,可以用不同的方法净化处理,防止空气污染。回答下列问题:
(1)在汽车尾气系统中安装催化转化器可减少CO和NO的污染,其反应为2CO(g)+2NO(g) 2CO2(g)+N2(g) △H。
2CO2(g)+N2(g) △H。
①该反应在常温下能自发进行,则该反应的△H_______ 0(填“>”或“<”)。
②将CO和NO以一定流速通过两种不同的催化剂发生上述反应、相同时间内测量逸出气体中N2的含量,从而确定尾气脱氮率(即NO的转化率),结果如下图所示:
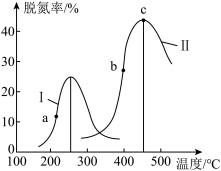
a点的v逆_______ b点的v正(填“>”“<”或“=”')。c点_______ (填“一定”或“不一定”)是平衡状态。
③对于反应2CO(g)+2NO(g) 2CO2(g)+N2(g),在实验中测得:v正= k正·c2(CO)·c2(NO)、v逆= k逆·c2(CO2)·c (N2),k正、k逆分别是正、逆反应速率常数,且只是温度的函数。
2CO2(g)+N2(g),在实验中测得:v正= k正·c2(CO)·c2(NO)、v逆= k逆·c2(CO2)·c (N2),k正、k逆分别是正、逆反应速率常数,且只是温度的函数。
T℃,将2 mol CO(g)和2 mol NO(g)通入体积为1 L的恒容密闭容器发生上述反应,反应平衡时,CO(g)的转化率为50%,则当CO(R)的转化率为25%时,v正:v逆=_______ 。
(2)二氧化铈(CeO2)在汽车尾气中CO的催化消除中有将广泛的应用,同时二氧化铈(CeO2)负载贵金属(Rh)和贵金属氧化物(Rh2O3)后催化活性的变化如下图所示。下列说法正确的是_______ (填标号)。
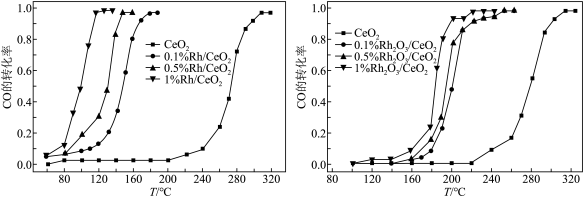
A.200℃时,复合催化剂比单一催化剂效率更高
B.在相同温度下,负载Rh2O3后催化剂的活性大于负载Rh的催化剂的活性
C.催化剂的活性随着负载Rh的增高而增大,促进了CO催化消除反应的平衡向正向移动
(3)用尿素水解生成的NH3催化还原NO,是柴油机车车辆尾气净化的主要方法。反应为4NH3(g)+O2(g)+4NO(g) 2N2(g)+6H2O(g)。实际应用中,加入尿素的量并不是越多越好,原因是
2N2(g)+6H2O(g)。实际应用中,加入尿素的量并不是越多越好,原因是__________ ,为了避免尿素过多造成的影响,可接一个氧化催化器,则氧化催化器中反应的化学方程式为_______ 。
(1)在汽车尾气系统中安装催化转化器可减少CO和NO的污染,其反应为2CO(g)+2NO(g)
 2CO2(g)+N2(g) △H。
2CO2(g)+N2(g) △H。①该反应在常温下能自发进行,则该反应的△H
②将CO和NO以一定流速通过两种不同的催化剂发生上述反应、相同时间内测量逸出气体中N2的含量,从而确定尾气脱氮率(即NO的转化率),结果如下图所示:

a点的v逆
③对于反应2CO(g)+2NO(g)
 2CO2(g)+N2(g),在实验中测得:v正= k正·c2(CO)·c2(NO)、v逆= k逆·c2(CO2)·c (N2),k正、k逆分别是正、逆反应速率常数,且只是温度的函数。
2CO2(g)+N2(g),在实验中测得:v正= k正·c2(CO)·c2(NO)、v逆= k逆·c2(CO2)·c (N2),k正、k逆分别是正、逆反应速率常数,且只是温度的函数。T℃,将2 mol CO(g)和2 mol NO(g)通入体积为1 L的恒容密闭容器发生上述反应,反应平衡时,CO(g)的转化率为50%,则当CO(R)的转化率为25%时,v正:v逆=
(2)二氧化铈(CeO2)在汽车尾气中CO的催化消除中有将广泛的应用,同时二氧化铈(CeO2)负载贵金属(Rh)和贵金属氧化物(Rh2O3)后催化活性的变化如下图所示。下列说法正确的是

A.200℃时,复合催化剂比单一催化剂效率更高
B.在相同温度下,负载Rh2O3后催化剂的活性大于负载Rh的催化剂的活性
C.催化剂的活性随着负载Rh的增高而增大,促进了CO催化消除反应的平衡向正向移动
(3)用尿素水解生成的NH3催化还原NO,是柴油机车车辆尾气净化的主要方法。反应为4NH3(g)+O2(g)+4NO(g)
 2N2(g)+6H2O(g)。实际应用中,加入尿素的量并不是越多越好,原因是
2N2(g)+6H2O(g)。实际应用中,加入尿素的量并不是越多越好,原因是
您最近一年使用:0次
解题方法
2 . 自热化学链重整制氢 工艺的原理如图所示:
工艺的原理如图所示:
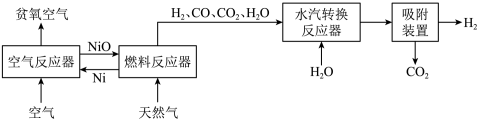
回答下列问题:
(1)25℃、101 时,5.9g
时,5.9g 与足量
与足量 反应生成
反应生成 放出47.2
放出47.2 的热量,则在“空气反应器”中发生反应的热化学方程式为
的热量,则在“空气反应器”中发生反应的热化学方程式为_______ 。
(2)“燃料反应器”中发生的部分反应有:
(Ⅰ)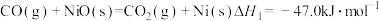
(Ⅱ)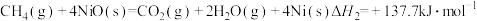
(Ⅲ)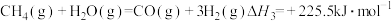
则反应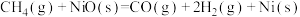 的
的
_______  。
。
(3)“水汽转换反应器”中发生的反应为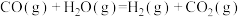 (平衡常数
(平衡常数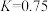 ),将天然气看作是纯净的
),将天然气看作是纯净的 (假定向水汽转换反应器中补充的水的物质的量等于甲烷的物质的量),若在t℃时进行转换,水汽转换反应器中某时刻
(假定向水汽转换反应器中补充的水的物质的量等于甲烷的物质的量),若在t℃时进行转换,水汽转换反应器中某时刻 、
、 、
、 、
、 浓度之比为
浓度之比为 此时
此时
_______ 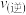 (填“>”、“=”或“<”),理由是
(填“>”、“=”或“<”),理由是_______ 。
(4)甲烷制氢传统工艺有水蒸气重整部分氧化重整以及联合重整等, 工艺重整是一种联合重整,涉及反应的热化学方程式如下:
工艺重整是一种联合重整,涉及反应的热化学方程式如下:
水蒸气重整反应: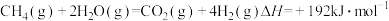
部分氧化重整反应: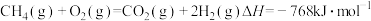
采用水蒸气重整的优点是_______ ;若上述两个反应在保持自热条件下(假设无热量损失),理论上1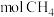 至多可获得
至多可获得 的物质的量为
的物质的量为_______ (结果保留1位小数)。
 工艺的原理如图所示:
工艺的原理如图所示:
回答下列问题:
(1)25℃、101
 时,5.9g
时,5.9g 与足量
与足量 反应生成
反应生成 放出47.2
放出47.2 的热量,则在“空气反应器”中发生反应的热化学方程式为
的热量,则在“空气反应器”中发生反应的热化学方程式为(2)“燃料反应器”中发生的部分反应有:
(Ⅰ)
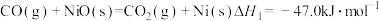
(Ⅱ)
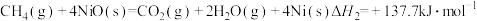
(Ⅲ)
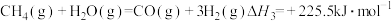
则反应
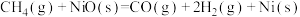 的
的
 。
。(3)“水汽转换反应器”中发生的反应为
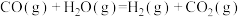 (平衡常数
(平衡常数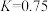 ),将天然气看作是纯净的
),将天然气看作是纯净的 (假定向水汽转换反应器中补充的水的物质的量等于甲烷的物质的量),若在t℃时进行转换,水汽转换反应器中某时刻
(假定向水汽转换反应器中补充的水的物质的量等于甲烷的物质的量),若在t℃时进行转换,水汽转换反应器中某时刻 、
、 、
、 、
、 浓度之比为
浓度之比为 此时
此时
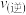 (填“>”、“=”或“<”),理由是
(填“>”、“=”或“<”),理由是(4)甲烷制氢传统工艺有水蒸气重整部分氧化重整以及联合重整等,
 工艺重整是一种联合重整,涉及反应的热化学方程式如下:
工艺重整是一种联合重整,涉及反应的热化学方程式如下:水蒸气重整反应:
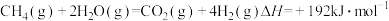
部分氧化重整反应:
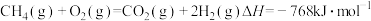
采用水蒸气重整的优点是
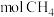 至多可获得
至多可获得 的物质的量为
的物质的量为
您最近一年使用:0次
解题方法
3 . 下列解释事实的方程式正确的是:
A.钢铁发生吸氧腐蚀,负极反应为: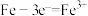 |
B.0.1 次氯酸溶液的 次氯酸溶液的 约为4.2: 约为4.2: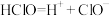 |
C.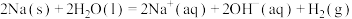  、 、 |
D.利用明矾做混凝剂净水: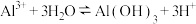 |
您最近一年使用:0次
名校
解题方法
4 . 研究化学反应进行的方向对于反应设计等具有重要意义,下列说法正确的是
| A.ΔH<0,ΔS>0的反应,在温度低时不能自发进行 |
| B.反应2MgO(s)+CO2(g)=2Mg(s)+C(s)能自发进行,说明该反应的ΔH>0 |
| C.需要加热才能进行的反应一定不是自发反应 |
| D.SiO2(s)+2C(s)=Si(s)+2CO(g)在高温下可自发进行,则该反应的ΔH>0 |
您最近一年使用:0次
名校
解题方法
5 . 回答下列问题:
(1)用钌的配合物作催化剂,一定条件下可直接光催化分解 ,发生反应:
,发生反应:
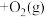 ,该反应的∆H
,该反应的∆H________ (填“>”或“<”,下同)0,∆S_______ 0,在低温下,该反应________ (填“能”或“不能”)自发进行。
(2)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式为 。反应在常温下能够自发进行,则反应的∆H
。反应在常温下能够自发进行,则反应的∆H______ (填“>”或“<”)0。
(3)已知在 、
、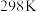 时石灰石分解反应
时石灰石分解反应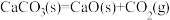 的
的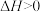 、
、 。
。
①常温下,该反应________ (填“能”或“不能”)自发进行。
②据本题反应数据分析,温度________ (填“能”或“不能”)成为反应进行方向的决定因素。
(4)已知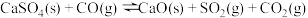
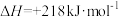 ,该反应能够自发进行的反应条件是
,该反应能够自发进行的反应条件是______ 。
(5)某吸热反应能自发进行,则该反应的∆S_____ (填“>”或“<”)0。
(1)用钌的配合物作催化剂,一定条件下可直接光催化分解
 ,发生反应:
,发生反应:
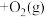 ,该反应的∆H
,该反应的∆H(2)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式为
 。反应在常温下能够自发进行,则反应的∆H
。反应在常温下能够自发进行,则反应的∆H(3)已知在
 、
、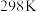 时石灰石分解反应
时石灰石分解反应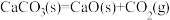 的
的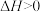 、
、 。
。①常温下,该反应
②据本题反应数据分析,温度
(4)已知
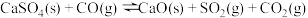
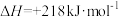 ,该反应能够自发进行的反应条件是
,该反应能够自发进行的反应条件是(5)某吸热反应能自发进行,则该反应的∆S
您最近一年使用:0次
2020-09-20更新
|
1090次组卷
|
17卷引用:湖北随州市第一中学2020-2021学年高二上学期期中考试化学试题
湖北随州市第一中学2020-2021学年高二上学期期中考试化学试题内蒙古集宁一中(西校区)2018-2019学年高一下学期期末考试化学试题2019年10月24日《每日一题》2019-2020学年高二化学人教选修4——化学反应方向的判断鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第1节 化学反应的方向高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第三节 化学反应的方向(已下线)练习5 化学反应的方向与调控-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)选择性必修1 专题2 第二单元 课时1 化学反应的方向(已下线)2.2.1 化学反应的方向-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)湖北省黄冈市麻城二中2021-2022学年高二上学期10月月考化学试题云南省澄江市第一中学2021-2022年高二下学期3月月考化学试题云南省瑞丽市第一民族中学2021-2022学年高二上学期期末考试化学试题(已下线)考点24 化学反应的方向-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)2.1 化学反应的方向-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)(已下线)第11讲 化学反应的方向-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)2.2.1化学反应的方向 课后作业(十) 化学反应的方向(已下线)考点24 化学反应的方向(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
6 . 氨的合成原理为:N2(g)+3H2(g)⇌2NH3(g)∆H=-92.4kJ·mol-1在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。回答下列问题:
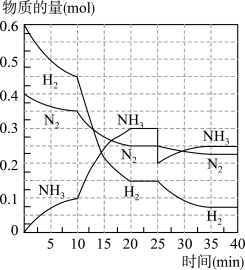
(1)10min内以NH3表示的平均反应速率为_________
(2)在10~20min内,NH3浓度变化的原因可能是_____________
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加NH3物质的量
(3)第1次平衡:平衡常数K1=__________ (带数据的表达式),第2次平衡时NH3的体积分数为_____________ 。
(4)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fc2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(l)⇌2NH3+1.5O2(g)∆H=akJ·mol-1,进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
①此合成反应的a______ 0,△S_______ 0;(填“>”、“<”或一”)
②已知N2(g)+3H2(g)⇌2NH3(g)∆H=-92.4kJ·mol-1,2 H2(g)+ O2(g)=2H2O(l) ∆H=-571.kJ·mol-1 则常温下氮气与水反应生成氨气与氧气的热化学方程式为_____________________________

(1)10min内以NH3表示的平均反应速率为
(2)在10~20min内,NH3浓度变化的原因可能是
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加NH3物质的量
(3)第1次平衡:平衡常数K1=
(4)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fc2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(l)⇌2NH3+1.5O2(g)∆H=akJ·mol-1,进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
①此合成反应的a
②已知N2(g)+3H2(g)⇌2NH3(g)∆H=-92.4kJ·mol-1,2 H2(g)+ O2(g)=2H2O(l) ∆H=-571.kJ·mol-1 则常温下氮气与水反应生成氨气与氧气的热化学方程式为
您最近一年使用:0次
2019-10-28更新
|
188次组卷
|
2卷引用:湖北省随州一中2019-2020学年高二上学期期中考试化学试题
名校
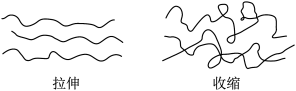
7 . 橡皮筋在拉伸和收缩状态时结构如图,在其拉伸过程中有放热现象。25℃、101kPa时,下列过程的焓变、熵变和自发性与橡皮筋从拉伸状态到收缩状态一致的是

| A.CaCO3=CaO+CO2↑ |
| B.NaOH的溶解 |
| C.2H2+O2=2H2O |
| D.Ba(OH)2•8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O |
您最近一年使用:0次
2018-11-28更新
|
514次组卷
|
16卷引用:湖北省随州市第一中学2018-2019学年高二下学期期中考试化学试题
湖北省随州市第一中学2018-2019学年高二下学期期中考试化学试题河南省八市2017-2018学年高二上学期第一次质量检测化学试题人教版高二化学选修4 第二章 第四节 化学反应进行的方向练习题辽宁省六校协作体2019-2020学年高二上学期期中考试化学试题福建省福州市八县一中2019-2020学年高二年上学期期末联考化学试题甘肃省张掖市2018—2019学年高二下学期期末考试化学试题鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第1节 化学反应的方向高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第三节 化学反应的方向江西省景德镇市昌江区景德镇一中2020-2021学年高二上学期期中考试化学试题(1班)安徽涡阳县育萃中学2020-2021学年高二上学期第三次月考化学试题江苏省南京市第十二中学2020-2021学年高二上学期第一次学情调研测试化学试题选择性必修1 专题2 第二单元 课时1 化学反应的方向(已下线)综合复习与测试(2)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)内蒙古赤峰市第四中学分校2021-2022学年高二上学期9月月考化学试题内蒙古赤峰市第四中学分校2021-2022学年高二上学期期中考试化学试题2.2.1化学反应的方向 课后
名校
8 . 关于恒容密闭容器进行的反应C(s)+ CO2(g)= 2CO(g)△H >0,下列说法不正确的是
| A.△S>0 |
| B.在低温下能自发进行 |
| C.当混合气体的密度不再发生变化时,反应达到平衡状态 |
| D.达到平衡状态时,升高温度, CO2转化率和反应速率均增大 |
您最近一年使用:0次
2017-11-11更新
|
810次组卷
|
9卷引用:湖北省随州一中2019-2020学年高二上学期期中考试化学试题
湖北省随州一中2019-2020学年高二上学期期中考试化学试题甘肃省会宁县第一中学2017-2018学年高二上学期期中考试(理)化学试题江西省南昌县莲塘一中2018届高三11月质量检测化学试题(已下线)2018-2019学年同步单元双基双测AB卷:第二单元化学反应速率与化学平衡单元测试B卷吉林省长春市一五O中2018-2019学年高二上学期期中考试化学试题湖南省双峰县第一中学2018-2019学年高二下学期第一次月考化学试题吉林省吉林地区普通高中友好学校联合体第三十一届2019-2020学年高二上学期期中考试化学试题内蒙古赤峰市宁城县2019-2020学年高二上学期期末考试化学试题黑龙江省鸡西市第一中学2020-2021学年度高二上学期期末化学试题



