1 . 某实验小组研究了几种无机盐对纤维素酶和木聚糖酶活力的影响。将无机盐与酶样分别以1∶10和1∶2的比例均匀混合,配制成待测酶液,酶活力测定结果如下表所示。已知不添加无机盐时,纤维素酶活力为1000IU/g,木聚糖酶活力为5000 IU/g。回答下列问题:
添加不同比例无机盐后对纤维素酶、木聚糖酶活力的影响 单位:IU/g
(1)酶活力也称酶活性,酶活性的大小可以用___________ 来表示。
(2)由表中数据可看出,随着无机盐添加比例的增加,对纤维素酶,木聚糖酶活力促进作用最明显的无机盐分别是___________ ;有同学提出相同的无机盐对不同酶的作用效果不同,其依据是___________ 。
(3)实验中 对木聚糖酶活力具有显著的抑制作用,原因可能是
对木聚糖酶活力具有显著的抑制作用,原因可能是___________ ,从而造成了木聚糖酶活性降低。
(4)在添加无机盐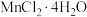 的条件下,进一步探究纤维素含量对酶促反应的影响,以羧甲基纤维素钠溶液作为反应底物,请设计实验思路及预期结果。
的条件下,进一步探究纤维素含量对酶促反应的影响,以羧甲基纤维素钠溶液作为反应底物,请设计实验思路及预期结果。
实验思路:___________ 。
预期实验结果:请根据预期实验结果绘制大致的曲线图___________ 。
添加不同比例无机盐后对纤维素酶、木聚糖酶活力的影响 单位:IU/g
| 添加无机盐 | 纤维素酶活力 | 木聚糖酶活力 | ||
| 1∶10 | 1∶2 | 1∶10 | 1∶2 | |
| NaCl | 1005 | 1005 | 5241 | 5318 |
| KI | 1001 | 1001 | 5012 | 5018 |
 | 957 | 902 | 1937 | 1798 |
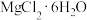 | 1000 | 1048 | 4496 | 4248 |
 | 1052 | 1084 | 4480 | 4261 |
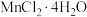 | 1225 | 1435 | 4546 | 4359 |
 | 996 | 1036 | 5313 | 5336 |
 | 1001 | 1069 | 5202 | 5381 |
 | 1007 | 1160 | 4407 | 4211 |
(2)由表中数据可看出,随着无机盐添加比例的增加,对纤维素酶,木聚糖酶活力促进作用最明显的无机盐分别是
(3)实验中
 对木聚糖酶活力具有显著的抑制作用,原因可能是
对木聚糖酶活力具有显著的抑制作用,原因可能是(4)在添加无机盐
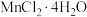 的条件下,进一步探究纤维素含量对酶促反应的影响,以羧甲基纤维素钠溶液作为反应底物,请设计实验思路及预期结果。
的条件下,进一步探究纤维素含量对酶促反应的影响,以羧甲基纤维素钠溶液作为反应底物,请设计实验思路及预期结果。实验思路:
预期实验结果:请根据预期实验结果绘制大致的曲线图
您最近半年使用:0次
名校
解题方法
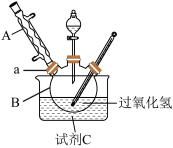
2 . 过二硫酸钠(Na2S2O8)是白色晶状粉末,易溶于水,不溶于乙醇,加热至65℃就会发生分解,常用作漂白剂,金属表面处理剂等。实验室以过氧化氢、浓硫酸和碳酸钠为原料制备过二硫酸钠。
I.过一硫酸(H2SO5)的合成
原理:H2O2+H2SO4=H2SO5+H2O。________ 。
(2)水槽中盛放的试剂C是________ (填“冰水”或“热水”)。
Ⅱ.过二硫酸钠(Na2S2O8)的合成
取下球形冷凝管A,在适当搅拌的条件下,沿瓶口a向仪器B中加入一定量的无水碳酸钠,控制加入速度,并控制反应温度在60℃左右,待碳酸钠完全溶解后继续恒温搅拌20min使之反应完全,这个过程中瓶口a不能封闭。
(3)合成反应分两步完成:________ ,2Na2SO4+H2SO5=2Na2S2O8+H2O。
(4)反应完毕,将仪器B中的溶液减压浓缩;结晶过滤、洗涤干燥,可得过硫酸钠,减压浓缩的原因是_________________ 。
(5)1mol Na2S2O8中存在的-O-O-数目为________ 。
(6)Na2S2O8具有强氧化性,可将I-氧化为I2: +2I-=2
+2I-=2 +I2↓,可用Fe2+作催化剂改变上述反应途径。试用离子方程式表示Fe2+对上述反应催化的历程:
+I2↓,可用Fe2+作催化剂改变上述反应途径。试用离子方程式表示Fe2+对上述反应催化的历程:_____________ 、__________ 。
(7)取适量过二硫酸钠,装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D,实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。取硬质玻璃管少量残留固体于试管中,加入蒸馏水,溶解后滴加BaCl2溶液和盐酸,产生白色沉淀。写出A装置中发生反应的化学方程式:____________ 。
I.过一硫酸(H2SO5)的合成
原理:H2O2+H2SO4=H2SO5+H2O。
(2)水槽中盛放的试剂C是
Ⅱ.过二硫酸钠(Na2S2O8)的合成
取下球形冷凝管A,在适当搅拌的条件下,沿瓶口a向仪器B中加入一定量的无水碳酸钠,控制加入速度,并控制反应温度在60℃左右,待碳酸钠完全溶解后继续恒温搅拌20min使之反应完全,这个过程中瓶口a不能封闭。
(3)合成反应分两步完成:
(4)反应完毕,将仪器B中的溶液减压浓缩;结晶过滤、洗涤干燥,可得过硫酸钠,减压浓缩的原因是
(5)1mol Na2S2O8中存在的-O-O-数目为
(6)Na2S2O8具有强氧化性,可将I-氧化为I2:
 +2I-=2
+2I-=2 +I2↓,可用Fe2+作催化剂改变上述反应途径。试用离子方程式表示Fe2+对上述反应催化的历程:
+I2↓,可用Fe2+作催化剂改变上述反应途径。试用离子方程式表示Fe2+对上述反应催化的历程:(7)取适量过二硫酸钠,装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D,实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。取硬质玻璃管少量残留固体于试管中,加入蒸馏水,溶解后滴加BaCl2溶液和盐酸,产生白色沉淀。写出A装置中发生反应的化学方程式:

您最近半年使用:0次
解题方法
3 . 甲烷是一种重要的化工原料,工业上可用甲烷大规模生产氢气。
方法一:甲烷高温重整反应制氢,主要反应如下:
反应I.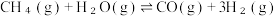 △H1
△H1
反应II.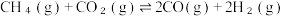 △H2
△H2
各反应平衡常数与温度的关系如图所示。_______ 0(填“>”或“<”),已知1000K时,达平衡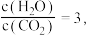 则此时
则此时 =
=_______ 。
(2)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示。当在某电极上生成的两种有机物物质的量之比为1∶1时,该电极上的电极反应式为_______ 。此时两个电极上理论消耗CH4和CO2的物质的量之比为_______ 。 在某温度下,体系压强恒定为p₀时,2molCH4和2molCO2发生上述反应,平衡时甲烷的转化率为50%,H₂O的分压为0.1p₀,则反应II的压强平衡常数Kp=
在某温度下,体系压强恒定为p₀时,2molCH4和2molCO2发生上述反应,平衡时甲烷的转化率为50%,H₂O的分压为0.1p₀,则反应II的压强平衡常数Kp=_______ (用含p₀的计算式表示,已知分压=总压×物质的量分数)。
方法二:甲烷裂解制氢的反应为(CH4(g)=C(s)+2H2(g) ΔH=+75kJ/mol,金属镍是该反应的一种高效催化剂,纳米SiO2具有较大比表面积和独特孔道结构,可以提高镍的分散性。
(4)与方法一相比,方法二制氢的优点是_______ (写出一条即可)。
(5)现以纳米SiO2负载镍为催化剂,以10mL/min的流速将甲烷通入常压固定床反应器中反应,600℃时,4种不同镍负载量催化剂对甲烷转化率和氢气产率的影响如图所示。由图判断,活性最强的催化剂是_______ (填标号),可能的原因是_______ (填标号)。
B.镍负载量较高时,载体孔内的镍迅速被积炭所覆盖,催化剂活性下降
C.镍负载量较高时,金属镍不易发生颗粒团聚,催化剂活性增强
方法一:甲烷高温重整反应制氢,主要反应如下:
反应I.
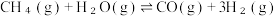 △H1
△H1反应II.
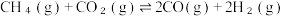 △H2
△H2各反应平衡常数与温度的关系如图所示。
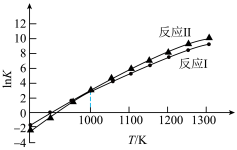
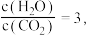 则此时
则此时 =
=(2)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示。当在某电极上生成的两种有机物物质的量之比为1∶1时,该电极上的电极反应式为
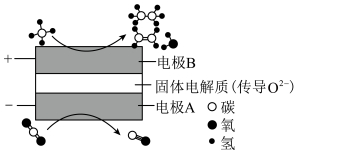
 在某温度下,体系压强恒定为p₀时,2molCH4和2molCO2发生上述反应,平衡时甲烷的转化率为50%,H₂O的分压为0.1p₀,则反应II的压强平衡常数Kp=
在某温度下,体系压强恒定为p₀时,2molCH4和2molCO2发生上述反应,平衡时甲烷的转化率为50%,H₂O的分压为0.1p₀,则反应II的压强平衡常数Kp=方法二:甲烷裂解制氢的反应为(CH4(g)=C(s)+2H2(g) ΔH=+75kJ/mol,金属镍是该反应的一种高效催化剂,纳米SiO2具有较大比表面积和独特孔道结构,可以提高镍的分散性。
(4)与方法一相比,方法二制氢的优点是
(5)现以纳米SiO2负载镍为催化剂,以10mL/min的流速将甲烷通入常压固定床反应器中反应,600℃时,4种不同镍负载量催化剂对甲烷转化率和氢气产率的影响如图所示。由图判断,活性最强的催化剂是
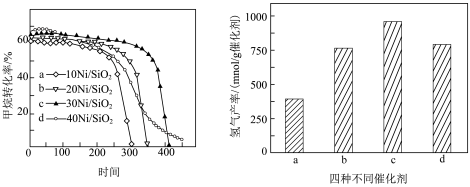
B.镍负载量较高时,载体孔内的镍迅速被积炭所覆盖,催化剂活性下降
C.镍负载量较高时,金属镍不易发生颗粒团聚,催化剂活性增强
您最近半年使用:0次
4 . 苯酚是一种重要的化工原料,一种制取苯酚的反应机理如图。下列说法正确的是
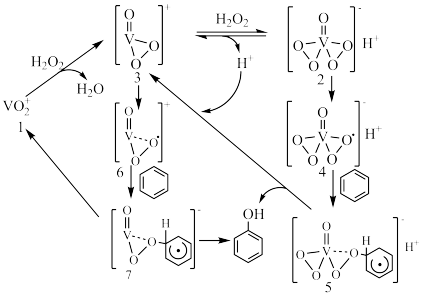
| A.苯和过氧化氢为非极性分子,水和苯酚为极性分子 |
| B.中间产物5转化为3的过程中,还生成了H2O |
| C.反应涉及O-H、V-O、C-H键的断裂和生成 |
| D.中间产物2和3之间的转化是氧化还原反应 |
您最近半年使用:0次
5 . 甲醇直接脱氢制无水甲醛是具有工业化前景的新工艺。回答下列问题:
(1)在标准压强(100kPa)、298K下,一些物质的热力学数据如下表,标准摩尔生成焓是指由稳定的单质合成1mol该物质的反应焓变;
甲醇脱氢制甲醛的反应方程式为:

___________ ,该反应高温能自发进行的原因是___________ 。
(2)已知Arrhenius经验公式为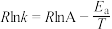 (
( 为活化能,k为速率常数,R、A为常数)。一定条件下,催化剂1作用下甲醇脱氢制甲醛反应的Arrhenius经验公式的实验数据如图中曲线a所示。
为活化能,k为速率常数,R、A为常数)。一定条件下,催化剂1作用下甲醇脱氢制甲醛反应的Arrhenius经验公式的实验数据如图中曲线a所示。
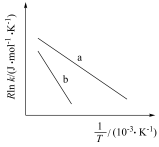
①升高温度,速率常数k___________ (填“增大”“减小”或“不变”);
②催化剂Ⅱ作用下,实验数据如图中b线所示,则催化效果:催化剂Ⅰ___________ 催化剂Ⅱ(填“>”成“<”)。
(3)催化剂1作用下,恒容密闭容器中充入一定量的 发生反应
发生反应 ,达到平衡时,容器总压、
,达到平衡时,容器总压、 的体积分数随温度的变化曲线如图所示。
的体积分数随温度的变化曲线如图所示。
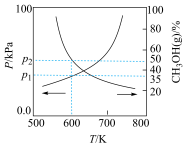
①随着温度的升高,压强不断增大的原因是___________ 。
②600K达到平衡时,
___________ kPa(用含“p”的式子表示,下同), 的转化率为
的转化率为___________ ,
___________ 。
(1)在标准压强(100kPa)、298K下,一些物质的热力学数据如下表,标准摩尔生成焓是指由稳定的单质合成1mol该物质的反应焓变;
| 物质 |  | HCHO |  |
标准摩尔生成焓(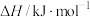 ) ) | 0 | -115.8 | -201 |
熵(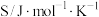 ) ) | 130.7 | 218.7 | 239.9 |


(2)已知Arrhenius经验公式为
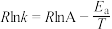 (
( 为活化能,k为速率常数,R、A为常数)。一定条件下,催化剂1作用下甲醇脱氢制甲醛反应的Arrhenius经验公式的实验数据如图中曲线a所示。
为活化能,k为速率常数,R、A为常数)。一定条件下,催化剂1作用下甲醇脱氢制甲醛反应的Arrhenius经验公式的实验数据如图中曲线a所示。
①升高温度,速率常数k
②催化剂Ⅱ作用下,实验数据如图中b线所示,则催化效果:催化剂Ⅰ
(3)催化剂1作用下,恒容密闭容器中充入一定量的
 发生反应
发生反应 ,达到平衡时,容器总压、
,达到平衡时,容器总压、 的体积分数随温度的变化曲线如图所示。
的体积分数随温度的变化曲线如图所示。
①随着温度的升高,压强不断增大的原因是
②600K达到平衡时,

 的转化率为
的转化率为
您最近半年使用:0次
6 . 科学家研究发现,在一种特殊催化剂和水参与下, 和
和 可高选择性地直接合成
可高选择性地直接合成 ,其反应机理如图所示,其中
,其反应机理如图所示,其中 表示被吸附在催化剂表面的M。
表示被吸附在催化剂表面的M。
下列说法错误的是
 和
和 可高选择性地直接合成
可高选择性地直接合成 ,其反应机理如图所示,其中
,其反应机理如图所示,其中 表示被吸附在催化剂表面的M。
表示被吸附在催化剂表面的M。
下列说法错误的是
A.在催化剂表面,存在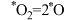 ,该过程放热 ,该过程放热 |
B.总反应是化合反应, 在总反应中相当于催化 在总反应中相当于催化 |
C.若起始时加入的是 、 、 、 、 ,则产物甲醇分子一定是 ,则产物甲醇分子一定是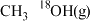 |
D.该过程的决速步反应为取代反应: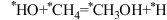 |
您最近半年使用:0次
名校
7 . 锂-氧电池(LOB)由于其超高的理论能量密度而被认为是最有前途的储能器件之一、最近,北京大学&清华大学课题组报道了以Pt1Pd为催化剂的LOB,其工作原理如图所示(Pt1Pd为单原子合金催化剂,单原子Pt精确分散在超薄P六方纳米板上)。
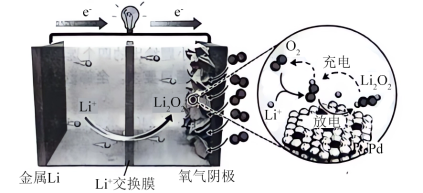
已知:理论能量密度是指在特定条件下,单位体积或表面积内储存的能量大小。
下列叙述正确的是

已知:理论能量密度是指在特定条件下,单位体积或表面积内储存的能量大小。
下列叙述正确的是
| A.放电时“氧气阴极”发生氧化反应 |
| B.LOB理论能量密度高是因为锂是最活泼金属 |
| C.充电时,金属Li电极电势高于另一电极 |
| D.Pt1Pd促进O2/Li2O2氧化还原对的活化,降低反应的活化能 |
您最近半年使用:0次
名校
解题方法
8 . 合成氨原料气高纯氢可以由天然气、水蒸气催化重整制取,所涉及的主要反应如下:
已知:反应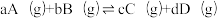 的物质的量分数平衡常数
的物质的量分数平衡常数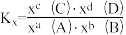 ,其中x(A)、x(B)、x(C)、x(D)为各组分的物质的量分数。
,其中x(A)、x(B)、x(C)、x(D)为各组分的物质的量分数。
请回答下列问题:
(1)298K时,有关物质的相对能量如下表所示。
CH4(g)的相对能量为_____ kJ·mol-l。
(2)反应ⅱ在某催化剂作用下,可能的反应历程如下(*表示吸附在催化剂表面),请写出步骤Ⅱ的方程式。
I.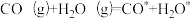
Ⅱ._____ 。
Ⅲ.
Ⅳ.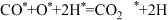
V.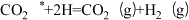
(3)相同条件下,随者反应温度的升高,化学平衡常数Kx1、Kx3的比值(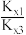 )
)_____ (填“增大”“减小”或“不变”),其原因为_____ 。
(4)T℃时,向2L恒容密闭容器中充入1molCH4和2molH2O(g),发生上述反应i和ⅲ。测得反应达到平衡时,容器中n(CH4)=0.4mol,n(H2)=2mol。
①T℃时,反应中H2O的平衡转化率为_____ 。
②T℃时,反应i的平衡常数Kx1=_____ (列出表达式,无需化简)。
③若将容器的体积压缩为1L,甲烷的平衡转化率_____ (填“增大”“减小”或“不变”,下同),反应ⅲ的逆反应速率_____ 。
④下列图像正确且能表明tmin时反应i达到化学平衡状态的是_____ (填字母)。
A.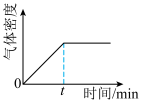 B.
B.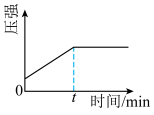 C.
C.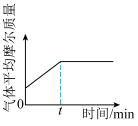 D.
D.
| 相关反应 | △H | 物质的量分数平衡常数 | |
| 反应i | 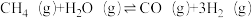 |  | Kx1 |
| 反应ⅱ | 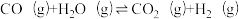 |  | Kx2 |
| 反应iii | 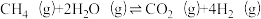 | 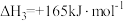 | Kx3 |
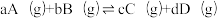 的物质的量分数平衡常数
的物质的量分数平衡常数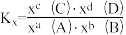 ,其中x(A)、x(B)、x(C)、x(D)为各组分的物质的量分数。
,其中x(A)、x(B)、x(C)、x(D)为各组分的物质的量分数。请回答下列问题:
(1)298K时,有关物质的相对能量如下表所示。
| 物质 | CO(g) | H2O(g) | H2(g) |
| 相对能量/(kJ·mol-1) | -110.5 | -241.8 | 0 |
(2)反应ⅱ在某催化剂作用下,可能的反应历程如下(*表示吸附在催化剂表面),请写出步骤Ⅱ的方程式。
I.
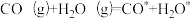
Ⅱ.
Ⅲ.

Ⅳ.
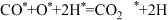
V.
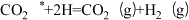
(3)相同条件下,随者反应温度的升高,化学平衡常数Kx1、Kx3的比值(
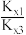 )
)(4)T℃时,向2L恒容密闭容器中充入1molCH4和2molH2O(g),发生上述反应i和ⅲ。测得反应达到平衡时,容器中n(CH4)=0.4mol,n(H2)=2mol。
①T℃时,反应中H2O的平衡转化率为
②T℃时,反应i的平衡常数Kx1=
③若将容器的体积压缩为1L,甲烷的平衡转化率
④下列图像正确且能表明tmin时反应i达到化学平衡状态的是
A.
 B.
B. C.
C. D.
D.
您最近半年使用:0次
9 . 甲醛释氢对氢能源和含甲醛污水处理有重要意义。
(1)HCHO电催化释氢
催化电解含较低浓度的HCHO、NaOH混合溶液,可获得 与HCOONa(如图所示),其中电极b表面覆盖一种Mo与P形成的化合物(晶胞结构如图所示)作催化剂。
与HCOONa(如图所示),其中电极b表面覆盖一种Mo与P形成的化合物(晶胞结构如图所示)作催化剂。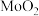 与
与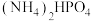 混合物与
混合物与 高温灼烧制得(反应中N元素化合价不变),该反应的化学方程式为
高温灼烧制得(反应中N元素化合价不变),该反应的化学方程式为_________________ 。
②电解时,电极b上同时产生 与
与 的物质的量之比为1∶2,则电极b上的电极反应式为
的物质的量之比为1∶2,则电极b上的电极反应式为_____________ 。
③电解过程中每产生1 mol ,通过阴离子交换膜的
,通过阴离子交换膜的 为
为______ mol。
(2)HCHO水化释氢
45℃时,碱性条件下Ag作催化剂可将甲醛转化为 ,反应的机理如图所示。
,反应的机理如图所示。 表面以防止纳米Ag团聚。其他条件不变,反应相同时间,NaOH浓度对氢气产生快慢的影响如图所示。
表面以防止纳米Ag团聚。其他条件不变,反应相同时间,NaOH浓度对氢气产生快慢的影响如图所示。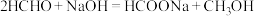 。
。
①若将甲醛中的氢用D原子标记为DCDO,得到的氢气产物为_______ (填化学式)。
②NaOH浓度低于1 mol⋅L 时,NaOH浓度增大产生氢气会加快的原因是
时,NaOH浓度增大产生氢气会加快的原因是__________ 。
③若NaOH浓度过大, 的产生迅速减慢的原因可能是
的产生迅速减慢的原因可能是__________________ 。
(3)甲烷与水在催化剂作用下可产生氢气与碳氧化物,与甲烷水化法制氢气相比,甲醛制氢的优点有______________ 。
(1)HCHO电催化释氢
催化电解含较低浓度的HCHO、NaOH混合溶液,可获得
 与HCOONa(如图所示),其中电极b表面覆盖一种Mo与P形成的化合物(晶胞结构如图所示)作催化剂。
与HCOONa(如图所示),其中电极b表面覆盖一种Mo与P形成的化合物(晶胞结构如图所示)作催化剂。
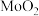 与
与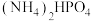 混合物与
混合物与 高温灼烧制得(反应中N元素化合价不变),该反应的化学方程式为
高温灼烧制得(反应中N元素化合价不变),该反应的化学方程式为②电解时,电极b上同时产生
 与
与 的物质的量之比为1∶2,则电极b上的电极反应式为
的物质的量之比为1∶2,则电极b上的电极反应式为③电解过程中每产生1 mol
 ,通过阴离子交换膜的
,通过阴离子交换膜的 为
为(2)HCHO水化释氢
45℃时,碱性条件下Ag作催化剂可将甲醛转化为
 ,反应的机理如图所示。
,反应的机理如图所示。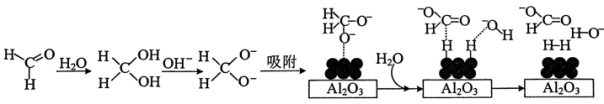
 表面以防止纳米Ag团聚。其他条件不变,反应相同时间,NaOH浓度对氢气产生快慢的影响如图所示。
表面以防止纳米Ag团聚。其他条件不变,反应相同时间,NaOH浓度对氢气产生快慢的影响如图所示。
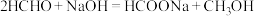 。
。①若将甲醛中的氢用D原子标记为DCDO,得到的氢气产物为
②NaOH浓度低于1 mol⋅L
 时,NaOH浓度增大产生氢气会加快的原因是
时,NaOH浓度增大产生氢气会加快的原因是③若NaOH浓度过大,
 的产生迅速减慢的原因可能是
的产生迅速减慢的原因可能是(3)甲烷与水在催化剂作用下可产生氢气与碳氧化物,与甲烷水化法制氢气相比,甲醛制氢的优点有
您最近半年使用:0次
2024-03-24更新
|
610次组卷
|
3卷引用:2024届河南省信阳高级中学高三下学期模拟考试(十六)理科综合试题-高中化学
名校
解题方法
10 . 在催化剂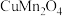 表面的
表面的 选择性催化还原NO的反应机理如下图所示(如)
选择性催化还原NO的反应机理如下图所示(如) 吸附在催化剂表面可表示为
吸附在催化剂表面可表示为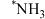 ,Ea表示活化能)。
,Ea表示活化能)。
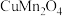 表面的
表面的 选择性催化还原NO的反应机理如下图所示(如)
选择性催化还原NO的反应机理如下图所示(如) 吸附在催化剂表面可表示为
吸附在催化剂表面可表示为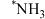 ,Ea表示活化能)。
,Ea表示活化能)。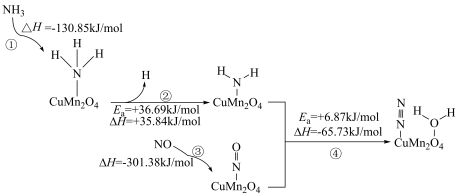
| A.该反应温度越高,反应速率越快 |
B. 比NO更易被催化剂 比NO更易被催化剂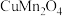 吸附 吸附 |
| C.反应过程中有非极性键的断裂与极性键的形成 |
D.决定总反应速率的基元反应可表示为: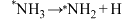 |
您最近半年使用:0次
2024-03-09更新
|
281次组卷
|
3卷引用:2024届河南省信阳高级中学高三下学期模拟考试(十六)理科综合试题-高中化学



