名校
解题方法
1 . 选择性催化还原法(SCR法)去除 是脱硝问题研究的热点,催化剂的选取是技术的核心。
是脱硝问题研究的热点,催化剂的选取是技术的核心。
(1)以 为催化剂的催化原理:
为催化剂的催化原理: 与
与 形成能提供氢离子的酸性位(如图所示),
形成能提供氢离子的酸性位(如图所示), 吸附在酸性位上生成中间体继续与NO反应。
吸附在酸性位上生成中间体继续与NO反应。
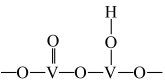
①五价钒在pH为10~13的溶液中会以焦钒酸根( )形式存在,请写出该离子的结构式
)形式存在,请写出该离子的结构式___________ ;
②其他条件相同, 、NO以一定速率,通过一定量
、NO以一定速率,通过一定量 催化剂催化脱硝,当NO含量一定,
催化剂催化脱硝,当NO含量一定,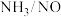 比值大于1.0后NO脱除率变化不大,其原因可能是
比值大于1.0后NO脱除率变化不大,其原因可能是___________ 。
(2)以 为催化剂的反应机理如图1所示:
为催化剂的反应机理如图1所示:

①请写出脱硝过程中总反应方程式:___________ 。
②NO脱除率随温度变化如图2所示,温度高于1000℃时NO脱除率明显下降,可能原因是:___________ 。
(3)以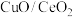 为催化剂
为催化剂
①理想 晶胞如图3所示,实际晶体中会含有部分氧空位。部分
晶胞如图3所示,实际晶体中会含有部分氧空位。部分 填充在由
填充在由 构成的
构成的___________ (填“四面体”或“八面体”)空隙中。

②Cu基催化剂对于使用CO脱去NO有着极为优异的催化性能,现探究不同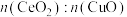 情况下脱硝、脱碳的情况。已知反应机理是CO首先吸附在
情况下脱硝、脱碳的情况。已知反应机理是CO首先吸附在 或CuO表面的活性位点上,由图像可以推断,CO反应的活性位点位于
或CuO表面的活性位点上,由图像可以推断,CO反应的活性位点位于___________ 上(填“ ”或“CuO”);
”或“CuO”);
③测定某催化剂中 质量分数,取催化剂产品0.8000g,用30mL高氯酸和20mL磷酸混合液加热溶解,冷却至室温后,用
质量分数,取催化剂产品0.8000g,用30mL高氯酸和20mL磷酸混合液加热溶解,冷却至室温后,用 硫酸亚铁铵[
硫酸亚铁铵[ ]溶液滴定,已知滴定时发生反应为
]溶液滴定,已知滴定时发生反应为 ,达到滴定终点时消耗硫酸亚铁铵溶液20.50mL,则该产品的纯度为
,达到滴定终点时消耗硫酸亚铁铵溶液20.50mL,则该产品的纯度为___________ (写出计算过程 ,计算结果保留4位有效数字)
 是脱硝问题研究的热点,催化剂的选取是技术的核心。
是脱硝问题研究的热点,催化剂的选取是技术的核心。(1)以
 为催化剂的催化原理:
为催化剂的催化原理: 与
与 形成能提供氢离子的酸性位(如图所示),
形成能提供氢离子的酸性位(如图所示), 吸附在酸性位上生成中间体继续与NO反应。
吸附在酸性位上生成中间体继续与NO反应。
①五价钒在pH为10~13的溶液中会以焦钒酸根(
 )形式存在,请写出该离子的结构式
)形式存在,请写出该离子的结构式②其他条件相同,
 、NO以一定速率,通过一定量
、NO以一定速率,通过一定量 催化剂催化脱硝,当NO含量一定,
催化剂催化脱硝,当NO含量一定,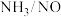 比值大于1.0后NO脱除率变化不大,其原因可能是
比值大于1.0后NO脱除率变化不大,其原因可能是(2)以
 为催化剂的反应机理如图1所示:
为催化剂的反应机理如图1所示:
①请写出脱硝过程中总反应方程式:
②NO脱除率随温度变化如图2所示,温度高于1000℃时NO脱除率明显下降,可能原因是:
(3)以
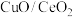 为催化剂
为催化剂①理想
 晶胞如图3所示,实际晶体中会含有部分氧空位。部分
晶胞如图3所示,实际晶体中会含有部分氧空位。部分 填充在由
填充在由 构成的
构成的
②Cu基催化剂对于使用CO脱去NO有着极为优异的催化性能,现探究不同
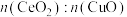 情况下脱硝、脱碳的情况。已知反应机理是CO首先吸附在
情况下脱硝、脱碳的情况。已知反应机理是CO首先吸附在 或CuO表面的活性位点上,由图像可以推断,CO反应的活性位点位于
或CuO表面的活性位点上,由图像可以推断,CO反应的活性位点位于 ”或“CuO”);
”或“CuO”);③测定某催化剂中
 质量分数,取催化剂产品0.8000g,用30mL高氯酸和20mL磷酸混合液加热溶解,冷却至室温后,用
质量分数,取催化剂产品0.8000g,用30mL高氯酸和20mL磷酸混合液加热溶解,冷却至室温后,用 硫酸亚铁铵[
硫酸亚铁铵[ ]溶液滴定,已知滴定时发生反应为
]溶液滴定,已知滴定时发生反应为 ,达到滴定终点时消耗硫酸亚铁铵溶液20.50mL,则该产品的纯度为
,达到滴定终点时消耗硫酸亚铁铵溶液20.50mL,则该产品的纯度为
您最近半年使用:0次
解题方法
2 . 研究氮氧化物的转化机理对环境保护具有重要意义。请回答下列问题:
(1)N2O是硝酸工业中氨催化氧化的副产物,CO处理N2O的原理为CO+N2O=N2+CO2。
①硝酸工业中氨被氧化成一氧化氮,生成的一氧化氮被反应后残余的氧气继续氧化为二氧化氮,随后将二氧化氮通入水中制取硝酸。写出一氧化氮到硝酸的总化学方程式:____________ 。
②在Fe+作用下,反应CO+N2O=N2+CO2分两步进行,已知第ⅰ步反应为
N2O+Fe+=N2+FeO+,试写出第ⅱ步反应的方程式:____________ 。
(2)处理 NO2的原理之一为2NO2(g)+2C(s) N2(g)+2CO2(g)。一定温度下,在2L恒容密闭容器中充入1molNO2和足量C发生该反应(不考虑2NO2
N2(g)+2CO2(g)。一定温度下,在2L恒容密闭容器中充入1molNO2和足量C发生该反应(不考虑2NO2 N2O4)。
N2O4)。
①实验测得NO2的转化率与时间的关系如图所示:
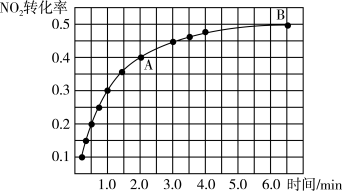
反应达到平衡时CO2的体积分数为____________ ,混合气体的平均摩尔质量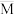 (A)
(A)____________ 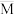 (B) (填“大于”“小于”或“等于”)。
(B) (填“大于”“小于”或“等于”)。
②下列能够判断该反应已达到平衡状态的是____________ (填序号)。
A.CO2的质量分数保持不变
B.容器中CO2与N2的百分含量之比保持不变
C.2v逆(NO2)=v正(N2)
D.混合气体的颜色保持不变
(3)羟基自由基(·OH)也可以用于脱硫脱硝。图表示光催化氧化技术可生成·OH,光照时,价带失去电子产生空穴(h+,具有强氧化性),价带上H2O直接转化为·OH, 在导带获得电子生成H2O2或
在导带获得电子生成H2O2或 ,最终转化为·OH。
,最终转化为·OH。

①价带上H2O遇h+直接转化为·OH的反应式可表示为______ ;
②在净化器中·OH与NO反应的化学方程式可表示为______ 。
(1)N2O是硝酸工业中氨催化氧化的副产物,CO处理N2O的原理为CO+N2O=N2+CO2。
①硝酸工业中氨被氧化成一氧化氮,生成的一氧化氮被反应后残余的氧气继续氧化为二氧化氮,随后将二氧化氮通入水中制取硝酸。写出一氧化氮到硝酸的总化学方程式:
②在Fe+作用下,反应CO+N2O=N2+CO2分两步进行,已知第ⅰ步反应为
N2O+Fe+=N2+FeO+,试写出第ⅱ步反应的方程式:
(2)处理 NO2的原理之一为2NO2(g)+2C(s)
 N2(g)+2CO2(g)。一定温度下,在2L恒容密闭容器中充入1molNO2和足量C发生该反应(不考虑2NO2
N2(g)+2CO2(g)。一定温度下,在2L恒容密闭容器中充入1molNO2和足量C发生该反应(不考虑2NO2 N2O4)。
N2O4)。①实验测得NO2的转化率与时间的关系如图所示:

反应达到平衡时CO2的体积分数为
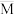 (A)
(A)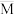 (B) (填“大于”“小于”或“等于”)。
(B) (填“大于”“小于”或“等于”)。②下列能够判断该反应已达到平衡状态的是
A.CO2的质量分数保持不变
B.容器中CO2与N2的百分含量之比保持不变
C.2v逆(NO2)=v正(N2)
D.混合气体的颜色保持不变
(3)羟基自由基(·OH)也可以用于脱硫脱硝。图表示光催化氧化技术可生成·OH,光照时,价带失去电子产生空穴(h+,具有强氧化性),价带上H2O直接转化为·OH,
 在导带获得电子生成H2O2或
在导带获得电子生成H2O2或 ,最终转化为·OH。
,最终转化为·OH。
①价带上H2O遇h+直接转化为·OH的反应式可表示为
②在净化器中·OH与NO反应的化学方程式可表示为
您最近半年使用:0次
2022-11-15更新
|
212次组卷
|
4卷引用:河南省安阳市2022-2023学年高三上学期期中考试化学试题
名校
3 . 为测试铁片中铁元素的含量,某课外活动小组提出下面方案并进行了实验。将0.200g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.0200mol•L-1的KMnO4溶液滴定,达到终点时消耗了25.00mLKMnO4溶液。
(1)配平以下方程式并标出电子转移的方同与数目:___ 。
H2SO4+KMnO4+FeSO4→MnSO4+Fe2(SO4)3+K2SO4+H2O
(2)铁片中铁元素的质量分数为___ ;若通过仪器分析发现该小组的测量结果偏高,以下可能的情况有___ 。
A.酸式滴定管洗净后,直接注入高锰酸钾溶液
B.洗净的锥形瓶,再用待测液润洗
C.锥形瓶中残留有少量蒸馏水
D.滴定至终点时,在滴定管尖嘴部位有气泡
(3)高锰酸钾溶液往往用硫酸酸化而不用盐酸酸化,原因是:___ 。
(4)Fe2(SO4)3溶液中c(Fe3+):c(SO )
)___ 2:3(填写“>”、“<”或“=”),用离子方程式解释:___ 。
(5)高锰酸钾在化学品生产中,广泛用作为氧化剂,可以氧化H2O2、Fe2+、S2-、SO 等多种物质。如H2O2+KMnO4+H2SO4→MnSO4+ +K2SO4+H2O,试推测空格上应填物质的化学式为
等多种物质。如H2O2+KMnO4+H2SO4→MnSO4+ +K2SO4+H2O,试推测空格上应填物质的化学式为___ 。
(6)上述反应在恒温下进行,该过程中会明显看到先慢后快的反应,原因可能是___ 。
(1)配平以下方程式并标出电子转移的方同与数目:
H2SO4+KMnO4+FeSO4→MnSO4+Fe2(SO4)3+K2SO4+H2O
(2)铁片中铁元素的质量分数为
A.酸式滴定管洗净后,直接注入高锰酸钾溶液
B.洗净的锥形瓶,再用待测液润洗
C.锥形瓶中残留有少量蒸馏水
D.滴定至终点时,在滴定管尖嘴部位有气泡
(3)高锰酸钾溶液往往用硫酸酸化而不用盐酸酸化,原因是:
(4)Fe2(SO4)3溶液中c(Fe3+):c(SO
 )
)(5)高锰酸钾在化学品生产中,广泛用作为氧化剂,可以氧化H2O2、Fe2+、S2-、SO
 等多种物质。如H2O2+KMnO4+H2SO4→MnSO4+ +K2SO4+H2O,试推测空格上应填物质的化学式为
等多种物质。如H2O2+KMnO4+H2SO4→MnSO4+ +K2SO4+H2O,试推测空格上应填物质的化学式为(6)上述反应在恒温下进行,该过程中会明显看到先慢后快的反应,原因可能是
您最近半年使用:0次
名校
解题方法
4 . 氮的化合物研究是环境科学的热点课题之一。
金属与不同密度硝酸溶液反应时,还原产物百分比与硝酸密度的关系下图所示:
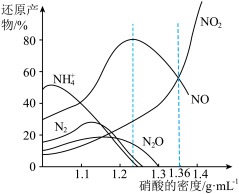
(1)当硝酸溶液的密度为1.36g.cm-3时,下列化学方程式中,能较准确表达Fe与过量硝酸反应的是(填序号)________________ 。
A.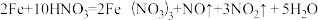
B.
C.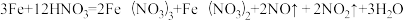
(2)现有一定量铝粉和铜粉的混合物与一定量很稀的硝酸溶液充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入5mo/L的NaOH溶液,所加NaOH溶液的体积与产生沉淀的物质的量关系如下图所示:
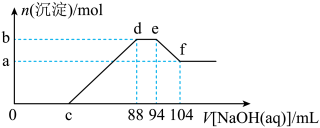
①c点对应NaOH溶液的体积为________________ mL;
②ef段发生反应的离子方程式为________________ 。
(3)研究表明硝酸与金属反应时,最容易生成亚硝酸(HNO2,弱酸),然后才转化成NO2,如果溶液中存在更强的氧化剂,如过氧化氢,它完全有能力将新产生的HNO2再氧化成HNO3,如图为金属在不同浓度的HNO3-H2O2混合溶液中的溶解速率和生成NOx的体积V的变化示意图:

①最佳溶解金属的混合溶液中HNO3的质量分数________________ 。
②H2O2与HNO2反应的化学方程式为________________ 。
(4)NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。NOx的储存和还原在不同时段交替进行,如图1所示:若用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,该过程分两步进行,图2表示该过程相关物质浓度随时间的变化关系。

①根据图1分析可以得出BaO的作用是________________ 。
②根据图2分析用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,第一步反应的化学方程为________________ 。
③还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有O2条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。请写出该反应的化学方程式________________ 。
金属与不同密度硝酸溶液反应时,还原产物百分比与硝酸密度的关系下图所示:

(1)当硝酸溶液的密度为1.36g.cm-3时,下列化学方程式中,能较准确表达Fe与过量硝酸反应的是(填序号)
A.
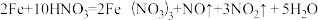
B.

C.
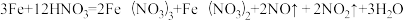
(2)现有一定量铝粉和铜粉的混合物与一定量很稀的硝酸溶液充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入5mo/L的NaOH溶液,所加NaOH溶液的体积与产生沉淀的物质的量关系如下图所示:

①c点对应NaOH溶液的体积为
②ef段发生反应的离子方程式为
(3)研究表明硝酸与金属反应时,最容易生成亚硝酸(HNO2,弱酸),然后才转化成NO2,如果溶液中存在更强的氧化剂,如过氧化氢,它完全有能力将新产生的HNO2再氧化成HNO3,如图为金属在不同浓度的HNO3-H2O2混合溶液中的溶解速率和生成NOx的体积V的变化示意图:

①最佳溶解金属的混合溶液中HNO3的质量分数
②H2O2与HNO2反应的化学方程式为
(4)NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。NOx的储存和还原在不同时段交替进行,如图1所示:若用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,该过程分两步进行,图2表示该过程相关物质浓度随时间的变化关系。

①根据图1分析可以得出BaO的作用是
②根据图2分析用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,第一步反应的化学方程为
③还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有O2条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。请写出该反应的化学方程式
您最近半年使用:0次
5 . 氨气广泛应用于化肥、制药、合成纤维等领域。工业上可由氢气和氮气合成氨气。若用 分别表示
分别表示 和固体催化剂,则在固体催化剂表面合成氨的过程如下图所示:
和固体催化剂,则在固体催化剂表面合成氨的过程如下图所示:

(1)吸附后,能量状态最高的是
(2)结合上述过程,一定温度下在固体催化剂表面进行
 的分解实验,发现
的分解实验,发现 的分解速率与其浓度的关系如下图所示。从吸附和解吸过程分析。
的分解速率与其浓度的关系如下图所示。从吸附和解吸过程分析。
①
 前反应速率增加的原因可能是
前反应速率增加的原因可能是②
 之后反应速率降低的原因可能是
之后反应速率降低的原因可能是(3)催化剂
 中的
中的 是活性组分。在反应器中以一定流速通过混合气
是活性组分。在反应器中以一定流速通过混合气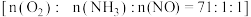 ,在不同温度下进行该催化反应,
,在不同温度下进行该催化反应, 的质量分数对单位时间内NO去除率的影响如下图所示。
的质量分数对单位时间内NO去除率的影响如下图所示。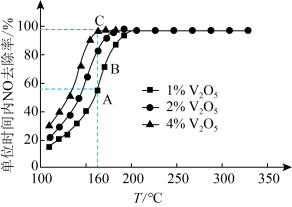
①从起始至对应A、B、C三点的平均反应速率由小到大的顺序为
② 的质量分数对该催化剂活性的影响是
的质量分数对该催化剂活性的影响是
(4)一定温度下,向1 L恒容密闭容器(含催化剂)中投入1 mol
 和1.5 mol NO,发生反应
和1.5 mol NO,发生反应 。达到平衡状态时,NO的转化率为60%,则平衡常数为
。达到平衡状态时,NO的转化率为60%,则平衡常数为 (列出计算式即可)。
(列出计算式即可)。
您最近半年使用:0次
6 . 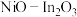 可协同催化
可协同催化 的氢化,体系中涉及以下两个反应:
的氢化,体系中涉及以下两个反应:
反应1:
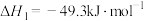
反应2:

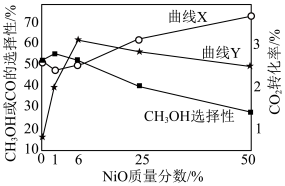
将一定比例的 、
、 以一定流速通过催化剂,在一定温度下反应,
以一定流速通过催化剂,在一定温度下反应, 的转化率、
的转化率、 或CO的选择性[
或CO的选择性[ ]与催化剂中NiO的质量分数的关系如图所示。下列说法正确的是
]与催化剂中NiO的质量分数的关系如图所示。下列说法正确的是
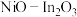 可协同催化
可协同催化 的氢化,体系中涉及以下两个反应:
的氢化,体系中涉及以下两个反应:反应1:

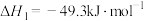
反应2:


将一定比例的
 、
、 以一定流速通过催化剂,在一定温度下反应,
以一定流速通过催化剂,在一定温度下反应, 的转化率、
的转化率、 或CO的选择性[
或CO的选择性[ ]与催化剂中NiO的质量分数的关系如图所示。下列说法正确的是
]与催化剂中NiO的质量分数的关系如图所示。下列说法正确的是
A.反应 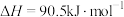 |
B.曲线Y表示 的转化率随催化剂中NiO的质量分数的变化 的转化率随催化剂中NiO的质量分数的变化 |
C.其他条件不变,催化剂中NiO的质量分数为1%时, 的产率最高 的产率最高 |
D.其他条件不变,NiO的质量分数从25%增加到50%, 的平衡选择性降低 的平衡选择性降低 |
您最近半年使用:0次
2023-11-13更新
|
635次组卷
|
4卷引用:江苏省苏州市2023-2024学年高三上学期11月期中考试化学试题
江苏省苏州市2023-2024学年高三上学期11月期中考试化学试题(已下线)选择题11-14(已下线)题型04 化学反应速率与平衡图像分析-2024年高考化学答题技巧与模板构建江苏省苏州市2023~2024学年高三上学期期中调研化学试题
名校
7 .  是一种强氧化剂,能分解成
是一种强氧化剂,能分解成 和
和 。图甲表示
。图甲表示 分解时能量与反应进程的关系,图乙为
分解时能量与反应进程的关系,图乙为 酶的相对活性与温度、时间的关系,图丙为相同浓度的
酶的相对活性与温度、时间的关系,图丙为相同浓度的 溶液在
溶液在 时,混合体系中
时,混合体系中 的质量分数与
的质量分数与 、时间的关系。
、时间的关系。

下列说法正确的是
 是一种强氧化剂,能分解成
是一种强氧化剂,能分解成 和
和 。图甲表示
。图甲表示 分解时能量与反应进程的关系,图乙为
分解时能量与反应进程的关系,图乙为 酶的相对活性与温度、时间的关系,图丙为相同浓度的
酶的相对活性与温度、时间的关系,图丙为相同浓度的 溶液在
溶液在 时,混合体系中
时,混合体系中 的质量分数与
的质量分数与 、时间的关系。
、时间的关系。
下列说法正确的是
A.反应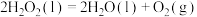 为吸热反应 为吸热反应 |
| B.催化剂改变该反应的活化能和焓变 |
C.相同浓度的 溶液用过氧化氢酶催化时,温度越高分解速率一定越快 溶液用过氧化氢酶催化时,温度越高分解速率一定越快 |
D.其他条件一定,碱性增强有利于 的分解 的分解 |
您最近半年使用:0次
8 . 在下列四支试管中发生反应:2H2O2=2H2O+O2↑,产生O2速率最大是
| 试管 | 温度 | 过氧化氢的质量分数 | 催化剂 |
| A | 25℃ | 3% | 无 |
| B | 50℃ | 3% | 无 |
| C | 25℃ | 6% | 无 |
| D | 50℃ | 6% | 有 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
9 . 阅读题目,回答问题:
(1)FeCl3常用于腐蚀印刷电路铜板,若将此反应设计成原电池,请写出该原电池正极电极反应为___________ 。
(2)为探究 在
在 制取
制取 反应中的作用,某兴趣小组进行下列实验:向试管中加入
反应中的作用,某兴趣小组进行下列实验:向试管中加入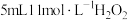 溶液,静置几分钟,无明显现象;滴加2滴
溶液,静置几分钟,无明显现象;滴加2滴 溶液,立即产生大量气泡,加
溶液,立即产生大量气泡,加 溶液反应
溶液反应 后,
后, 的浓度变为
的浓度变为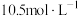 ,则20min内H2O2的平均反应速率为
,则20min内H2O2的平均反应速率为___________ 。
(3)H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等。某兴趣小组为探究外界条件对H2O2分解反应速率的影响,设计如表所示实验。填写表中空白内容:
(4)如图装置可以把氢气中蕴含的化学能转化为电能,被称为氢氧燃料电池。
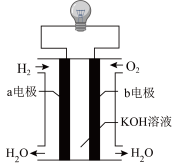
①该电池的正极是电极___________ (填“a”或“b”),负极发生反应的方程式为___________ 。
②电池工作时,当外电路中转移 电子时,消耗的
电子时,消耗的 在标准状况下体积为
在标准状况下体积为___________ 。
(1)FeCl3常用于腐蚀印刷电路铜板,若将此反应设计成原电池,请写出该原电池正极电极反应为
(2)为探究
 在
在 制取
制取 反应中的作用,某兴趣小组进行下列实验:向试管中加入
反应中的作用,某兴趣小组进行下列实验:向试管中加入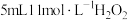 溶液,静置几分钟,无明显现象;滴加2滴
溶液,静置几分钟,无明显现象;滴加2滴 溶液,立即产生大量气泡,加
溶液,立即产生大量气泡,加 溶液反应
溶液反应 后,
后, 的浓度变为
的浓度变为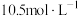 ,则20min内H2O2的平均反应速率为
,则20min内H2O2的平均反应速率为(3)H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等。某兴趣小组为探究外界条件对H2O2分解反应速率的影响,设计如表所示实验。填写表中空白内容:
| 试管编号 | 实验目的 |  溶液 溶液 | 温度 | 水的体积/mL |  溶液体积/mL 溶液体积/mL | |
| 质量分数 | 体积/mL | |||||
| I | 为编号Ⅱ实验的参照 | 12% | 5.0 | 常温 | 0 | 0 |
| Ⅱ | 温度对反应速率的影响 | 12% | 5.0 | 60℃ | 0 | 0 |
| Ⅲ | 为编号Ⅳ实验的参照 | 4.0% | 5.0 | 常温 | ① | 0 |
| Ⅳ | ② | 4.0% | 5.0 | 常温 | 0 | 1.0 |

①该电池的正极是电极
②电池工作时,当外电路中转移
 电子时,消耗的
电子时,消耗的 在标准状况下体积为
在标准状况下体积为
您最近半年使用:0次
2023-05-16更新
|
216次组卷
|
2卷引用:广东省广州市第六十五中学2022-2023学年高一下学期期中考试化学试题
名校
10 . 对于可逆反应mA(g)+nB(s)  pC(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D %与温度T或压强p的关系如图所示,下列说法正确的是
pC(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D %与温度T或压强p的关系如图所示,下列说法正确的是
 pC(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D %与温度T或压强p的关系如图所示,下列说法正确的是
pC(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D %与温度T或压强p的关系如图所示,下列说法正确的是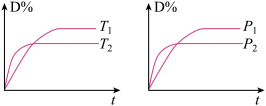
| A.降温,化学平衡向正反应方向移动 |
| B.使用催化剂可使D%有所增加 |
| C.化学方程式中化学计量数m+n<p+q |
| D.升温,A的转化率提高 |
您最近半年使用:0次
2023-04-25更新
|
413次组卷
|
4卷引用:青海省西宁市六校联考2022-2023学年高二上学期期末考试化学试题
青海省西宁市六校联考2022-2023学年高二上学期期末考试化学试题(已下线)专题04 化学平衡-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)安徽省合肥市第一中学2023-2024学年高二上学期12月月考化学试题天津市武清区河西务中学2023-2024学年高二上学期第二次月考化学试卷



