名校
1 . 研发 CO2 利用技术成为了研究热点,某科研团队采用一种类似“搭积木”的方式,在实验室中首次实现从二氧化碳到淀粉分子的全合成,“积木”中涉及如下两个反应:① CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ②CH3OH(g)+O2(g)
CH3OH(g)+H2O(g) ②CH3OH(g)+O2(g)  HCHO(g)+H2O2(l)。完成填空:
HCHO(g)+H2O2(l)。完成填空:
(1)一定温度下,往 5L 反应釜中充入 1molCO2、3molH2,反应 5min,气体总的物质的量减少了 20%,则 0~5min 内,H2 的平均反应速率 v=_______ 。
(2)反应②的平衡表达式 K=_______ 。
(3)将同体积的 CH3OH(g)与 O2(g)充入反应器中,平衡时 v 正(O2)、c(O2)与温度的关系如图所示:
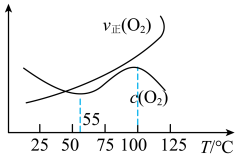
反应②为______ 反应(选填:放热或吸热)。55~100℃时,O2 的物质的量浓度随温度升高而增大的原因是________ 。
(4)反应②常会有副产物 HCOOH 产生,HCOOH 溶液呈______ (选填酸性、中性、碱性) 。并设计实验证明该性质_________ 。
(5)写出 HCOOH 与 CH3CH2OH 反应的化学方程式___________ 。反应类型_______ 。
 CH3OH(g)+H2O(g) ②CH3OH(g)+O2(g)
CH3OH(g)+H2O(g) ②CH3OH(g)+O2(g)  HCHO(g)+H2O2(l)。完成填空:
HCHO(g)+H2O2(l)。完成填空:(1)一定温度下,往 5L 反应釜中充入 1molCO2、3molH2,反应 5min,气体总的物质的量减少了 20%,则 0~5min 内,H2 的平均反应速率 v=
(2)反应②的平衡表达式 K=
(3)将同体积的 CH3OH(g)与 O2(g)充入反应器中,平衡时 v 正(O2)、c(O2)与温度的关系如图所示:

反应②为
(4)反应②常会有副产物 HCOOH 产生,HCOOH 溶液呈
(5)写出 HCOOH 与 CH3CH2OH 反应的化学方程式
您最近一年使用:0次
名校
解题方法
2 . 回答下列问题。
(1)为探究 与
与 的还原性强弱,取适量制得的
的还原性强弱,取适量制得的 晶体,进行如下实验:
晶体,进行如下实验:
将适量 加入
加入 溶液中,若观察到
溶液中,若观察到___________ ,则可证明还原性 ;实际发现溶液产生红褐色沉淀,并闻到臭鸡蛋气味气体,请从平衡移动的角度解释上述现象:
;实际发现溶液产生红褐色沉淀,并闻到臭鸡蛋气味气体,请从平衡移动的角度解释上述现象:___________ 。
(2)为了证明 可以氧化
可以氧化 溶液中的
溶液中的 ,某同学设计了一个原电池装置,并正确绘制了其工作原理示意图,但不慎被污渍遮住了部分内容(如下图),请“复原”该示意图:
,某同学设计了一个原电池装置,并正确绘制了其工作原理示意图,但不慎被污渍遮住了部分内容(如下图),请“复原”该示意图:___________

(1)为探究
 与
与 的还原性强弱,取适量制得的
的还原性强弱,取适量制得的 晶体,进行如下实验:
晶体,进行如下实验:将适量
 加入
加入 溶液中,若观察到
溶液中,若观察到 ;实际发现溶液产生红褐色沉淀,并闻到臭鸡蛋气味气体,请从平衡移动的角度解释上述现象:
;实际发现溶液产生红褐色沉淀,并闻到臭鸡蛋气味气体,请从平衡移动的角度解释上述现象:(2)为了证明
 可以氧化
可以氧化 溶液中的
溶液中的 ,某同学设计了一个原电池装置,并正确绘制了其工作原理示意图,但不慎被污渍遮住了部分内容(如下图),请“复原”该示意图:
,某同学设计了一个原电池装置,并正确绘制了其工作原理示意图,但不慎被污渍遮住了部分内容(如下图),请“复原”该示意图:
您最近一年使用:0次
名校
解题方法
3 . 痛风是以关节炎反复发作及产生肾结石为特征的一类疾病,关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下:① ,②
,②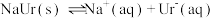 。已知:37℃时,
。已知:37℃时,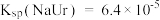 。
。
(1)关节炎发作大多在脚趾和手指的关节处,夏天症状减轻,冬天症状加重,说明反应②是
(2)下列事实可以证明尿酸是弱电解质的是___________
| A.HUr溶液可使石蕊溶液变红 | B.NaUr溶液显碱性 |
| C.常温下,等体积的尿酸溶液导电性比盐酸弱 | D.室温下测10mL0.01mol·L—1HUr溶液pH>2 |
A. | B.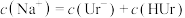 |
C.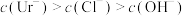 | D.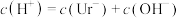 |
 。当向其中加入NaCl(s)至
。当向其中加入NaCl(s)至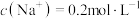 时,NaUr晶体
时,NaUr晶体
您最近一年使用:0次
2023-06-19更新
|
168次组卷
|
3卷引用:上海市嘉定区第一中学2022-2023学年高二上学期期末(等级)考试化学试题
上海市嘉定区第一中学2022-2023学年高二上学期期末(等级)考试化学试题(已下线)专题06 酸碱中和与盐类水解及难溶电解质的沉淀溶解平衡-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(上海专用)陕西省汉中市南郑区铁佛中学2023-2024学年高二上学期12月月考化学试题
名校
4 . 现代医学证明“痛风”的病因与关节滑液中形成尿酸钠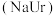 晶体有关,尤其在寒冷季节易诱发关节疼痛。主要原理为:
晶体有关,尤其在寒冷季节易诱发关节疼痛。主要原理为:
①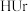 (尿酸)
(尿酸)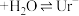 (尿酸离子)
(尿酸离子)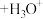
②
下列叙述错误 的是
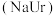 晶体有关,尤其在寒冷季节易诱发关节疼痛。主要原理为:
晶体有关,尤其在寒冷季节易诱发关节疼痛。主要原理为:①
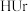 (尿酸)
(尿酸)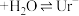 (尿酸离子)
(尿酸离子)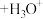
②

下列叙述
| A.①是尿酸的电离方程式 |
B.反应②的 ,因此热敷能减轻关节疼痛 ,因此热敷能减轻关节疼痛 |
| C.饮食中摄入过多食盐,容易诱发痛风 |
| D.“痛风”患者应控制摄入产生较多尿酸的食物 |
您最近一年使用:0次
2023-01-12更新
|
145次组卷
|
3卷引用:上海市七宝中学2022-2023学年高二上学期期末考试化学试题
上海市七宝中学2022-2023学年高二上学期期末考试化学试题(已下线)专题03 化学反应进行的方向和限度-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(上海专用)课时3影响化学平衡的因素随堂练习
名校
5 . 硫酸亚铁晶体(FeSO4●7H2O)在医药上作补血剂。工业上用废铁生产FeSO4●7H2O的一种流程如图所示:
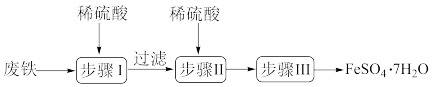
(1)步骤Ⅰ中除铁和硫酸、铁锈和硫酸反应外,还有一个反应的化学方程式为:___________ 。
(2)证明步骤I滤液中只含有 的方法:取样,先滴加
的方法:取样,先滴加___________ ,再滴加___________ (填试剂,名称),该过程的现象___________ 。
(3)步骤Ⅲ从硫酸亚铁溶液中获得硫酸亚铁晶体( )的实验操作为蒸发浓缩、冷却结晶、
)的实验操作为蒸发浓缩、冷却结晶、___________ 、冰水洗涤、烘干。烘干操作需在低温条件下进行,原因是:___________ 。
(4)将FeCl3和KSCN溶液混合,发生可逆反应: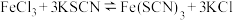 ,已知反应处于平衡状态中,现改变条件请回答下列问题:
,已知反应处于平衡状态中,现改变条件请回答下列问题:
向上述混合液中,若加入少量 固体后,混合溶液红色
固体后,混合溶液红色___________ ;若加入少量 粉后,混合溶液红色
粉后,混合溶液红色___________ ;若加入少量 固体后,混合溶液红色
固体后,混合溶液红色___________ ;若加入 溶液后,混合溶液红色
溶液后,混合溶液红色___________ 。(填“变深”、“变浅”或“不变”;注意,溶液中加入少量固体可以忽略体积变化)

(1)步骤Ⅰ中除铁和硫酸、铁锈和硫酸反应外,还有一个反应的化学方程式为:
(2)证明步骤I滤液中只含有
 的方法:取样,先滴加
的方法:取样,先滴加(3)步骤Ⅲ从硫酸亚铁溶液中获得硫酸亚铁晶体(
 )的实验操作为蒸发浓缩、冷却结晶、
)的实验操作为蒸发浓缩、冷却结晶、(4)将FeCl3和KSCN溶液混合,发生可逆反应:
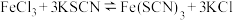 ,已知反应处于平衡状态中,现改变条件请回答下列问题:
,已知反应处于平衡状态中,现改变条件请回答下列问题:向上述混合液中,若加入少量
 固体后,混合溶液红色
固体后,混合溶液红色 粉后,混合溶液红色
粉后,混合溶液红色 固体后,混合溶液红色
固体后,混合溶液红色 溶液后,混合溶液红色
溶液后,混合溶液红色
您最近一年使用:0次
名校
6 . 弱电解质的电离平衡、盐类的水解平衡和难溶电解质的溶解平衡均属于化学学习中的动态平衡。
(1)已知室温时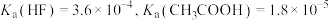
① 的
的 溶液与
溶液与 的
的 溶液相比,一定有
溶液相比,一定有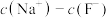
___________ 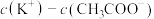 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
②向 溶液中滴加
溶液中滴加 溶液至
溶液至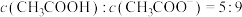 ,此时溶液
,此时溶液
___________ 。
(2)化学上常用 表示溶液中的酸碱度,
表示溶液中的酸碱度,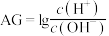 。
。 时,用
时,用 的
的 溶液滴定
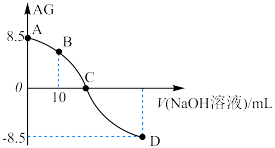
溶液滴定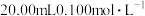 某酸(HA)溶液,
某酸(HA)溶液, 与所加
与所加 溶液的体积(V)关系如图所示,B点溶液中:
溶液的体积(V)关系如图所示,B点溶液中:
___________  (填“>”、“=”或“<”,下同)。
(填“>”、“=”或“<”,下同)。
(3) 时,将
时,将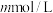 的醋酸钠溶液与
的醋酸钠溶液与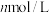 盐酸溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数
盐酸溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数
___________ (用含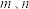 的代数式表示)。
的代数式表示)。
(4) 溶液中存在多个平衡
溶液中存在多个平衡
(i)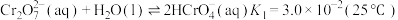
(ii)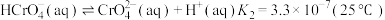
①下列有关 溶液的说法正确的有
溶液的说法正确的有___________ 。
A.加入少量水稀释,溶液中离子总数增加
B.加入少量硫酸,溶液的 不变
不变
C.加入少量 固体,平衡时
固体,平衡时 与
与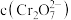 的比值保持不变
的比值保持不变
D.加入少量 溶液,反应(ⅰ)的平衡逆向移动
溶液,反应(ⅰ)的平衡逆向移动
② 时,
时,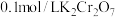 溶液中
溶液中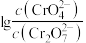 随
随 的变化关系如图。
的变化关系如图。
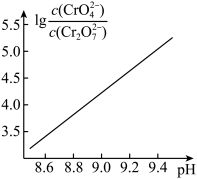
当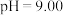 时,设
时,设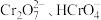 与
与 的平衡浓度分别为
的平衡浓度分别为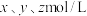 ,则
,则 之间的关系式为
之间的关系式为________  ;计算溶液中
;计算溶液中 的平衡浓度
的平衡浓度_______ (结果保留两位有效数字)。
(1)已知室温时
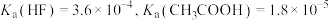
①
 的
的 溶液与
溶液与 的
的 溶液相比,一定有
溶液相比,一定有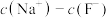
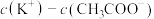 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。②向
 溶液中滴加
溶液中滴加 溶液至
溶液至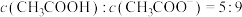 ,此时溶液
,此时溶液
(2)化学上常用
 表示溶液中的酸碱度,
表示溶液中的酸碱度,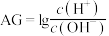 。
。 时,用
时,用 的
的 溶液滴定
溶液滴定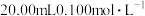 某酸(HA)溶液,
某酸(HA)溶液, 与所加
与所加 溶液的体积(V)关系如图所示,B点溶液中:
溶液的体积(V)关系如图所示,B点溶液中:
 (填“>”、“=”或“<”,下同)。
(填“>”、“=”或“<”,下同)。
(3)
 时,将
时,将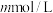 的醋酸钠溶液与
的醋酸钠溶液与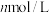 盐酸溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数
盐酸溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数
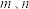 的代数式表示)。
的代数式表示)。(4)
 溶液中存在多个平衡
溶液中存在多个平衡(i)
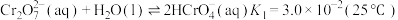
(ii)
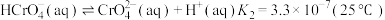
①下列有关
 溶液的说法正确的有
溶液的说法正确的有A.加入少量水稀释,溶液中离子总数增加
B.加入少量硫酸,溶液的
 不变
不变C.加入少量
 固体,平衡时
固体,平衡时 与
与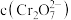 的比值保持不变
的比值保持不变D.加入少量
 溶液,反应(ⅰ)的平衡逆向移动
溶液,反应(ⅰ)的平衡逆向移动②
 时,
时,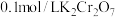 溶液中
溶液中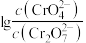 随
随 的变化关系如图。
的变化关系如图。
当
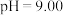 时,设
时,设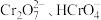 与
与 的平衡浓度分别为
的平衡浓度分别为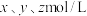 ,则
,则 之间的关系式为
之间的关系式为 ;计算溶液中
;计算溶液中 的平衡浓度
的平衡浓度
您最近一年使用:0次
2023-12-19更新
|
338次组卷
|
3卷引用:上海市宜川中学2023-2024学年高三上学期期末考试化学试题
上海市宜川中学2023-2024学年高三上学期期末考试化学试题山东省济宁市第一中学2023-2024学年高三上学期12月月考化学试题(已下线)专题05 盐类的水解-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)
名校
7 . I.肼(N2H4),又称联氨。
(1)肼在水中电离方式与NH3相似,若将NH3视为一元弱碱,则N2H4是一种二元弱碱。根据以上信息,推断下列关于N2H4的说法不正确的是___________。
(2)在实验室中,可以用次氯酸钠和氨气在常温下制备联氨,反应的离子方程式为:___________ 。
Ⅱ.一定温度下发生反应:
 。
。
(3)该温度下此反应的平衡常数表达式为___________ 。
(4)下列能够表明上述反应已达到平衡状态的有___________。
(5)写出一种提高N2H4平衡转化率的方法___________ 。
(1)肼在水中电离方式与NH3相似,若将NH3视为一元弱碱,则N2H4是一种二元弱碱。根据以上信息,推断下列关于N2H4的说法不正确的是___________。
| A.它与硫酸形成的酸式盐可以表示为N2H5HSO4 |
| B.它溶于水所得的溶液中共有4种离子 |
C.它溶于水发生电离的第一步可表示为: |
| D.若已知联氨和四氧化二氮可以做火箭推进剂,两者反应产物可以是氮气和水 |
Ⅱ.一定温度下发生反应:

 。
。(3)该温度下此反应的平衡常数表达式为
(4)下列能够表明上述反应已达到平衡状态的有___________。
A. |
| B.混合气体的平均相对分子质量不再改变 |
| C.气体密度不再改变 |
| D.体系温度不再改变 |
您最近一年使用:0次
名校
解题方法
8 . 由H、C、N、O、S等元素形成的多种化合物在生产生活中有着重要应用。
Ⅰ.研究表明,在催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:反应①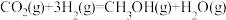
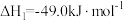
反应②
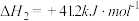
(1)关于上述反应①说法正确的是___________。
(2)恒容条件下,能说明反应②已经达到平衡状态的是___________。
(3)在恒容密闭容器中发生反应①,有利于提高CO2平衡转化率的措施有___________。
Ⅱ.T1时,将1.00 mol CO2和3.00molH2充入体积为1.00L的恒容密闭容器中发生反应①,已知容器起始压强为p0,经过3h反应达到平衡,平衡后混合气体的物质的量为3.00mol。
(4)达到平衡时,CO2的转化率为___________ 。
(5)该过程中H2的平均反应速率为___________ mol·L-1·h-1;
(6)写出反应①的平衡常数表达式K=___________ 。K可用反应体系中气体物质分压表示,即用平衡分压代替平衡浓度,分压=总压×物质的量分数。则上述反应的平衡常数KP=___________ (用含p0的代数式表示)。
Ⅰ.研究表明,在催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:反应①
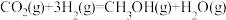
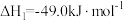
反应②

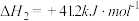
(1)关于上述反应①说法正确的是___________。
| A.△S>0 | B.△S<0 | C.低温自发 | D.高温自发 |
| A.混合气体的平均相对分子质量不变 | B.混合气体的密度不变 |
| C.v (H2)正=v (CO)正 | D.n(CO)/n(H2)不变 |
| A.降低反应温度 | B.增大压强(物质状态不变) |
| C.增大CO2的物质的量 | D.混合气体中掺入一定量惰性气体(不参与反应) |
Ⅱ.T1时,将1.00 mol CO2和3.00molH2充入体积为1.00L的恒容密闭容器中发生反应①,已知容器起始压强为p0,经过3h反应达到平衡,平衡后混合气体的物质的量为3.00mol。
(4)达到平衡时,CO2的转化率为
(5)该过程中H2的平均反应速率为
(6)写出反应①的平衡常数表达式K=
您最近一年使用:0次
名校
9 . Ⅰ.CO2催化加氢可以生成低碳有机物,有以下反应:
反应Ⅰ: ;
;
反应Ⅱ:
(1) 分子中化学键类型为
分子中化学键类型为___________ 。  分子的空间填充模型为
分子的空间填充模型为___________ 。
A.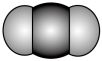 B.
B.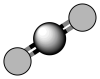
(2)已知反应Ⅰ是放热反应,能正确表示该反应的图示是___________ 。
A.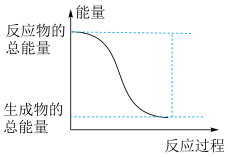 B.
B.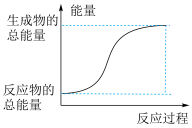
Ⅱ.在 密闭容器中,充入
密闭容器中,充入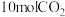 和
和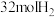 ,在催化剂、200℃条件下,发生反应Ⅰ,部分反应物和产物随时间变化如图所示:
,在催化剂、200℃条件下,发生反应Ⅰ,部分反应物和产物随时间变化如图所示:
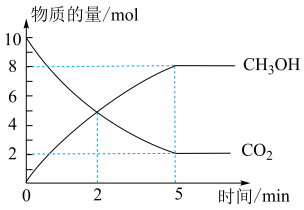
(3) 末,以
末,以  的浓度变化表示反应的平均速率为
的浓度变化表示反应的平均速率为___________  。
。
(4)下列措施中能增大反应速率且利于平衡正向移动的是___________。
(5)下列情况能说明该反应达到化学平衡状态的是___________ 。
A.单位时间内消耗 ,同时生成
,同时生成
B.密闭容器中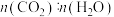 不发生变化
不发生变化
C.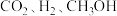 浓度之比为
浓度之比为 的状态
的状态
(6)储氢材料纳米碳管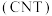 是空心管状的纳米级晶体,它有力地推动了氢氧燃料电池的开发。关于碳纳米管材料,下列说法错误的是
是空心管状的纳米级晶体,它有力地推动了氢氧燃料电池的开发。关于碳纳米管材料,下列说法错误的是___________ 。
A.与 是同素异形体
是同素异形体
B.表面积大,吸附能力强
C.和氢氧化铁胶体属于同种分散系
(7)某学生用铁棒、铜罐等材料设计了如图简易电池装置。
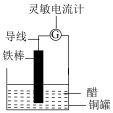
①该装置将___________ 能转化为___________ 能
A.电 B.化学
②___________ 发生氧化反应
A.铁棒 B.铜罐
反应Ⅰ:
 ;
;反应Ⅱ:

(1)
 分子中化学键类型为
分子中化学键类型为 分子的空间填充模型为
分子的空间填充模型为A.
 B.
B.
(2)已知反应Ⅰ是放热反应,能正确表示该反应的图示是
A.
 B.
B.
Ⅱ.在
 密闭容器中,充入
密闭容器中,充入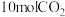 和
和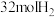 ,在催化剂、200℃条件下,发生反应Ⅰ,部分反应物和产物随时间变化如图所示:
,在催化剂、200℃条件下,发生反应Ⅰ,部分反应物和产物随时间变化如图所示:
(3)
 末,以
末,以  的浓度变化表示反应的平均速率为
的浓度变化表示反应的平均速率为 。
。(4)下列措施中能增大反应速率且利于平衡正向移动的是___________。
| A.升高反应温度 | B.将 与反应混合物分离 与反应混合物分离 |
| C.使用高效催化剂 | D.增大 浓度 浓度 |
(5)下列情况能说明该反应达到化学平衡状态的是
A.单位时间内消耗
 ,同时生成
,同时生成
B.密闭容器中
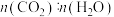 不发生变化
不发生变化C.
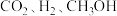 浓度之比为
浓度之比为 的状态
的状态(6)储氢材料纳米碳管
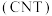 是空心管状的纳米级晶体,它有力地推动了氢氧燃料电池的开发。关于碳纳米管材料,下列说法错误的是
是空心管状的纳米级晶体,它有力地推动了氢氧燃料电池的开发。关于碳纳米管材料,下列说法错误的是A.与
 是同素异形体
是同素异形体B.表面积大,吸附能力强
C.和氢氧化铁胶体属于同种分散系
(7)某学生用铁棒、铜罐等材料设计了如图简易电池装置。

①该装置将
A.电 B.化学
②
A.铁棒 B.铜罐
您最近一年使用:0次
10 . 尿素 是一种重要的氮肥。工业上以
是一种重要的氮肥。工业上以 和
和 为原料合成尿素,在尿素合成塔中的主要反应可表示如下:
为原料合成尿素,在尿素合成塔中的主要反应可表示如下:
反应I: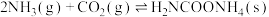 (氨基甲酸铵)
(氨基甲酸铵) 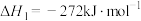
反应Ⅱ: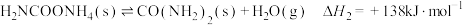
总反应Ⅲ: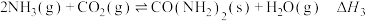
(1) 的电子式为
的电子式为___________ ; 中含有
中含有___________ 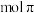 键。
键。
(2)反应I的熵变
___________ 0(填“>”“=”或“<”),反应Ⅲ的
___________ 。
(3)下列关于尿素合成的说法正确的是___________。
研究反应I的逆反应对提高尿素产率有重要意义。某研究学习小组把一定量的氨基甲酸铵固体放入容积为 的密闭容器中,在
的密闭容器中,在 下分解:
下分解: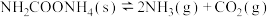 ,
,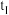 时达到化学平衡。
时达到化学平衡。 随时间
随时间 变化曲线如图所示。
变化曲线如图所示。

(4)可以判断该分解反应已经达到平衡的是___________。
(5) 时,该反应的化学平衡常数
时,该反应的化学平衡常数 的值为
的值为___________ 。
(6)在 时间内该化学反应速率
时间内该化学反应速率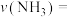
___________ 。
(7)若其他条件不变, 时将容器体积压缩到1L,
时将容器体积压缩到1L, 时达到新的平衡。请在图中画出
时达到新的平衡。请在图中画出 时间内
时间内 随时间
随时间 变化的曲线
变化的曲线___________ 。
 是一种重要的氮肥。工业上以
是一种重要的氮肥。工业上以 和
和 为原料合成尿素,在尿素合成塔中的主要反应可表示如下:
为原料合成尿素,在尿素合成塔中的主要反应可表示如下:反应I:
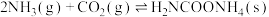 (氨基甲酸铵)
(氨基甲酸铵) 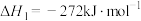
反应Ⅱ:
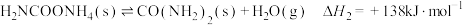
总反应Ⅲ:
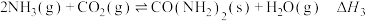
(1)
 的电子式为
的电子式为 中含有
中含有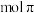 键。
键。(2)反应I的熵变


(3)下列关于尿素合成的说法正确的是___________。
| A.及时分离出尿素可促使反应Ⅱ向正反应方向移动 |
| B.从合成塔出来的混合气体分离出水蒸气后可以循环使用 |
| C.保持容积不变,充入惰性气体增大压强,可提高总反应Ⅲ的反应速率 |
D.保持压强不变,降低氨碳比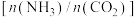 可提高反应I中 可提高反应I中 的平衡转化率 的平衡转化率 |
研究反应I的逆反应对提高尿素产率有重要意义。某研究学习小组把一定量的氨基甲酸铵固体放入容积为
 的密闭容器中,在
的密闭容器中,在 下分解:
下分解: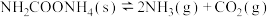 ,
,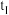 时达到化学平衡。
时达到化学平衡。 随时间
随时间 变化曲线如图所示。
变化曲线如图所示。
(4)可以判断该分解反应已经达到平衡的是___________。
| A.混合气体的平均摩尔质量不变 | B.密闭容器中总压强不变 |
| C.密闭容器中混合气体的密度不变 | D.密闭容器中氮气的体积分数不变 |
(5)
 时,该反应的化学平衡常数
时,该反应的化学平衡常数 的值为
的值为(6)在
 时间内该化学反应速率
时间内该化学反应速率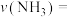
(7)若其他条件不变,
 时将容器体积压缩到1L,
时将容器体积压缩到1L, 时达到新的平衡。请在图中画出
时达到新的平衡。请在图中画出 时间内
时间内 随时间
随时间 变化的曲线
变化的曲线
您最近一年使用:0次



