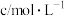1 . 高锰酸钾( )是化学实验中一种常用试剂.
)是化学实验中一种常用试剂.
I.某研究性学习小组利用 溶液和酸性
溶液和酸性 溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验方案如下:
溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验方案如下:
(1)实验①与②可探究__________ 对化学反应速率的影响,且
_______ mL.
(2)某同学在探究“反应物浓度对反应速率影响”的平行实验中,保持 溶液浓度不变,将
溶液浓度不变,将 溶液的浓度设计为变量.该实验设计是否合理并说明原因:
溶液的浓度设计为变量.该实验设计是否合理并说明原因:____ 。
(3)实验①测得 溶液的褪色时间为40s,忽略混合前后溶液体积的变化,则此段时间内
溶液的褪色时间为40s,忽略混合前后溶液体积的变化,则此段时间内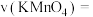
________  .
.
II. 溶液常用作氧化还原滴定的标准液.某实验小组欲测定某样品中
溶液常用作氧化还原滴定的标准液.某实验小组欲测定某样品中 的含量,某同学设计如下实验:
的含量,某同学设计如下实验:
①称取样品ag,加水溶解,配制成 溶液.
溶液.
②取 溶液于锥形瓶中,用
溶液于锥形瓶中,用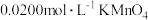 标准溶液(酸性)进行滴定,滴定结束后消耗
标准溶液(酸性)进行滴定,滴定结束后消耗 溶液
溶液 .
.
(4)滴定过程中发生反应的离子方程式为_________________ ;
(5)滴定终点的现象是:___________________________ ;
(6)测得该样品中 的质量分数为
的质量分数为______________ ;
(7)下列操作中可能使测定结果偏低的是_________ (填字母)
A.酸式滴定管未用标准 溶液进行润洗
溶液进行润洗
B.酸式滴定管尖嘴在滴定前没有气泡,滴定后有气泡
C.锥形瓶中残留少量蒸馏水
D.读数时,开始俯视读数,滴定结束时仰视读数
 )是化学实验中一种常用试剂.
)是化学实验中一种常用试剂.I.某研究性学习小组利用
 溶液和酸性
溶液和酸性 溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验方案如下:
溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验方案如下:实验序号 | 实验温度/K | 参加反应的物质 | ||||
|
|
| ||||
|
|
|
|
| ||
① | 293 | 2 | 0.02 | 4 | 0.1 | 0 |
② |
| 2 | 0.02 | 3 | 0.1 |
|
③ | 313 | 2 | 0.02 |
| 0.1 |
|

(2)某同学在探究“反应物浓度对反应速率影响”的平行实验中,保持
 溶液浓度不变,将
溶液浓度不变,将 溶液的浓度设计为变量.该实验设计是否合理并说明原因:
溶液的浓度设计为变量.该实验设计是否合理并说明原因:(3)实验①测得
 溶液的褪色时间为40s,忽略混合前后溶液体积的变化,则此段时间内
溶液的褪色时间为40s,忽略混合前后溶液体积的变化,则此段时间内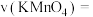
 .
.II.
 溶液常用作氧化还原滴定的标准液.某实验小组欲测定某样品中
溶液常用作氧化还原滴定的标准液.某实验小组欲测定某样品中 的含量,某同学设计如下实验:
的含量,某同学设计如下实验:①称取样品ag,加水溶解,配制成
 溶液.
溶液.②取
 溶液于锥形瓶中,用
溶液于锥形瓶中,用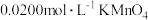 标准溶液(酸性)进行滴定,滴定结束后消耗
标准溶液(酸性)进行滴定,滴定结束后消耗 溶液
溶液 .
.(4)滴定过程中发生反应的离子方程式为
(5)滴定终点的现象是:
(6)测得该样品中
 的质量分数为
的质量分数为(7)下列操作中可能使测定结果偏低的是
A.酸式滴定管未用标准
 溶液进行润洗
溶液进行润洗B.酸式滴定管尖嘴在滴定前没有气泡,滴定后有气泡
C.锥形瓶中残留少量蒸馏水
D.读数时,开始俯视读数,滴定结束时仰视读数
您最近一年使用:0次
名校
2 .  是一种绿色试剂,在化学工业中用作生产过氧乙酸、亚氯酸钠等的原料,医药工业用作杀菌剂、消毒剂。某化学小组欲探究双氧水的性质做了如下实验:
是一种绿色试剂,在化学工业中用作生产过氧乙酸、亚氯酸钠等的原料,医药工业用作杀菌剂、消毒剂。某化学小组欲探究双氧水的性质做了如下实验:
(1)下表是该小组研究影响过氧化氢( )分解速率的因素时采集的数据[用
)分解速率的因素时采集的数据[用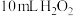 溶液制取
溶液制取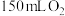 所需的时间(s)]。
所需的时间(s)]。
①研究小组在设计方案时,考虑了浓度、________ 、因素对过氧化氢分解速率的影响。
(2)另一研究小组拟在同浓度 的催化下,探究双氧水浓度对
的催化下,探究双氧水浓度对 分解速率的影响,限选试剂与仪器:30%双氧水、
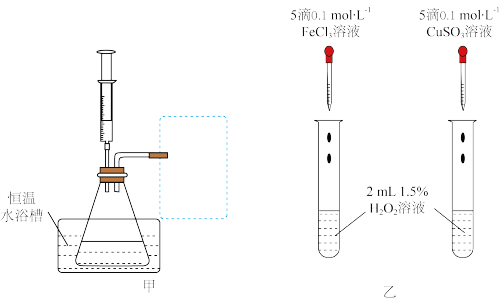
分解速率的影响,限选试剂与仪器:30%双氧水、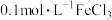 溶液、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。设计实验装置,完成图甲方框内的装置示意图
溶液、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。设计实验装置,完成图甲方框内的装置示意图_________ (要求所测得的数据能直接体现反应速率大小)。
(3)对于 分解反应,
分解反应, 也有一定的催化作用。为比较
也有一定的催化作用。为比较 和
和 对
对 分解的催化效果,研究小组的同学设计了如图乙所示的实验。请回答相关问题:
分解的催化效果,研究小组的同学设计了如图乙所示的实验。请回答相关问题:
①可通过观察_________ ,比较得出结论。
②有同学提出将 的
的 溶液改为
溶液改为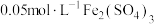 溶液更为合理,其理由是
溶液更为合理,其理由是__________ 。
(4)已知 溶液中主要含有
溶液中主要含有 、
、 和
和 三种微粒,该组同学又做了两种猜想:
三种微粒,该组同学又做了两种猜想:
猜想1:真正催化分解 的是
的是 溶液中的
溶液中的 ;
;
猜想2:真正催化分解 的是
的是___________ 。
完成表格,验证猜想:
 是一种绿色试剂,在化学工业中用作生产过氧乙酸、亚氯酸钠等的原料,医药工业用作杀菌剂、消毒剂。某化学小组欲探究双氧水的性质做了如下实验:
是一种绿色试剂,在化学工业中用作生产过氧乙酸、亚氯酸钠等的原料,医药工业用作杀菌剂、消毒剂。某化学小组欲探究双氧水的性质做了如下实验:(1)下表是该小组研究影响过氧化氢(
 )分解速率的因素时采集的数据[用
)分解速率的因素时采集的数据[用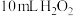 溶液制取
溶液制取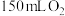 所需的时间(s)]。
所需的时间(s)]。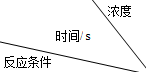 | 30%双氧水 | 15%双氧水 | 10%双氧水 | 5%双氧水 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
 、加热 、加热 | 10 | 25 | 60 | 120 |
(2)另一研究小组拟在同浓度
 的催化下,探究双氧水浓度对
的催化下,探究双氧水浓度对 分解速率的影响,限选试剂与仪器:30%双氧水、
分解速率的影响,限选试剂与仪器:30%双氧水、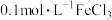 溶液、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。设计实验装置,完成图甲方框内的装置示意图
溶液、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。设计实验装置,完成图甲方框内的装置示意图
(3)对于
 分解反应,
分解反应, 也有一定的催化作用。为比较
也有一定的催化作用。为比较 和
和 对
对 分解的催化效果,研究小组的同学设计了如图乙所示的实验。请回答相关问题:
分解的催化效果,研究小组的同学设计了如图乙所示的实验。请回答相关问题:①可通过观察
②有同学提出将
 的
的 溶液改为
溶液改为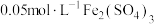 溶液更为合理,其理由是
溶液更为合理,其理由是(4)已知
 溶液中主要含有
溶液中主要含有 、
、 和
和 三种微粒,该组同学又做了两种猜想:
三种微粒,该组同学又做了两种猜想:猜想1:真正催化分解
 的是
的是 溶液中的
溶液中的 ;
;猜想2:真正催化分解
 的是
的是完成表格,验证猜想:
| 所需试剂 | 操作及现象 | 结论 |
 对 对 分解无催化作用 分解无催化作用 |
您最近一年使用:0次
2020-09-20更新
|
410次组卷
|
3卷引用:广东省中山市第一中学2019-2020学年高二上学期第一次段考化学试题
名校
3 . 低碳经济成为人们一种新的生活理念,二氧化碳的捕捉和利用是一个重要研究方向, 既可变废为宝,又可减少碳的排放。工业上可用CO2和H2制备被誉为“21世纪的清洁燃料”二甲醚(CH3OCH3):
如在500℃时,在密闭容器中将炼焦中的CO2转化为二甲醚,其相关反应为:
主反应I:2CO2 (g)+6H2(g) CH3OCH3(g)+3H2O(g) ΔH1
CH3OCH3(g)+3H2O(g) ΔH1
副反应II:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
(1)已知:①CO(g)+2H2(g) CH3OH(g) ΔH=-90.1kJ/mol
CH3OH(g) ΔH=-90.1kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=-24.5kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-24.5kJ/mol
③CO(g)+H2O(g) CO2(g)+H2(g) H= -41.0kJ/mol
CO2(g)+H2(g) H= -41.0kJ/mol
则主反应I的ΔH1=______ 。
(2)在一定温度下某密闭容器中按CO2和H2的浓度比为1∶3投料进行反应,测得不同时间段部分物质的浓度如下表:
①10-20min内,CH3OCH3的平均反应速率v(CH3OCH3)=_______ 。
②根据以上数据计算主反应I的平衡常数K=______ (列式,代入数据,不计算结果)。
(3)欲提高CH3OCH3产率的关键的因素是选用合适的催化剂,其原因是_______ 。
(4)对于反应II,温度对CO2的转化率及催化剂的效率影响如图所示:下列有关说法不正确的是_______ 。
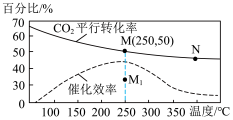
A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于Ml
B.温度低于250°C时,随温度升高甲醇的产率增大
C.M点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化
(5)利用太阳能电池将CO2转化为乙烯、丙烯等有机化工原料,其工作原理如图所示。则a为太阳能电池的_______ 极,写M极上生成丙烯的电极反应式为_________ 。
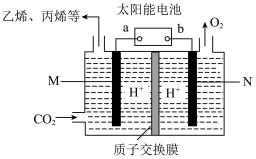
如在500℃时,在密闭容器中将炼焦中的CO2转化为二甲醚,其相关反应为:
主反应I:2CO2 (g)+6H2(g)
 CH3OCH3(g)+3H2O(g) ΔH1
CH3OCH3(g)+3H2O(g) ΔH1副反应II:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2(1)已知:①CO(g)+2H2(g)
 CH3OH(g) ΔH=-90.1kJ/mol
CH3OH(g) ΔH=-90.1kJ/mol②2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH=-24.5kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-24.5kJ/mol③CO(g)+H2O(g)
 CO2(g)+H2(g) H= -41.0kJ/mol
CO2(g)+H2(g) H= -41.0kJ/mol则主反应I的ΔH1=
(2)在一定温度下某密闭容器中按CO2和H2的浓度比为1∶3投料进行反应,测得不同时间段部分物质的浓度如下表:
| 时间(min) | 0 | 10 | 20 | 30 | 40 |
| H2 | 1.00mol/L | 0.68 mol/L | 0.40 mol/L | 0.30 mol/L | 0.30 mol/L |
| CH3OCH3 | 0 mol/L | 0.05 mol/L | 0.08 mol/L | 0.10 mol/L | 0.10 mol/L |
①10-20min内,CH3OCH3的平均反应速率v(CH3OCH3)=
②根据以上数据计算主反应I的平衡常数K=
(3)欲提高CH3OCH3产率的关键的因素是选用合适的催化剂,其原因是
(4)对于反应II,温度对CO2的转化率及催化剂的效率影响如图所示:下列有关说法不正确的是

A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于Ml
B.温度低于250°C时,随温度升高甲醇的产率增大
C.M点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化
(5)利用太阳能电池将CO2转化为乙烯、丙烯等有机化工原料,其工作原理如图所示。则a为太阳能电池的

您最近一年使用:0次
2020-04-01更新
|
272次组卷
|
4卷引用:广东省中山市2019-2020学年高三上学期期末统考化学试题
广东省中山市2019-2020学年高三上学期期末统考化学试题(已下线)《2020年新高考政策解读与配套资源》2020年山东新高考化学全真模拟卷(七)天津地区2021届高三上学期期中考试模拟测化学试题陕西省西安中学2022届高三下学期第五次模拟考试理科综合化学试题
10-11高二下·广东中山·阶段练习
名校
4 . 乙酸蒸汽能形成二聚分子:2CH3COOH (CH3COOH)2 △H<0,现欲测定乙酸分子的相对分子质量.应采用的条件为( )
(CH3COOH)2 △H<0,现欲测定乙酸分子的相对分子质量.应采用的条件为( )
 (CH3COOH)2 △H<0,现欲测定乙酸分子的相对分子质量.应采用的条件为( )
(CH3COOH)2 △H<0,现欲测定乙酸分子的相对分子质量.应采用的条件为( )| A.低温低压 | B.低温高压 | C.高温高压 | D.高温低压 |
您最近一年使用:0次
2019-11-16更新
|
95次组卷
|
12卷引用:2010—2011学年广东省中山一中高二下学期第一次段考化学试卷
(已下线)2010—2011学年广东省中山一中高二下学期第一次段考化学试卷(已下线)2012-2013学年黑龙江省鹤岗一中高一下学期期末考试化学试卷(已下线)2013-2014学年安徽省屯溪一中高二上学期期中考试化学试卷(已下线)2014-2015学年山西省太原第五中学高二10月月考化学试卷山东省济宁市邹城市兖矿第一中学2018-2019学年高二上学期期中模拟考化学试题安徽省新城高升学校2018-2019学年高二上学期期中考试化学试题河北省承德一中2017-2018学年高二第二次月考化学试卷吉林松原乾安七中2019-2020学年高二上学期9月月考化学试题吉林省松原市乾安县七中2019-2020学年高二上学期第一次月考化学试题天津市静海区大邱庄中学等四校2019-2020学年高二10联考化学试题黑龙江省实验中学2021-2022学年高二上学期第一次月考化学试题吉林省榆树市第一高级中学校2021-2022学年高二上学期10月月考化学试题
名校
解题方法
5 . 氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
①分析数据可知:大气固氮反应属于_______ (填“吸热”或“放热”)反应。
②从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因_____________________________________________ 。
③在一定的温度下,把2体积N2和6体积H2分别通入一个带活塞的体积可变的容器中,活塞的一端与大气相通容器中发生如下反应:N2(g)+3H2(g) 2NH3(g) △H<0。反应达到平衡后,测得混合气体为7体积。达到平衡时N2的转化率
2NH3(g) △H<0。反应达到平衡后,测得混合气体为7体积。达到平衡时N2的转化率_______________________ 。
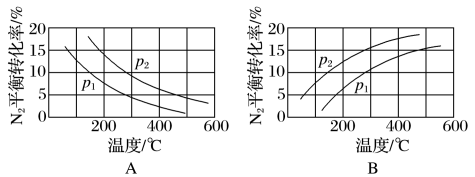
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(P1、P2)下随温度变化的曲线,下图所示的图示中,正确的是_______ (填“A”或“B”);比较p1、p2的大小关系: p1_______________ p2(填“>”或“<”)。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
| 反应 | 大气固氮N2(g)+O2(g) 2NO(g) 2NO(g) | 工业固氮N2(g)+3H2(g) 2NH3(g) 2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
①分析数据可知:大气固氮反应属于
②从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因
③在一定的温度下,把2体积N2和6体积H2分别通入一个带活塞的体积可变的容器中,活塞的一端与大气相通容器中发生如下反应:N2(g)+3H2(g)
 2NH3(g) △H<0。反应达到平衡后,测得混合气体为7体积。达到平衡时N2的转化率
2NH3(g) △H<0。反应达到平衡后,测得混合气体为7体积。达到平衡时N2的转化率
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(P1、P2)下随温度变化的曲线,下图所示的图示中,正确的是

您最近一年使用:0次
2017-12-04更新
|
198次组卷
|
2卷引用:广东省中山市第一中学2017-2018学年高二上学期第二次统测化学试题