解题方法
1 . 固体燃料是目前我国合成氨生产的主要原料,随着煤气化技术的进步,多煤种均可作为合成氨的原料。以煤为原料的合成氨生产流程由三个基本部分组成:
(1)原料气的制备过程中主要发生反应:
I.
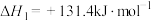
Ⅱ.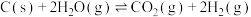
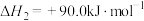
图1为碳与水蒸气反应的平衡常数与温度的关系图,图2表示了氧煤比对气化过程的影响,氧煤比的大小是影响气化炉温度、碳转化率、煤中有效气体(CO+H2)含量高低的重要因素。
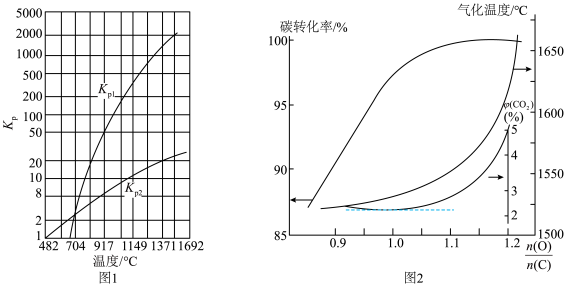
①由图1可知,高温有利于提高___________ 和___________ 的含量。
②试分析原料气制备过程中通入O2的原因:___________ ;由图可知,合适的氧煤比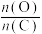 应保证在
应保证在___________ 左右。
(2)原料气的净化过程中,脱碳工序须将CO2去除。N-甲基二乙醇胺(简称MDEA,分子式可简写为R2CH3N)水溶液因其选择性高、溶剂消耗少、对设备腐蚀小、可再生等优点被广泛使用。MDEA吸收CO2的反应可表示为: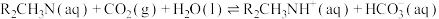
①脱碳工序可防止CO2在低温下固化变为干冰,堵塞设备和管道,还可防止___________ 。
②从结构角度分析MDEA具有碱性的原因:___________ 。
③标准平衡常数 可以表示平衡时各物质的浓度关系:如反应
可以表示平衡时各物质的浓度关系:如反应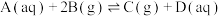 的
的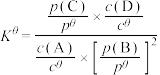 ,其中
,其中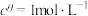 ,
,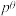 为标准大气压,
为标准大气压, 、
、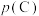 分别为气体的分压,分压=气体物质的量分数×总压。在T℃时的刚性密闭容器中,用20L2.3mol/L的MDEA溶液吸收总压为
分别为气体的分压,分压=气体物质的量分数×总压。在T℃时的刚性密闭容器中,用20L2.3mol/L的MDEA溶液吸收总压为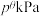 的合成氨原料气(含体积分数分别为30%的N2、55%的H2、15%的CO2),充分吸收后,MDEA浓度降低为2.0mol/L,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数
的合成氨原料气(含体积分数分别为30%的N2、55%的H2、15%的CO2),充分吸收后,MDEA浓度降低为2.0mol/L,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数
___________ (保留2位有效数字)。
(3)影响合成氨工艺条件的主要因素是空间速度(单位时间内通过单位体积催化剂的气量,简称空速)、反应温度、合成压力和气体组成等。目前30MPa的中压法合成塔,空速一般为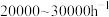 ,原因是
,原因是___________ 。
| 原料气的制备 | → | 原料气的净化 | → | 气体的压缩与氨的合成 |
(1)原料气的制备过程中主要发生反应:
I.

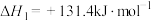
Ⅱ.
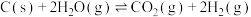
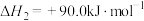
图1为碳与水蒸气反应的平衡常数与温度的关系图,图2表示了氧煤比对气化过程的影响,氧煤比的大小是影响气化炉温度、碳转化率、煤中有效气体(CO+H2)含量高低的重要因素。

①由图1可知,高温有利于提高
②试分析原料气制备过程中通入O2的原因:
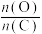 应保证在
应保证在(2)原料气的净化过程中,脱碳工序须将CO2去除。N-甲基二乙醇胺(简称MDEA,分子式可简写为R2CH3N)水溶液因其选择性高、溶剂消耗少、对设备腐蚀小、可再生等优点被广泛使用。MDEA吸收CO2的反应可表示为:
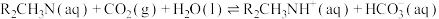
①脱碳工序可防止CO2在低温下固化变为干冰,堵塞设备和管道,还可防止
②从结构角度分析MDEA具有碱性的原因:
③标准平衡常数
 可以表示平衡时各物质的浓度关系:如反应
可以表示平衡时各物质的浓度关系:如反应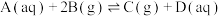 的
的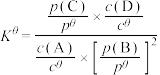 ,其中
,其中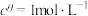 ,
,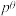 为标准大气压,
为标准大气压, 、
、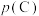 分别为气体的分压,分压=气体物质的量分数×总压。在T℃时的刚性密闭容器中,用20L2.3mol/L的MDEA溶液吸收总压为
分别为气体的分压,分压=气体物质的量分数×总压。在T℃时的刚性密闭容器中,用20L2.3mol/L的MDEA溶液吸收总压为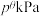 的合成氨原料气(含体积分数分别为30%的N2、55%的H2、15%的CO2),充分吸收后,MDEA浓度降低为2.0mol/L,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数
的合成氨原料气(含体积分数分别为30%的N2、55%的H2、15%的CO2),充分吸收后,MDEA浓度降低为2.0mol/L,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数
(3)影响合成氨工艺条件的主要因素是空间速度(单位时间内通过单位体积催化剂的气量,简称空速)、反应温度、合成压力和气体组成等。目前30MPa的中压法合成塔,空速一般为
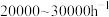 ,原因是
,原因是
您最近一年使用:0次
名校
2 . 氨是一种重要的基础化工产品。
(1)合成氨的原料气( 及少量
及少量 的混合气)在进入合成塔前需除去
的混合气)在进入合成塔前需除去 ,原因是
,原因是___________ 。
原料气中的 常用甲烷水蒸气重整反应制备,涉及的主要反应如下:
常用甲烷水蒸气重整反应制备,涉及的主要反应如下:
反应Ⅰ:
反应Ⅱ: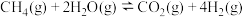
反应Ⅲ:
一定条件下,向体积为V的恒容容器中充入 甲烷和
甲烷和 水蒸气,达到平衡时,甲烷和水蒸气的转化率分别是80%和40%,则
水蒸气,达到平衡时,甲烷和水蒸气的转化率分别是80%和40%,则 的物质的量为
的物质的量为________  ,写出反应Ⅲ的平衡常数
,写出反应Ⅲ的平衡常数
___________ 。
(2) 与
与 作用分别生成
作用分别生成 的反应均为放热反应。工业尾气中的
的反应均为放热反应。工业尾气中的 可通过催化氧化为
可通过催化氧化为 除去。将一定比例的
除去。将一定比例的 和
和 的混合气体以一定流速经过装有催化剂的反应管,
的混合气体以一定流速经过装有催化剂的反应管, 的转化率、
的转化率、 的选择性[
的选择性[ ]与温度的关系如图。
]与温度的关系如图。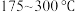 范围内升高温度,出口处氮氧化物的量
范围内升高温度,出口处氮氧化物的量________ (填“增大”或“减小), 的平衡转化率
的平衡转化率________ (填“增大”或“减小”)。
②为能更有效除去尾气中的 ,保护环境,应选择的最佳温度为
,保护环境,应选择的最佳温度为________ (填序号)。
A. B.
B. C.
C.
(3)氨气也可与氨的氧化物反应生成氮气,该反应可用于处理氮的氧化物。例如: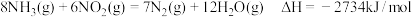 ,将
,将 和
和 以一定的流速,分别通过甲、乙两种催化剂发生上述反应,相同时间内测量逸出气体中
以一定的流速,分别通过甲、乙两种催化剂发生上述反应,相同时间内测量逸出气体中 含量,从而确定
含量,从而确定 的转化率,结果如图所示:
的转化率,结果如图所示:___________ (填“是”或“不是”)平衡状态,原因是___________ 。
(1)合成氨的原料气(
 及少量
及少量 的混合气)在进入合成塔前需除去
的混合气)在进入合成塔前需除去 ,原因是
,原因是原料气中的
 常用甲烷水蒸气重整反应制备,涉及的主要反应如下:
常用甲烷水蒸气重整反应制备,涉及的主要反应如下:反应Ⅰ:

反应Ⅱ:
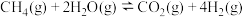
反应Ⅲ:

一定条件下,向体积为V的恒容容器中充入
 甲烷和
甲烷和 水蒸气,达到平衡时,甲烷和水蒸气的转化率分别是80%和40%,则
水蒸气,达到平衡时,甲烷和水蒸气的转化率分别是80%和40%,则 的物质的量为
的物质的量为 ,写出反应Ⅲ的平衡常数
,写出反应Ⅲ的平衡常数
(2)
 与
与 作用分别生成
作用分别生成 的反应均为放热反应。工业尾气中的
的反应均为放热反应。工业尾气中的 可通过催化氧化为
可通过催化氧化为 除去。将一定比例的
除去。将一定比例的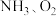 和
和 的混合气体以一定流速经过装有催化剂的反应管,
的混合气体以一定流速经过装有催化剂的反应管, 的转化率、
的转化率、 的选择性[
的选择性[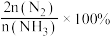 ]与温度的关系如图。
]与温度的关系如图。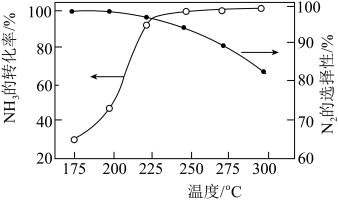
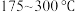 范围内升高温度,出口处氮氧化物的量
范围内升高温度,出口处氮氧化物的量 的平衡转化率
的平衡转化率②为能更有效除去尾气中的
 ,保护环境,应选择的最佳温度为
,保护环境,应选择的最佳温度为A.
 B.
B. C.
C.
(3)氨气也可与氨的氧化物反应生成氮气,该反应可用于处理氮的氧化物。例如:
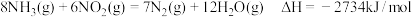 ,将
,将 和
和 以一定的流速,分别通过甲、乙两种催化剂发生上述反应,相同时间内测量逸出气体中
以一定的流速,分别通过甲、乙两种催化剂发生上述反应,相同时间内测量逸出气体中 含量,从而确定
含量,从而确定 的转化率,结果如图所示:
的转化率,结果如图所示: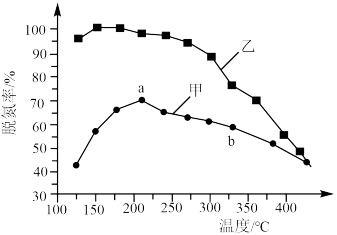
您最近一年使用:0次
2023-10-06更新
|
152次组卷
|
2卷引用:湖北省宜荆荆随2024届高三上学期10月联考化学试题
名校
解题方法
3 . 工业合成氨是人类科学技术的一项重大突破。其合成原理为:
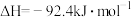

(1)下列关于工业合成氨的说法正确的是___________。
(2)一定温度下,在密闭容器中充入 和
和 并发生反应,若容器容积恒定,达到平衡时,气体的压强为原来的
并发生反应,若容器容积恒定,达到平衡时,气体的压强为原来的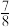 ,则
,则 的转化率为
的转化率为___________ 。
(3)工业上合成氨的部分工艺流程如图:
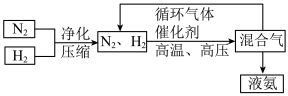
请用平衡移动原理来解释在流程中及时分离出氨气和循环使用气体的原因___________ 。
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响,实验结果如图所示(图中T表示温度)。则:
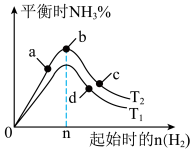
图象中 和
和 的关系是:
的关系是:
___________  (填“>、<或=”,下同);a、b、c、d四点所处的平衡状态中,反应物
(填“>、<或=”,下同);a、b、c、d四点所处的平衡状态中,反应物 的转化率最高的是
的转化率最高的是___________ (填字母)。
(5)恒温下,往一个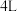 的密闭容器中充入
的密闭容器中充入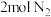 和
和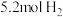 ,反应过程中对
,反应过程中对 的浓度进行检测,得到的数据如表所示:
的浓度进行检测,得到的数据如表所示:
此条件下该反应的化学平衡常数
___________ ;若维持容器体积不变,温度不变,往原平衡体系中加入 、
、 和
和 各
各 ,化学平衡将向
,化学平衡将向___________ 反应方向移动(填“正”或“逆”)。

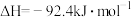

(1)下列关于工业合成氨的说法正确的是___________。
A.因为 ,所以该反应一定能自发进行 ,所以该反应一定能自发进行 |
| B.工业合成氨的反应是熵减小的放热反应,在常温时可自发进行 |
| C.合成氨反应选择在400~500℃进行的重要原因是此温度下氨的产率最高 |
| D.生产中在考虑动力和设备材料承受能力的前提下,压强越大越好 |
(2)一定温度下,在密闭容器中充入
 和
和 并发生反应,若容器容积恒定,达到平衡时,气体的压强为原来的
并发生反应,若容器容积恒定,达到平衡时,气体的压强为原来的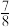 ,则
,则 的转化率为
的转化率为(3)工业上合成氨的部分工艺流程如图:

请用平衡移动原理来解释在流程中及时分离出氨气和循环使用气体的原因
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响,实验结果如图所示(图中T表示温度)。则:

图象中
 和
和 的关系是:
的关系是:
 (填“>、<或=”,下同);a、b、c、d四点所处的平衡状态中,反应物
(填“>、<或=”,下同);a、b、c、d四点所处的平衡状态中,反应物 的转化率最高的是
的转化率最高的是(5)恒温下,往一个
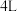 的密闭容器中充入
的密闭容器中充入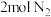 和
和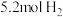 ,反应过程中对
,反应过程中对 的浓度进行检测,得到的数据如表所示:
的浓度进行检测,得到的数据如表所示:| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
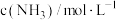 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |

 、
、 和
和 各
各 ,化学平衡将向
,化学平衡将向
您最近一年使用:0次
名校
解题方法
4 . 异丁烯( )是一种重要的化工原料,利用异丁烷(
)是一种重要的化工原料,利用异丁烷( )催化脱氢制备。回答下列问题:
)催化脱氢制备。回答下列问题:
(1)已知 、
、 和
和 的燃烧热
的燃烧热 如下表所示:
如下表所示:
则异丁烷催化脱氢反应 的
的
___________  。有利于提高异丁烷平衡转化率的条件是
。有利于提高异丁烷平衡转化率的条件是___________ (填标号)。
a.高温低压 B.高温高压 C.低温高压 D.低温低压
(2)在温度和压强相同条件下,相同流速的异丁烷通过不同的催化剂反应相同的时间,异丁烷的转化率与异丁烯的选择性[选择性=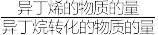 ]如下表所示,则催化剂催化效果最好的是
]如下表所示,则催化剂催化效果最好的是___________ 。
(3)在温度和压强相同条件下,不同流速的异丁烷通过催化剂反应相同的时间,异丁烷的转化率随着流速的增大而减小,其原因可能是___________ 。
(4)在高温条件下,异丁烷容易发生裂解产生积碳,沉积在催化剂的表面导致异丁烯的产率降低。若在相同条件下,向反应体系中通入 ,异丁烯的产率会提高,请利用方程式说明原因
,异丁烯的产率会提高,请利用方程式说明原因___________ 。
(5)在一定温度T℃和压强p条件下,假设异丁烷脱氢只发生副反应: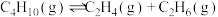 ;达到平衡时,异丁烷的转化率为80%,异丁烯的分压是乙烯分压的3倍,则异丁烯的选择性为
;达到平衡时,异丁烷的转化率为80%,异丁烯的分压是乙烯分压的3倍,则异丁烯的选择性为___________ ;异丁烷催化脱氢制异丁烯反应的
___________ 。
 )是一种重要的化工原料,利用异丁烷(
)是一种重要的化工原料,利用异丁烷( )催化脱氢制备。回答下列问题:
)催化脱氢制备。回答下列问题:(1)已知
 、
、 和
和 的燃烧热
的燃烧热 如下表所示:
如下表所示:| 物质 |  |  |  |
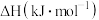 | -2877 | -2718 | -286 |
 的
的
 。有利于提高异丁烷平衡转化率的条件是
。有利于提高异丁烷平衡转化率的条件是a.高温低压 B.高温高压 C.低温高压 D.低温低压
(2)在温度和压强相同条件下,相同流速的异丁烷通过不同的催化剂反应相同的时间,异丁烷的转化率与异丁烯的选择性[选择性=
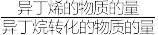 ]如下表所示,则催化剂催化效果最好的是
]如下表所示,则催化剂催化效果最好的是| 催化剂的种类 | 异丁烷的转化率/% | 异丁烯的选择性/% |
| a | 35% | 90% |
| b | 50% | 65% |
| c | 44% | 75% |
(4)在高温条件下,异丁烷容易发生裂解产生积碳,沉积在催化剂的表面导致异丁烯的产率降低。若在相同条件下,向反应体系中通入
 ,异丁烯的产率会提高,请利用方程式说明原因
,异丁烯的产率会提高,请利用方程式说明原因(5)在一定温度T℃和压强p条件下,假设异丁烷脱氢只发生副反应:
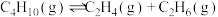 ;达到平衡时,异丁烷的转化率为80%,异丁烯的分压是乙烯分压的3倍,则异丁烯的选择性为
;达到平衡时,异丁烷的转化率为80%,异丁烯的分压是乙烯分压的3倍,则异丁烯的选择性为
您最近一年使用:0次
解题方法
5 . 氨气是现代工业、农业生产最基础的化工原料之一、
Ⅰ.传统的“哈伯法”反应原理为:
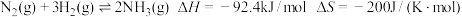
(1)上述反应在常温下___________ (填“能”或“不能”)自发进行。
(2)“哈伯法”合成氨的工业条件为400~500℃、10~30MPa,是综合考虑了___________ 因素(至少写两点)。
(3)t℃时向2L的某刚性容器中充入 和
和 。已知平衡时体系中
。已知平衡时体系中 的体积占比为
的体积占比为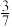 ,则该反应的平衡常数
,则该反应的平衡常数
___________ 。
Ⅱ.“哈伯法”的原料 来自于化石燃料,该过程会产生大量温室气体
来自于化石燃料,该过程会产生大量温室气体 。近年来有科学家提出通过电解氮气和水来合成氨气(NRR反应)。
。近年来有科学家提出通过电解氮气和水来合成氨气(NRR反应)。
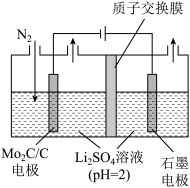
(4)一种常温常压下NRR反应的装置如图所示,请写出阴极的电极反应方程式:___________ 。
(5)下表为不同电压下进行电解时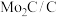 电极表面的气体产生情况(以
电极表面的气体产生情况(以 为计算值)
为计算值)
①表中 的最大产率=
的最大产率=___________ (产率=实际产量/理论产量×100%,常温常压下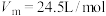 ,结果保留3位有效数值)
,结果保留3位有效数值)
②较高电压下 的生成速率下降的原因是:
的生成速率下降的原因是:___________ 。
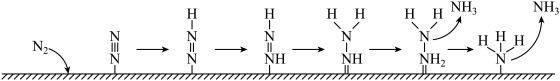
(6)如图为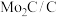 电极表面“
电极表面“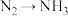 ”的可能路径(
”的可能路径( 表示电极表面)。该过程中会产生两种具有对称结构的副产物,分别为:
表示电极表面)。该过程中会产生两种具有对称结构的副产物,分别为:___________ (填化学式)。
Ⅰ.传统的“哈伯法”反应原理为:
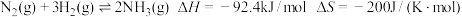
(1)上述反应在常温下
(2)“哈伯法”合成氨的工业条件为400~500℃、10~30MPa,是综合考虑了
(3)t℃时向2L的某刚性容器中充入
 和
和 。已知平衡时体系中
。已知平衡时体系中 的体积占比为
的体积占比为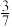 ,则该反应的平衡常数
,则该反应的平衡常数
Ⅱ.“哈伯法”的原料
 来自于化石燃料,该过程会产生大量温室气体
来自于化石燃料,该过程会产生大量温室气体 。近年来有科学家提出通过电解氮气和水来合成氨气(NRR反应)。
。近年来有科学家提出通过电解氮气和水来合成氨气(NRR反应)。(4)一种常温常压下NRR反应的装置如图所示,请写出阴极的电极反应方程式:
(5)下表为不同电压下进行电解时
 电极表面的气体产生情况(以
电极表面的气体产生情况(以 为计算值)
为计算值)①表中
 的最大产率=
的最大产率=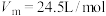 ,结果保留3位有效数值)
,结果保留3位有效数值) ②较高电压下
 的生成速率下降的原因是:
的生成速率下降的原因是:| 电压V |  通入速率mL/min 通入速率mL/min |  生成速率mL/min 生成速率mL/min |  生成速率mg/min 生成速率mg/min |
| 0.2 | 25 | 0.015 | 0.51 |
| 0.3 | 25 | 0.038 | 0.68 |
| 0.4 | 25 | 0.095 | 0.65 |
| 0.5 | 25 | 0.11 | 0.52 |
(6)如图为
 电极表面“
电极表面“ ”的可能路径(
”的可能路径( 表示电极表面)。该过程中会产生两种具有对称结构的副产物,分别为:
表示电极表面)。该过程中会产生两种具有对称结构的副产物,分别为:
您最近一年使用:0次
名校
解题方法
6 . 钌 粉主要用于生产钌靶材,而钌靶材是生产计算机硬盘不可替代的材料。以钌废料(废料中钌主要以单质的形式存在,还含有Al、Cr、Cr、CO、Ti、Fe等杂质)制备高纯钌粉的流程如下:
粉主要用于生产钌靶材,而钌靶材是生产计算机硬盘不可替代的材料。以钌废料(废料中钌主要以单质的形式存在,还含有Al、Cr、Cr、CO、Ti、Fe等杂质)制备高纯钌粉的流程如下:
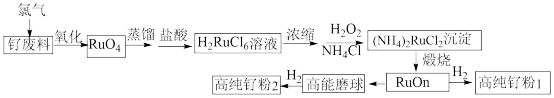
已知:i.钌在碱性条件下被氯气氧化为 ,
, 是有毒的挥发性物质,用盐酸吸收得到红色
是有毒的挥发性物质,用盐酸吸收得到红色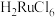 溶液,其中还含有少量
溶液,其中还含有少量 ;
;
ii.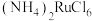 易溶于水,微溶于酒精。
易溶于水,微溶于酒精。
回答下列问题:
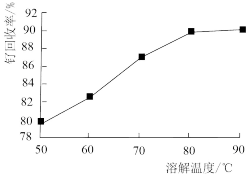
(1)钌废料在碱性条件下被氯气氧化的离子方程式为_______ ;钌废料氧化时,随着温度的升高,钌的回收率变化如图所示。综合考虑,确定氧化时的温度以_______ ℃为宜。
(2)用盐酸吸收蒸馏产物时发生主要反应的化学方程式是_______ 。
(3)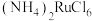 沉淀用乙醇洗涤而不用水洗涤的优点是
沉淀用乙醇洗涤而不用水洗涤的优点是_______ 。
(4)加入 的主要作用是
的主要作用是_______ ,同时又调节了溶液的 ,有利于沉淀反应的发生。流程中可以循环利用的物质
,有利于沉淀反应的发生。流程中可以循环利用的物质_______ 。
(5)煅烧的过程分为两步:第1步是氯钌酸铵分解生成钌单质和一种无毒的气体单质,同时有两种化合物生成;第2步是钌单质与氧气反应生成钌的氧化物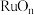 (
(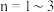 )。第1步的化学方程式是
)。第1步的化学方程式是_______ 。
 粉主要用于生产钌靶材,而钌靶材是生产计算机硬盘不可替代的材料。以钌废料(废料中钌主要以单质的形式存在,还含有Al、Cr、Cr、CO、Ti、Fe等杂质)制备高纯钌粉的流程如下:
粉主要用于生产钌靶材,而钌靶材是生产计算机硬盘不可替代的材料。以钌废料(废料中钌主要以单质的形式存在,还含有Al、Cr、Cr、CO、Ti、Fe等杂质)制备高纯钌粉的流程如下: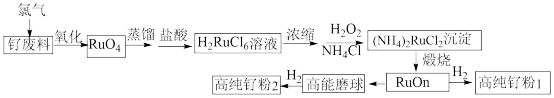
已知:i.钌在碱性条件下被氯气氧化为
 ,
, 是有毒的挥发性物质,用盐酸吸收得到红色
是有毒的挥发性物质,用盐酸吸收得到红色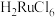 溶液,其中还含有少量
溶液,其中还含有少量 ;
;ii.
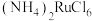 易溶于水,微溶于酒精。
易溶于水,微溶于酒精。回答下列问题:
(1)钌废料在碱性条件下被氯气氧化的离子方程式为

(2)用盐酸吸收蒸馏产物时发生主要反应的化学方程式是
(3)
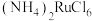 沉淀用乙醇洗涤而不用水洗涤的优点是
沉淀用乙醇洗涤而不用水洗涤的优点是(4)加入
 的主要作用是
的主要作用是 ,有利于沉淀反应的发生。流程中可以循环利用的物质
,有利于沉淀反应的发生。流程中可以循环利用的物质(5)煅烧的过程分为两步:第1步是氯钌酸铵分解生成钌单质和一种无毒的气体单质,同时有两种化合物生成;第2步是钌单质与氧气反应生成钌的氧化物
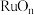 (
( )。第1步的化学方程式是
)。第1步的化学方程式是
您最近一年使用:0次
2023-01-16更新
|
275次组卷
|
5卷引用:湖北省七市(州)2023届高三3月联合统一调研测试化学试题变式题(工业流程题)
(已下线)湖北省七市(州)2023届高三3月联合统一调研测试化学试题变式题(工业流程题)山东省鄄城县第一中学2022-2023学年高三上学期期末考试化学试题山东省菏泽市郓城县实验中学2022-2023学年高三上学期期末考试化学试题(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(工业流程题)河南省南阳市新野县第一高级中学校2023-2024学年高三上学期12月月考化学试题
名校
解题方法
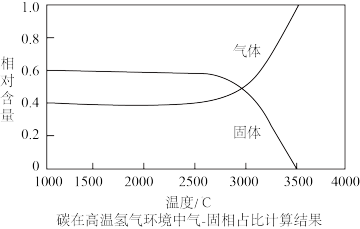
7 . 金属铼(Re)广泛应用于国防、石油化工以及电子制造等领域,铼可通过还原高铼酸铵(NH4ReO4)制备。以钼精矿(主要成分为钼的硫化物和少量铼的硫化物)制取高铼酸铵的流程如下图所示。

回答下列问题:
(1)为了提高“焙烧”过程的效率,可以采取的措施为_______ (回答任意两点)。
(2)“焙烧”过程加入生石灰,有效解决了SO2的危害,则ReS2转化为Ca(ReO4)2的方程式为_______ 。
(3)“浸渣”的主要成分为_______
(4)“萃取”机理为:R3N+H++ReO =R3N·HReO4,则“反萃取”所用试剂X为
=R3N·HReO4,则“反萃取”所用试剂X为_______
(5)“反萃取”后,从NH4ReO4溶液中得到晶体的操作为_______ 、过滤、洗涤、干燥。
(6)NH4ReO4经过高温氢气还原即可获得铼粉,该反应的化学方程式为_______ 。
(7)经过上述反应后制备的铼粉中含有少量碳粉和铁粉(其熔沸点见表),在3500℃下,利用氢气提纯可得到纯度达99.995%的铼粉,请分析原因_______ 。

回答下列问题:
(1)为了提高“焙烧”过程的效率,可以采取的措施为
(2)“焙烧”过程加入生石灰,有效解决了SO2的危害,则ReS2转化为Ca(ReO4)2的方程式为
(3)“浸渣”的主要成分为
(4)“萃取”机理为:R3N+H++ReO
 =R3N·HReO4,则“反萃取”所用试剂X为
=R3N·HReO4,则“反萃取”所用试剂X为(5)“反萃取”后,从NH4ReO4溶液中得到晶体的操作为
(6)NH4ReO4经过高温氢气还原即可获得铼粉,该反应的化学方程式为
(7)经过上述反应后制备的铼粉中含有少量碳粉和铁粉(其熔沸点见表),在3500℃下,利用氢气提纯可得到纯度达99.995%的铼粉,请分析原因
| 物质 | 熔点(℃) | 沸点(℃) |
| Re | 3180 | 5900 |
| C | 3652 | 4827 |
| Fe | 1535 | 2750 |

您最近一年使用:0次
2022-11-18更新
|
537次组卷
|
4卷引用:湖北省高中名校联盟2022-2023学年高三上学期第二次联合测评化学试卷
湖北省高中名校联盟2022-2023学年高三上学期第二次联合测评化学试卷湖北大学附属中学2023届高三上学期第二次联合测评化学试题湖北省高中名校联盟2022-2023学年高三上学期11月月考化学试题(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(工业流程题)
名校
解题方法
8 . 锌盐在化工、医药、电镀等方面都有重要应用。以硫化锌精矿为原料,选择在常压下,采用氧化-酸浸法进行实验生产的工艺如图所示。
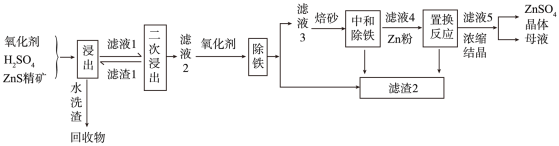
已知:①浸出液杂质离子主要是Fe2+、Fe3+,还含有少量的Cu2+、Ni2+等;
②pH=1.5时,除铁的化学方程式为3Fe2(SO4)3+K2SO4+12H2O=2KFe3(SO4)2(OH)6↓+6H2SO4;
③25℃时,Ksp[Fe(OH)3]=3×10-39。
回答下列问题:
(1)浸出时,选用氧化-酸浸法而不直接选用酸浸法的优点是_______ ,氧化剂在稀硫酸介质中对硫化锌精矿进行浸取时所涉及的化学反应机理较为复杂,若氧化剂为稀硝酸时氧化产物为单质S,则发生反应的离子方程式为_______ 。
(2)温度对硫化锌精矿的浸出率有重要的影响,从室温到100°C范围内,温度对硫化锌精矿的浸出率的影响结果如图所示:
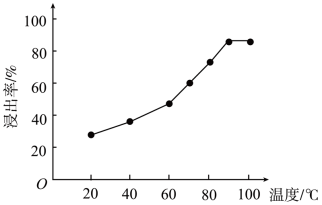
随浸出温度的升高,硫化锌精矿的浸出率显著提高的原因是_______ ;实际工业生产选用的合适温度为_______ 左右。
(3)若氧化剂为H2O2,用离子方程式解释除铁之前需要加入氧化剂的目的:_______ 。测定除铁后的滤液中c(Fe3+)为0.003mol·L-1,则此时溶液的pH=_______ 。
(4)除铁后再进一步调节pH=4左右,使其完全水解形成Fe(OH)3沉淀,即可达到除铁要求,不在除铁之前调节pH=4的原因是_______ 。
(5)加入Zn的目的是_______ 。

已知:①浸出液杂质离子主要是Fe2+、Fe3+,还含有少量的Cu2+、Ni2+等;
②pH=1.5时,除铁的化学方程式为3Fe2(SO4)3+K2SO4+12H2O=2KFe3(SO4)2(OH)6↓+6H2SO4;
③25℃时,Ksp[Fe(OH)3]=3×10-39。
回答下列问题:
(1)浸出时,选用氧化-酸浸法而不直接选用酸浸法的优点是
(2)温度对硫化锌精矿的浸出率有重要的影响,从室温到100°C范围内,温度对硫化锌精矿的浸出率的影响结果如图所示:

随浸出温度的升高,硫化锌精矿的浸出率显著提高的原因是
(3)若氧化剂为H2O2,用离子方程式解释除铁之前需要加入氧化剂的目的:
(4)除铁后再进一步调节pH=4左右,使其完全水解形成Fe(OH)3沉淀,即可达到除铁要求,不在除铁之前调节pH=4的原因是
(5)加入Zn的目的是
您最近一年使用:0次
名校
解题方法
9 . 一种制取电池级二氧化锰的工艺流程如下图:
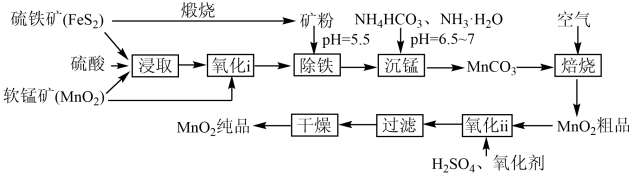
回答下列问题:
(1)“浸取”过程有硫单质生成,写出该过程中主要反应的化学方程式_______ 。
(2)“氧化ⅰ”过程软锰矿的作用是_______ 。“氧化ⅱ”过程中,将Mn(Ⅱ)转化为Mn(Ⅳ)的最适宜氧化剂是_______ (填标号)。
a. b.
b. c.
c.
(3)工业上煅烧硫铁矿产生的 气体可以用石灰乳吸收。常温下,测得
气体可以用石灰乳吸收。常温下,测得 与水形成的浊液pH为9,若忽略
与水形成的浊液pH为9,若忽略 的第二步水解,则
的第二步水解,则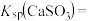
_______ (保留三位有效数字)[已知:室温下亚硫酸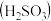 的电离平衡常数
的电离平衡常数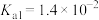 ,
, ]
]
(4)“沉锰”过程 转化为
转化为 的离子方程式为
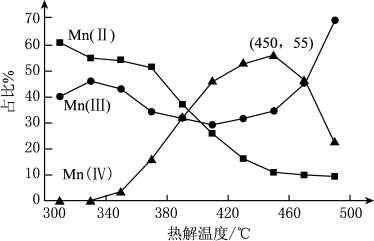
的离子方程式为_______ 。在一定空气流速下,相同时间内“焙烧” ,产物中不同价态Mn的占比随热解温度的变化如图。“焙烧”过程中涉及如下化学反应:
,产物中不同价态Mn的占比随热解温度的变化如图。“焙烧”过程中涉及如下化学反应:
①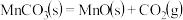
②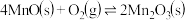

③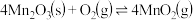

为了增大产物中 的占比,可以采用的措施是
的占比,可以采用的措施是_______ (答出两条)。将制备获得的电池级二氧化锰用于构建水系锌锰电池,其工作原理为: ,放电时正极的电极反应式为
,放电时正极的电极反应式为_______ 。
(5)用氧化还原法测定 纯品纯度(杂质不参与下列反应):称取
纯品纯度(杂质不参与下列反应):称取 样品0.1000g,试样经过过氧化钠碱熔后,得到
样品0.1000g,试样经过过氧化钠碱熔后,得到 溶液,配成溶液经加热煮沸除去过氧化物,酸化溶液,此时
溶液,配成溶液经加热煮沸除去过氧化物,酸化溶液,此时 歧化为
歧化为 和
和 ,过滤除去
,过滤除去 ,用
,用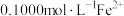 标准溶液滴定
标准溶液滴定 ,用去37.00mL,则样品中
,用去37.00mL,则样品中 的质量分数为
的质量分数为_______ (保留3位有效数字)。

回答下列问题:
(1)“浸取”过程有硫单质生成,写出该过程中主要反应的化学方程式
(2)“氧化ⅰ”过程软锰矿的作用是
a.
 b.
b. c.
c.
(3)工业上煅烧硫铁矿产生的
 气体可以用石灰乳吸收。常温下,测得
气体可以用石灰乳吸收。常温下,测得 与水形成的浊液pH为9,若忽略
与水形成的浊液pH为9,若忽略 的第二步水解,则
的第二步水解,则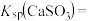
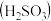 的电离平衡常数
的电离平衡常数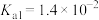 ,
, ]
](4)“沉锰”过程
 转化为
转化为 的离子方程式为
的离子方程式为 ,产物中不同价态Mn的占比随热解温度的变化如图。“焙烧”过程中涉及如下化学反应:
,产物中不同价态Mn的占比随热解温度的变化如图。“焙烧”过程中涉及如下化学反应:
①
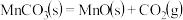
②
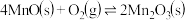

③
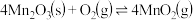

为了增大产物中
 的占比,可以采用的措施是
的占比,可以采用的措施是 ,放电时正极的电极反应式为
,放电时正极的电极反应式为(5)用氧化还原法测定
 纯品纯度(杂质不参与下列反应):称取
纯品纯度(杂质不参与下列反应):称取 样品0.1000g,试样经过过氧化钠碱熔后,得到
样品0.1000g,试样经过过氧化钠碱熔后,得到 溶液,配成溶液经加热煮沸除去过氧化物,酸化溶液,此时
溶液,配成溶液经加热煮沸除去过氧化物,酸化溶液,此时 歧化为
歧化为 和
和 ,过滤除去
,过滤除去 ,用
,用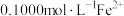 标准溶液滴定
标准溶液滴定 ,用去37.00mL,则样品中
,用去37.00mL,则样品中 的质量分数为
的质量分数为
您最近一年使用:0次
2022-04-29更新
|
1222次组卷
|
4卷引用:湖北省武汉市第二中学2022届高三5月全仿真模拟考试(一)化学试题
湖北省武汉市第二中学2022届高三5月全仿真模拟考试(一)化学试题山东省济宁市2022届高三第二次模拟考试化学试题湖南省长沙市长沙县第一中学2021-2022学年高三下学期期中考试化学试题(已下线)微专题17 热点金属及其化合物制备流程(V、Cr、Mn、Co、Ni)-备战2023年高考化学一轮复习考点微专题
名校
解题方法
10 . 工业上利用废催化剂(主要含 ,含少量Pd等)提取钯、明矾的流程如下:
,含少量Pd等)提取钯、明矾的流程如下:
(1)明矾的化学式为_______ 。
(2)为了工艺绿色化,将空气和流程中产生的_______ (气体)混合通入“酸浸”工序中。
(3)“酸浸”中生成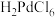 的化学方程式为
的化学方程式为_______ 。
(4)“热还原”中_______ (填“能”或“不能”)根据消耗 的总质量计算Pd的质量,理由是
的总质量计算Pd的质量,理由是_______ 。
(5)其他条件相同时,“酸浸”中钯浸出率与液固比(一定浓度的硝酸和盐酸组成混合溶液的体积与钯渣质量之比)关系如图1所示,最佳液固比为_______ 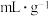 。当液固比一定时,相同时间内钯浸出率与温度关系如图2所示,解释40℃钯浸出率达到峰值的原因:
。当液固比一定时,相同时间内钯浸出率与温度关系如图2所示,解释40℃钯浸出率达到峰值的原因:_______ 。 ,其中x的最大值为0.8。已知Pd的密度为
,其中x的最大值为0.8。已知Pd的密度为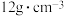 ,则
,则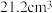 Pd能储存标准状况下
Pd能储存标准状况下 的最大体积为
的最大体积为_______ L。
 ,含少量Pd等)提取钯、明矾的流程如下:
,含少量Pd等)提取钯、明矾的流程如下:
(1)明矾的化学式为
(2)为了工艺绿色化,将空气和流程中产生的
(3)“酸浸”中生成
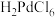 的化学方程式为
的化学方程式为(4)“热还原”中
 的总质量计算Pd的质量,理由是
的总质量计算Pd的质量,理由是(5)其他条件相同时,“酸浸”中钯浸出率与液固比(一定浓度的硝酸和盐酸组成混合溶液的体积与钯渣质量之比)关系如图1所示,最佳液固比为
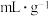 。当液固比一定时,相同时间内钯浸出率与温度关系如图2所示,解释40℃钯浸出率达到峰值的原因:
。当液固比一定时,相同时间内钯浸出率与温度关系如图2所示,解释40℃钯浸出率达到峰值的原因: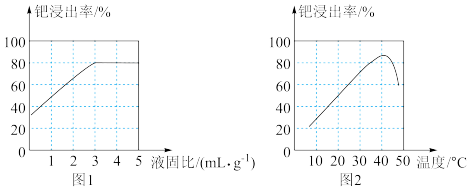
 ,其中x的最大值为0.8。已知Pd的密度为
,其中x的最大值为0.8。已知Pd的密度为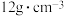 ,则
,则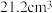 Pd能储存标准状况下
Pd能储存标准状况下 的最大体积为
的最大体积为
您最近一年使用:0次
2022-03-08更新
|
829次组卷
|
7卷引用:湖北省襄阳市第五中学2022届高三适应性考试(一)化学试题



