名校
解题方法
1 . 硫酸在国民经济中占有极其重要的地位,工业上常以黄铁矿为原料用接触法制硫酸。
(1)接触室中发生的反应:
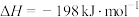 。
。
①若测得2h后 的浓度为0.6
的浓度为0.6 ,此时间内
,此时间内 的消耗速率为0.2
的消耗速率为0.2 ,则开始时
,则开始时 的浓度为
的浓度为_________  。
。
②将0.050mol (g)和0.030mol
(g)和0.030mol  (g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测
(g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测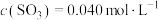 。计算该条件下反应的平衡常数K=
。计算该条件下反应的平衡常数K=_________ , 的平衡转化率为
的平衡转化率为_________ 。
③ 可作为该反应的催化剂,其过程如图。c步的化学方程式可表示为
可作为该反应的催化剂,其过程如图。c步的化学方程式可表示为_________ 。
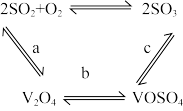
(2)硫酸的生产中,下列说法不正确的是_________(填字母)。
(3)为减少 的排放,工业上将
的排放,工业上将 转化为
转化为 固定,但存在C0会同时发生以下两个反应:
固定,但存在C0会同时发生以下两个反应:
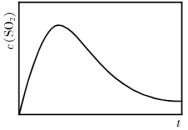
恒容、恒温( )条件下,反应体系中
)条件下,反应体系中 随时间t变化的总趋势如图。结合已知信息分析
随时间t变化的总趋势如图。结合已知信息分析 随时间t变化的原因:
随时间t变化的原因:_________ 。
(1)接触室中发生的反应:

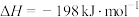 。
。①若测得2h后
 的浓度为0.6
的浓度为0.6 ,此时间内
,此时间内 的消耗速率为0.2
的消耗速率为0.2 ,则开始时
,则开始时 的浓度为
的浓度为 。
。②将0.050mol
 (g)和0.030mol
(g)和0.030mol  (g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测
(g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测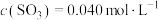 。计算该条件下反应的平衡常数K=
。计算该条件下反应的平衡常数K= 的平衡转化率为
的平衡转化率为③
 可作为该反应的催化剂,其过程如图。c步的化学方程式可表示为
可作为该反应的催化剂,其过程如图。c步的化学方程式可表示为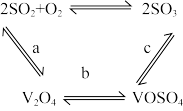
(2)硫酸的生产中,下列说法不正确的是_________(填字母)。
| A.把黄铁矿磨成细粉末在“沸腾”状态下燃烧,可以提高反应速率和原料的利用率 |
| B.气体在进接触室前要先净化,可防止催化剂中毒 |
| C.接触室中反应温度采用400~500℃,主要是为了提高原料的平衡转化率 |
D.吸收塔中操作采取逆流的形式, 从下而上,水从上而下 从下而上,水从上而下 |
 的排放,工业上将
的排放,工业上将 转化为
转化为 固定,但存在C0会同时发生以下两个反应:
固定,但存在C0会同时发生以下两个反应:| 反应 | 活化能 | 平衡常数 | |
| Ⅰ |  | 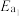 | 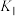 |
| Ⅱ |  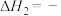 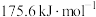 | 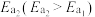 | 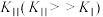 |
恒容、恒温(
 )条件下,反应体系中
)条件下,反应体系中 随时间t变化的总趋势如图。结合已知信息分析
随时间t变化的总趋势如图。结合已知信息分析 随时间t变化的原因:
随时间t变化的原因:
您最近一年使用:0次
2022-12-05更新
|
36次组卷
|
2卷引用:广东省梅州市兴宁市沐彬中学2022-2023学年高二上学期第二次月考化学试题
名校
2 . 二氧化锰是化学工业中常用的氧化剂和催化剂。我国主要以贫菱锰矿(有效成分为MnCO3)为原料,通过热解法进行生产。
(1)碳酸锰热解制二氧化锰分两步进行:
i.MnCO3(s) MnO(s)+CO2(g) ΔH1=+a kJ·mol−1
MnO(s)+CO2(g) ΔH1=+a kJ·mol−1
ii.2MnO(s)+O2(g) 2MnO2(s) ΔH2=+b kJ·mol−1
2MnO2(s) ΔH2=+b kJ·mol−1
①反应i的化学平衡常数表达式K=_________ 。
②焙烧MnCO3制取MnO2的热化学方程式是_________ 。
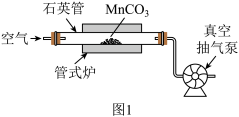
(2)焙烧(装置如图1)时持续通入空气,并不断抽气的目的是_________ 。
(3)在其他条件不变时,某科研团队对影响MnCO3转化率的生产条件进行了研究,结果如图2、图3所示。
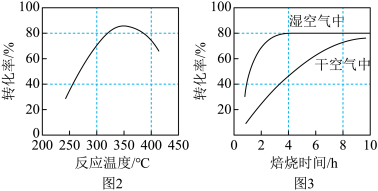
①图2是在常压(0.1 MPa)下的研究结果,请在图2中用虚线画出10 MPa下MnCO3转化率与反应温度的关系图_________ 。
②常压下,要提高MnCO3的转化率,应选择的生产条件是_________ 焙烧6~8h。
(1)碳酸锰热解制二氧化锰分两步进行:
i.MnCO3(s)
 MnO(s)+CO2(g) ΔH1=+a kJ·mol−1
MnO(s)+CO2(g) ΔH1=+a kJ·mol−1ii.2MnO(s)+O2(g)
 2MnO2(s) ΔH2=+b kJ·mol−1
2MnO2(s) ΔH2=+b kJ·mol−1①反应i的化学平衡常数表达式K=
②焙烧MnCO3制取MnO2的热化学方程式是
(2)焙烧(装置如图1)时持续通入空气,并不断抽气的目的是

(3)在其他条件不变时,某科研团队对影响MnCO3转化率的生产条件进行了研究,结果如图2、图3所示。

①图2是在常压(0.1 MPa)下的研究结果,请在图2中用虚线画出10 MPa下MnCO3转化率与反应温度的关系图
②常压下,要提高MnCO3的转化率,应选择的生产条件是
您最近一年使用:0次
2022-12-05更新
|
99次组卷
|
3卷引用:辽宁省大连庄河市高级中学2022-2023学年高二上学期12月月考化学(B卷)试题
名校
3 . 化学对提高人类生活质量和促进社会发展具有重要作用。下列人类活动中,运用了相应的化学原理的是
| 选项 | 人类活动 | 化学原理 |
| A | 实验室用锌与稀硫酸反应制氢气,同时有热量放出 | 该反应不遵循能量守恒定律 |
| B | 游轮底部定期更换锌块 | 利用电解原理可防止腐蚀 |
| C |  溶液除铁锈 溶液除铁锈 |  水解呈酸性 水解呈酸性 |
| D | 工业合成氨通常在高温条件下进行 | 高温促进合成氨平衡正向移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-12-04更新
|
126次组卷
|
2卷引用:湖南省长沙市长郡中学2022--2023学年高二上学期第二次线上月考化学试题
解题方法
4 . 在硫酸工业中,通过下列反应使 氧化为
氧化为 :
:
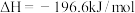 。下表列出了在不同温度和压强下,反应达到平衡时
。下表列出了在不同温度和压强下,反应达到平衡时 的转化率。下列说法错误的是
的转化率。下列说法错误的是
 氧化为
氧化为 :
:
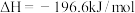 。下表列出了在不同温度和压强下,反应达到平衡时
。下表列出了在不同温度和压强下,反应达到平衡时 的转化率。下列说法错误的是
的转化率。下列说法错误的是| 温度/℃ | 平衡时 的转化率/% 的转化率/% | ||||
| 0.1MPa | 0.5MPa | 1MPa | 5MPa | 10MPa | |
| 450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
| A.从理论上分析,选择温度450-550℃,既利于平衡正向移动又利于提高反应速率 |
B.从理论上分析,为了使 尽可能多地转化为 尽可能多地转化为 ,应选择的条件是450℃,10MPa ,应选择的条件是450℃,10MPa |
C.在实际生产中,为了降低成本采用常压条件,因为常压下 的转化率已经很高了 的转化率已经很高了 |
| D.在实际生产中,通入过量的空气,既利于平衡正向移动,又利于提高反应速率 |
您最近一年使用:0次
5 . Br2是一种重要的工业原料,沸点为59℃,微溶于水,有很强的挥发性和腐蚀性。海水苦卤含溴(Br-)高达60mg•L-1,是非常宝贵的化工资源。从苦卤中提溴的一种工艺流程如图1,回答下列问题:
(1)基态溴原子的价层电子排布式为____ 。
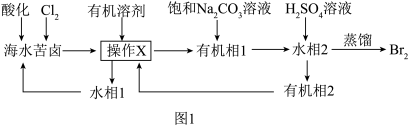
(2)①不同pH下,Cl2的用量即配氯率(实际通入Cl2和理论需要Cl2的体积比)与所得溶液中Br2的含量关系如图2所示。综合考虑,选择配氯率为和酸化的pH分别为____ 。
a.1.1,1 b.1.1,3 c.1.1,5 d.1,7
②用有机溶剂提溴的操作X名称为____ ,大部分卤代烃对环境不友好,所以工业上常用“乙酸仲丁酯”提溴,“有机相1”在原溶液的____ (填“上”或“下”)层。
③向“有机相1”中加入饱和Na2CO3溶液,Br2歧化为NaBrO3和NaBr,同时产生气体,写出化学方程式:____ ;向“水相2”中加入硫酸又可以得到Br2,离子方程式为____ 。
(3)某化学兴趣小组模拟“粗溴”蒸馏收集溴的过程,设计了如图3所示的实验装置。
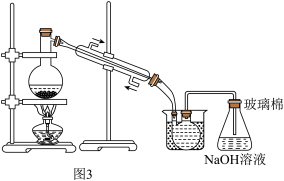
①实验过程中,蒸馏加热温度需控制80~90℃,再收集59℃的馏分。在图中补画出____ ,完成该控温实验操作,所需要的常用玻璃仪器____ 。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是____ 。
(4)现有1m3含溴(Br-)60mg•L-1的海水苦卤,若整个流程中有20%的溴损失,最终可以制得Br2质量为____ 。

(1)基态溴原子的价层电子排布式为
(2)①不同pH下,Cl2的用量即配氯率(实际通入Cl2和理论需要Cl2的体积比)与所得溶液中Br2的含量关系如图2所示。综合考虑,选择配氯率为和酸化的pH分别为

a.1.1,1 b.1.1,3 c.1.1,5 d.1,7
②用有机溶剂提溴的操作X名称为
③向“有机相1”中加入饱和Na2CO3溶液,Br2歧化为NaBrO3和NaBr,同时产生气体,写出化学方程式:
(3)某化学兴趣小组模拟“粗溴”蒸馏收集溴的过程,设计了如图3所示的实验装置。

①实验过程中,蒸馏加热温度需控制80~90℃,再收集59℃的馏分。在图中补画出
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是
(4)现有1m3含溴(Br-)60mg•L-1的海水苦卤,若整个流程中有20%的溴损失,最终可以制得Br2质量为
您最近一年使用:0次
解题方法
6 . 铈(Ce)是一种应用广泛的稀土元素,从氟碳铈矿(主要含CeFCO3、Fe2O3、SiO2)和天青石(主要含SrSO4、并含有少量Ba、Ca等杂质)伴生矿中回收铈,同时生产高纯碳酸锶(SrCO3)的一种生产工艺流程如图:
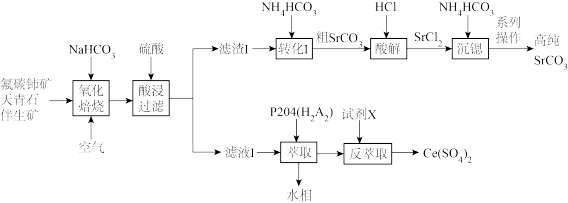
已知:①铈的常见价态是+3和+4价;
②碳酸氢铵受热易分解
(1)① 中Ce的化合价为
中Ce的化合价为_______ ;
②“氧化焙烧”时,Ce元素转化为CeO2,F元素转化为NaF,该过程中氧化剂与还原剂的物质的量之比为_______ 。
(2)焙烧温度是影响浸出率的关键因素之一,下图为不同焙烧温度对Ce和Sr浸出率的影响。
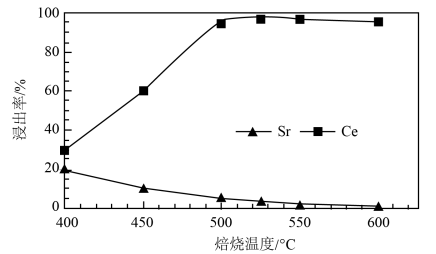
结合实际生产可知,“氧化焙烧”步骤应控制焙烧温度为_______ ,原因为_______ 。
(3)“沉锶”步骤中发生的离子反应方程式:_______ 。
(4)“萃取”步骤的原理为: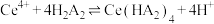 ,则试剂X为
,则试剂X为_______ 。

已知:①铈的常见价态是+3和+4价;
②碳酸氢铵受热易分解
(1)①
 中Ce的化合价为
中Ce的化合价为②“氧化焙烧”时,Ce元素转化为CeO2,F元素转化为NaF,该过程中氧化剂与还原剂的物质的量之比为
(2)焙烧温度是影响浸出率的关键因素之一,下图为不同焙烧温度对Ce和Sr浸出率的影响。

结合实际生产可知,“氧化焙烧”步骤应控制焙烧温度为
(3)“沉锶”步骤中发生的离子反应方程式:
(4)“萃取”步骤的原理为:
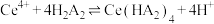 ,则试剂X为
,则试剂X为
您最近一年使用:0次
解题方法
7 . 处理含铬[Cr(Ⅵ)]废水的方法有化学沉淀法、铝还原回收法等。已知 在溶液中存在如下平衡:
在溶液中存在如下平衡: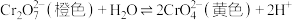 。
。
(1)钡盐沉铬法:向含 的酸性废水中加入钡盐,生成难溶于水的
的酸性废水中加入钡盐,生成难溶于水的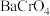 沉淀。使用
沉淀。使用 的沉铬效果要优于
的沉铬效果要优于 的原因是
的原因是_______ ,
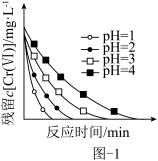
(2)亚硫酸氢钠-石灰乳还原沉淀法:向初始pH不等的几份酸性含铬废水中加入等量 ,使
,使 还原成
还原成 。测得废水中残留
。测得废水中残留 与反应时间的关系变化关系如图-1所示。
与反应时间的关系变化关系如图-1所示。
①写出 将
将 还原为
还原为 的离子方程式:
的离子方程式:_______ ,
②实际生产中,还原反应控制 为2.5左右的原因是
为2.5左右的原因是_______ 。
(3)还原回收 法:
法:
步骤I:向含 的酸性溶液中加入一定量的铝粉,充分反应,过滤。
的酸性溶液中加入一定量的铝粉,充分反应,过滤。
步骤Ⅱ:利用步骤I过滤后得到的溶液(含有 、
、 、
、 )制备
)制备 晶体。
晶体。
①研究发现,若步骤I中 偏低将会导致
偏低将会导致 的去除率下降,其原因是
的去除率下降,其原因是_______ 。
②步骤获得 晶体的实验方案为,向过滤后的溶液中
晶体的实验方案为,向过滤后的溶液中_______ ,冰水洗涤,干燥。(实验中须用到的试剂: 溶液、
溶液、 溶液、稀硫酸)
溶液、稀硫酸)
已知:i.碱性条件下 能被
能被 氧化为
氧化为 ;酸性条件下
;酸性条件下 能将
能将 还原为
还原为 。
。
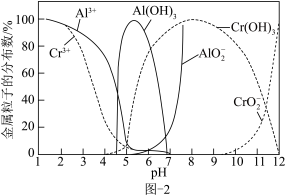
ii.常温下,体系中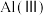 、
、 微粒的分布分数随溶液pH的变化如图-2所示(部分无关粒子已略去)。
微粒的分布分数随溶液pH的变化如图-2所示(部分无关粒子已略去)。
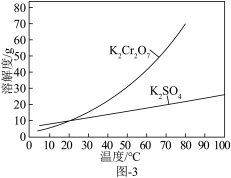
iii.不同温度下 和
和 的溶解度如图-3所示。
的溶解度如图-3所示。
 在溶液中存在如下平衡:
在溶液中存在如下平衡: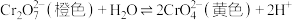 。
。(1)钡盐沉铬法:向含
 的酸性废水中加入钡盐,生成难溶于水的
的酸性废水中加入钡盐,生成难溶于水的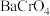 沉淀。使用
沉淀。使用 的沉铬效果要优于
的沉铬效果要优于 的原因是
的原因是(2)亚硫酸氢钠-石灰乳还原沉淀法:向初始pH不等的几份酸性含铬废水中加入等量
 ,使
,使 还原成
还原成 。测得废水中残留
。测得废水中残留 与反应时间的关系变化关系如图-1所示。
与反应时间的关系变化关系如图-1所示。
①写出
 将
将 还原为
还原为 的离子方程式:
的离子方程式:②实际生产中,还原反应控制
 为2.5左右的原因是
为2.5左右的原因是(3)还原回收
 法:
法:步骤I:向含
 的酸性溶液中加入一定量的铝粉,充分反应,过滤。
的酸性溶液中加入一定量的铝粉,充分反应,过滤。步骤Ⅱ:利用步骤I过滤后得到的溶液(含有
 、
、 、
、 )制备
)制备 晶体。
晶体。①研究发现,若步骤I中
 偏低将会导致
偏低将会导致 的去除率下降,其原因是
的去除率下降,其原因是②步骤获得
 晶体的实验方案为,向过滤后的溶液中
晶体的实验方案为,向过滤后的溶液中 溶液、
溶液、 溶液、稀硫酸)
溶液、稀硫酸)已知:i.碱性条件下
 能被
能被 氧化为
氧化为 ;酸性条件下
;酸性条件下 能将
能将 还原为
还原为 。
。ii.常温下,体系中
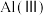 、
、 微粒的分布分数随溶液pH的变化如图-2所示(部分无关粒子已略去)。
微粒的分布分数随溶液pH的变化如图-2所示(部分无关粒子已略去)。
iii.不同温度下
 和
和 的溶解度如图-3所示。
的溶解度如图-3所示。
您最近一年使用:0次
8 . 关于工业合成NH3的说法中不正确的是
| A.适当加压可提高氨的产率 |
| B.加入催化剂可以加快反应速率 |
| C.选择400-500℃是因该温度下氨的平衡产率最高 |
| D.将含N2和H2的原料气循环使用可以提高原料的转化率 |
您最近一年使用:0次
9 . 下列事实不能用勒夏特列原理解释的是
A.用排饱和食盐水法收集 |
| B.开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| C.500℃比室温更有利于合成氨的反应 |
D.利用反应 制取金属钾,选取适宜的温度 制取金属钾,选取适宜的温度 |
您最近一年使用:0次
10 . 某地菱锰矿的主要成分为MnCO3,其中还含有少量的FeCO3、CaCO3、Al2O3等杂质。工业上以菱锰矿为原料制备高纯度碳酸锰的流程如下所示:
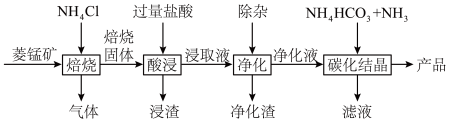
已知:MnCO3+2NH4Cl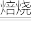 MnCl2+CO2↑+2NH3↑+H2O↑,相关金属离子[c(Mn2+)=0.1 mol/L]形成氢氧化物沉淀的pH范围如下:
MnCl2+CO2↑+2NH3↑+H2O↑,相关金属离子[c(Mn2+)=0.1 mol/L]形成氢氧化物沉淀的pH范围如下:
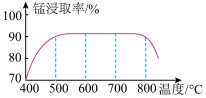
(1)焙烧时温度对锰浸取率的影响如图所示,焙烧时适宜的温度为_______ 左右,800℃以上锰的浸取率偏低,可能的原因是_______ 。
(2)净化包含三步:
①加入少量MnO2,添加少量MnO2的作用是_______ ,发生反应的离子方程式为_______ 。
②加氨水调pH,溶液的pH范围应调节至4.7~8.1,生成的沉淀主要是_______ 。
③加入MnF2,沉淀除去Ca2+。
(3)碳化结晶步骤中加入NH4HCO3生成MnCO3的离子方程式为_______ 。

已知:MnCO3+2NH4Cl
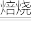 MnCl2+CO2↑+2NH3↑+H2O↑,相关金属离子[c(Mn2+)=0.1 mol/L]形成氢氧化物沉淀的pH范围如下:
MnCl2+CO2↑+2NH3↑+H2O↑,相关金属离子[c(Mn2+)=0.1 mol/L]形成氢氧化物沉淀的pH范围如下:| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 |

(2)净化包含三步:
①加入少量MnO2,添加少量MnO2的作用是
②加氨水调pH,溶液的pH范围应调节至4.7~8.1,生成的沉淀主要是
③加入MnF2,沉淀除去Ca2+。
(3)碳化结晶步骤中加入NH4HCO3生成MnCO3的离子方程式为
您最近一年使用:0次



