名校
解题方法
1 . 铁酸钡( )是一种压电材料。以重晶石(
)是一种压电材料。以重晶石( ,杂质主要有
,杂质主要有 、
、 等)为原料,采用下列路线可制备粉状
等)为原料,采用下列路线可制备粉状 。
。
回答下列问题:
(1)“焙烧”步骤中碳粉将 还原为BaS的化学方程式为
还原为BaS的化学方程式为___________ 。
(2)①用水“浸取”时主要发生反应的离子方程式为___________ 。
②流程中先用水浸取,再用盐酸酸化,相比于焙烧后的产物直接用盐酸浸取主要的优势在于___________ 。
(3)“浓缩结晶”所得 中常含有少量杂质金属离子,因此在制备高纯
中常含有少量杂质金属离子,因此在制备高纯 时需要先将
时需要先将 纯化。纯化的步骤为:将酸浸液加热至95℃浓缩,冷却结晶后得到
纯化。纯化的步骤为:将酸浸液加热至95℃浓缩,冷却结晶后得到 溶于水中,加入双氧水,然后加入氨水调节pH,过滤除去沉淀。滤液经加热浓缩,冷却结晶,即得到高纯度
溶于水中,加入双氧水,然后加入氨水调节pH,过滤除去沉淀。滤液经加热浓缩,冷却结晶,即得到高纯度 。
。
①加入双氧水的作用为___________ 。
②为何不在浓缩结晶之前加入双氧水和氨水除去杂质金属离子?___________ 。
(4)“沉淀”步骤生成难溶的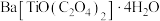
已知: 在水中剧烈水解,在“沉淀”步骤的反应体系中,根据pH不同,发生以下过程:
在水中剧烈水解,在“沉淀”步骤的反应体系中,根据pH不同,发生以下过程:
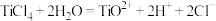 ;
;
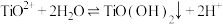 ;
;
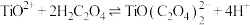
实验表明,“沉淀”反应的最佳pH条件为2.5附近。从平衡移动角度分析pH太高或太低对生成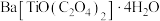 沉淀不利的原因:
沉淀不利的原因:___________ 。
(5)在氮气气氛中“热分解”生成粉状钛酸钡,对应的化学反应方程式为___________ 。
 )是一种压电材料。以重晶石(
)是一种压电材料。以重晶石( ,杂质主要有
,杂质主要有 、
、 等)为原料,采用下列路线可制备粉状
等)为原料,采用下列路线可制备粉状 。
。
回答下列问题:
(1)“焙烧”步骤中碳粉将
 还原为BaS的化学方程式为
还原为BaS的化学方程式为(2)①用水“浸取”时主要发生反应的离子方程式为
②流程中先用水浸取,再用盐酸酸化,相比于焙烧后的产物直接用盐酸浸取主要的优势在于
(3)“浓缩结晶”所得
 中常含有少量杂质金属离子,因此在制备高纯
中常含有少量杂质金属离子,因此在制备高纯 时需要先将
时需要先将 纯化。纯化的步骤为:将酸浸液加热至95℃浓缩,冷却结晶后得到
纯化。纯化的步骤为:将酸浸液加热至95℃浓缩,冷却结晶后得到 溶于水中,加入双氧水,然后加入氨水调节pH,过滤除去沉淀。滤液经加热浓缩,冷却结晶,即得到高纯度
溶于水中,加入双氧水,然后加入氨水调节pH,过滤除去沉淀。滤液经加热浓缩,冷却结晶,即得到高纯度 。
。①加入双氧水的作用为
②为何不在浓缩结晶之前加入双氧水和氨水除去杂质金属离子?
(4)“沉淀”步骤生成难溶的
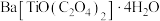
已知:
 在水中剧烈水解,在“沉淀”步骤的反应体系中,根据pH不同,发生以下过程:
在水中剧烈水解,在“沉淀”步骤的反应体系中,根据pH不同,发生以下过程: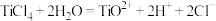 ;
;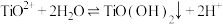 ;
;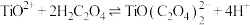
实验表明,“沉淀”反应的最佳pH条件为2.5附近。从平衡移动角度分析pH太高或太低对生成
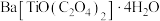 沉淀不利的原因:
沉淀不利的原因:(5)在氮气气氛中“热分解”生成粉状钛酸钡,对应的化学反应方程式为
您最近一年使用:0次
2 . 某矿石的组成为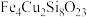 ,以此为原料实现如下转化:
,以此为原料实现如下转化:
请回答:
(1)下列说法正确的是________(填序号)。
(2) 与矿石中金属阳离子的配位能力由强到弱的顺序是
与矿石中金属阳离子的配位能力由强到弱的顺序是________ 。
(3)生成深蓝色溶液的化学方程式为________ 。
(4) 遇酸会迅速分解,请设计实验证明氧化产物与还原产物
遇酸会迅速分解,请设计实验证明氧化产物与还原产物________ 。 遇酸分解的离子方程式为
遇酸分解的离子方程式为________ 。
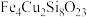 ,以此为原料实现如下转化:
,以此为原料实现如下转化:
请回答:
(1)下列说法正确的是________(填序号)。
A. 是由极性键形成的极性分子 是由极性键形成的极性分子 |
B.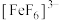 的氧化性弱于 的氧化性弱于 |
| C.矿石中Si与O形成相互独立的正四面体结构 |
D.固体A中含有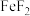 |
(2)
 与矿石中金属阳离子的配位能力由强到弱的顺序是
与矿石中金属阳离子的配位能力由强到弱的顺序是(3)生成深蓝色溶液的化学方程式为
(4)
 遇酸会迅速分解,请设计实验证明氧化产物与还原产物
遇酸会迅速分解,请设计实验证明氧化产物与还原产物 遇酸分解的离子方程式为
遇酸分解的离子方程式为
您最近一年使用:0次
解题方法
3 . 以方铅矿(主要含PbS、FeS)和废铅膏(主要含PbO2、PbO)为原料实现如下转化。 的形式浸出。
的形式浸出。
②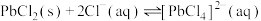

请回答:
(1)浸出过程中,发生了多个反应。请写出PbO2、PbS在盐酸和MgCl2溶液的作用下转化为 的离子方程式
的离子方程式___________ ;在浸出时,MgCl2的作用为___________ 。
(2)H2S气体主要是由___________ (填化学式)反应产生的,___________ (填“可以”、“不可以”)用CuSO4溶液吸收。
(3)下列说法正确的是___________。
(4)设计实验,验证结晶后过滤得到的滤液中含有Fe元素___________ 。
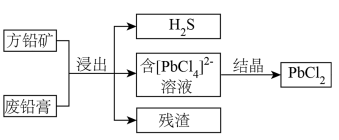
 的形式浸出。
的形式浸出。②
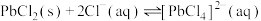

请回答:
(1)浸出过程中,发生了多个反应。请写出PbO2、PbS在盐酸和MgCl2溶液的作用下转化为
 的离子方程式
的离子方程式(2)H2S气体主要是由
(3)下列说法正确的是___________。
A.浸出产生的 最终氧化为 最终氧化为 存在于溶液中 存在于溶液中 |
B. 的空间构型是正四面体 的空间构型是正四面体 |
C.可以向含 的溶液中加入适量的冷水结晶获得PbCl2 的溶液中加入适量的冷水结晶获得PbCl2 |
| D.工业上主要通过电解熔融PbCl2制金属Pb |
(4)设计实验,验证结晶后过滤得到的滤液中含有Fe元素
您最近一年使用:0次
解题方法
4 . 过氧化钙晶体(CaO2⋅8H2O,微溶于水,不溶于乙醇、乙醚)是重要的化学品,常用作杀菌剂、防腐剂、化妆品的添加剂等。实验室以石灰石(含有少量铁、硅的氧化物)为原料制备CaO2的实验流程如下:
(1)由石灰石制备纯CaCO3的过程需经过盐酸溶解、H2O2溶液氧化、调pH除铁、 溶液沉钙等步骤。
溶液沉钙等步骤。
①“调pH除铁”后,需用如图所示的热抽滤装置除去 ,相比普通过滤装置,热抽滤装置的优点是
,相比普通过滤装置,热抽滤装置的优点是___________ 。 溶液沉钙”反应的离子方程式为
溶液沉钙”反应的离子方程式为___________ 。
(2)“制备”过程所用装置如下图所示:___________ ,若用乙装置制备NH3,,写出反应的化学方程式:___________ 。
②仪器X的名称为___________ 。
③“制备” 需在冰水浴中进行,温度需控制在0℃,可采取的方法是
需在冰水浴中进行,温度需控制在0℃,可采取的方法是___________ 。生成 的离子方程式为
的离子方程式为___________ ;CaCl2与H2O2直接反应不易发生,制备时加入适量氨水有利于CaO2生成,其原因可能是___________ 。
(3)产品中CaO2含量测定。高锰酸钾滴定法原理为在酸性条件下,CaO2与稀酸反应生成H2O2,用标准酸性KMnO4溶液滴定所生成的H2O2,以确定CaO2含量。下列关于滴定分析的说法,错误的是___________(填字母)。

(1)由石灰石制备纯CaCO3的过程需经过盐酸溶解、H2O2溶液氧化、调pH除铁、
 溶液沉钙等步骤。
溶液沉钙等步骤。①“调pH除铁”后,需用如图所示的热抽滤装置除去
 ,相比普通过滤装置,热抽滤装置的优点是
,相比普通过滤装置,热抽滤装置的优点是
 溶液沉钙”反应的离子方程式为
溶液沉钙”反应的离子方程式为(2)“制备”过程所用装置如下图所示:

②仪器X的名称为
③“制备”
 需在冰水浴中进行,温度需控制在0℃,可采取的方法是
需在冰水浴中进行,温度需控制在0℃,可采取的方法是 的离子方程式为
的离子方程式为(3)产品中CaO2含量测定。高锰酸钾滴定法原理为在酸性条件下,CaO2与稀酸反应生成H2O2,用标准酸性KMnO4溶液滴定所生成的H2O2,以确定CaO2含量。下列关于滴定分析的说法,错误的是___________(填字母)。
| A.滴定时应一直观察滴定管中溶液体积的变化 |
| B.当滴入半滴酸性KMnO4溶液后,溶液颜色从无色刚好变为浅红色,且半分钟内不变色,表示已经到达滴定终点 |
| C.滴定前滴定管尖嘴内有气泡,滴定后尖嘴内无气泡,则测定结果偏小 |
| D.读取KMnO4溶液体积时,滴定前俯视读数,滴定后仰视读数,则测定结果偏大 |
您最近一年使用:0次
名校
解题方法
5 . 工业上以软锰矿(主要成分为MnO2,还含有少量Fe2O3)和辉钼矿(主要成分为MoS2,还含有少量Si、Ni的氧化物)为原料,制备四钼酸铵晶体[(NH4)2Mo4O13 2H2O]和硫酸锰晶体的工艺流程如下:
2H2O]和硫酸锰晶体的工艺流程如下:  分别为19.4和12.6;
分别为19.4和12.6; 。
。
回答下列问题:
(1)为了提高焙烧效率,可以采取的措施有___________ (写一条即可);“高温焙烧”时MnO2、MoS2转化为MnMoO4、MnSO4,写出该反应的化学方程式___________ 。
(2)“除铁”过程中加入碳酸钠调节溶液的pH至2,生成难溶于水的黄钠铁矾[NaFe3(SO4)2(OH)6],写出该反应的离子方程式___________ 。
(3)“除铁”后的溶液中c(Mn2+)=0.5 mol L-1,当溶液中可溶组分浓度c≤10-5mol
L-1,当溶液中可溶组分浓度c≤10-5mol L-1时,可认为已除尽,则“除镍”应控制溶液pH的范围是
L-1时,可认为已除尽,则“除镍”应控制溶液pH的范围是___________ [已知pc(S2-)=-lgc(S2-),该溶液中pc(S2-)和pH的关系为pc(S2-)=15.1-pH;忽略溶液体积变化]。
(4)硫酸锰在不同温度下的溶解度和该温度范围内析出晶体的组成如下图所示。从过滤所得的滤液中获得较高纯度MnSO4 H2O的操作是:控制温度在80~90 ℃之间蒸发结晶,
H2O的操作是:控制温度在80~90 ℃之间蒸发结晶,___________ ,使固体MnSO4 H2O与溶液分离,
H2O与溶液分离,___________ ,真空干燥。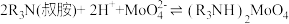 ,则“反萃取”中的试剂X最适宜选用
,则“反萃取”中的试剂X最适宜选用___________ (填标号)。
a.稀硫酸 b.(NH4)2SO4溶液 c.NaOH溶液 d.氨水
从“母液”中回收的副产品主要是___________ (填名称)。
 2H2O]和硫酸锰晶体的工艺流程如下:
2H2O]和硫酸锰晶体的工艺流程如下: 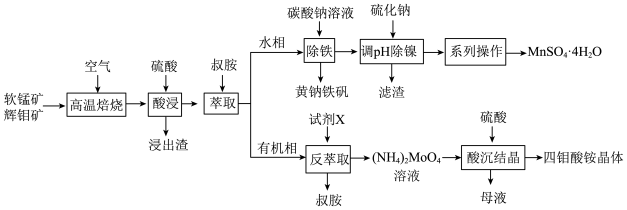
 分别为19.4和12.6;
分别为19.4和12.6; 。
。回答下列问题:
(1)为了提高焙烧效率,可以采取的措施有
(2)“除铁”过程中加入碳酸钠调节溶液的pH至2,生成难溶于水的黄钠铁矾[NaFe3(SO4)2(OH)6],写出该反应的离子方程式
(3)“除铁”后的溶液中c(Mn2+)=0.5 mol
 L-1,当溶液中可溶组分浓度c≤10-5mol
L-1,当溶液中可溶组分浓度c≤10-5mol L-1时,可认为已除尽,则“除镍”应控制溶液pH的范围是
L-1时,可认为已除尽,则“除镍”应控制溶液pH的范围是(4)硫酸锰在不同温度下的溶解度和该温度范围内析出晶体的组成如下图所示。从过滤所得的滤液中获得较高纯度MnSO4
 H2O的操作是:控制温度在80~90 ℃之间蒸发结晶,
H2O的操作是:控制温度在80~90 ℃之间蒸发结晶, H2O与溶液分离,
H2O与溶液分离,
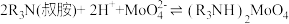 ,则“反萃取”中的试剂X最适宜选用
,则“反萃取”中的试剂X最适宜选用a.稀硫酸 b.(NH4)2SO4溶液 c.NaOH溶液 d.氨水
从“母液”中回收的副产品主要是
您最近一年使用:0次
名校
解题方法
6 . 工业上利用锌焙砂(主要成分为 ,含有少量
,含有少量 、
、 、
、 等)生产高纯
等)生产高纯 的流程示意图如下。
的流程示意图如下。 溶液和氨水“浸出”锌焙砂。
溶液和氨水“浸出”锌焙砂。
①“浸出”前,锌焙砂预先粉碎的目的是_____ 。
②通过“浸出”步骤,锌焙砂中的 转化为
转化为 ,该反应的离子方程式为
,该反应的离子方程式为_____ 。
(2)“浸出”时 转化为
转化为 。“除砷”步骤①中用
。“除砷”步骤①中用 作氧化剂。
作氧化剂。
i.指出 中
中 与
与 的化合价:
的化合价:_____ 。
ii.步骤①的离子方程式为_____ 。
(3)“除重金属”时加入 溶液。滤渣Ⅱ中含有的主要物质是
溶液。滤渣Ⅱ中含有的主要物质是_____ 和 。
。
(4)“蒸氨”时会出现白色固体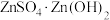 ,运用平衡移动原理解释原因:
,运用平衡移动原理解释原因:_____ 。
(5)“沉锌”步骤①中加入足量 溶液将白色固体转化为
溶液将白色固体转化为 的离子方程式为
的离子方程式为_____ 。
(6)“煅烧”步骤中,不同温度下, 分解的失重曲线和产品
分解的失重曲线和产品 的比表面积变化情况如图甲、图乙所示。
的比表面积变化情况如图甲、图乙所示。
已知:i.固体失重质量分数=
ii.比表面积指单位质量固体所具有的总面积;比表面积越大,产品 的活性越高。
的活性越高。 ,300min后固体失重质量分数为33.3%,则
,300min后固体失重质量分数为33.3%,则 的分解率为
的分解率为_____ %(保留到小数点后一位)。
②根据图1和图2,获得高产率( 分解率
分解率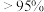 )、高活性(
)、高活性( 比表面积
比表面积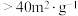 )产品
)产品 的最佳条件是
的最佳条件是_____ (填字母序号)。
a.恒温280℃,60~120min
b.恒温300℃,240~300min
c.恒温350℃,240~300min
d.恒温550℃,60~120min
(7)该流程中可循环利用的物质有_____ 。
 ,含有少量
,含有少量 、
、 、
、 等)生产高纯
等)生产高纯 的流程示意图如下。
的流程示意图如下。
已知: 结构如图所示
结构如图所示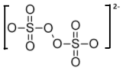
 溶液和氨水“浸出”锌焙砂。
溶液和氨水“浸出”锌焙砂。①“浸出”前,锌焙砂预先粉碎的目的是
②通过“浸出”步骤,锌焙砂中的
 转化为
转化为 ,该反应的离子方程式为
,该反应的离子方程式为(2)“浸出”时
 转化为
转化为 。“除砷”步骤①中用
。“除砷”步骤①中用 作氧化剂。
作氧化剂。i.指出
 中
中 与
与 的化合价:
的化合价:ii.步骤①的离子方程式为
(3)“除重金属”时加入
 溶液。滤渣Ⅱ中含有的主要物质是
溶液。滤渣Ⅱ中含有的主要物质是 。
。(4)“蒸氨”时会出现白色固体
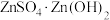 ,运用平衡移动原理解释原因:
,运用平衡移动原理解释原因:(5)“沉锌”步骤①中加入足量
 溶液将白色固体转化为
溶液将白色固体转化为 的离子方程式为
的离子方程式为(6)“煅烧”步骤中,不同温度下,
 分解的失重曲线和产品
分解的失重曲线和产品 的比表面积变化情况如图甲、图乙所示。
的比表面积变化情况如图甲、图乙所示。已知:i.固体失重质量分数=

ii.比表面积指单位质量固体所具有的总面积;比表面积越大,产品
 的活性越高。
的活性越高。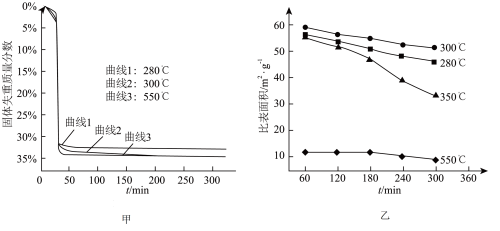
 ,300min后固体失重质量分数为33.3%,则
,300min后固体失重质量分数为33.3%,则 的分解率为
的分解率为②根据图1和图2,获得高产率(
 分解率
分解率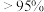 )、高活性(
)、高活性( 比表面积
比表面积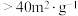 )产品
)产品 的最佳条件是
的最佳条件是a.恒温280℃,60~120min
b.恒温300℃,240~300min
c.恒温350℃,240~300min
d.恒温550℃,60~120min
(7)该流程中可循环利用的物质有
您最近一年使用:0次
解题方法
7 . I.V2O5是一种重要的工业催化剂。
(1)V2O5催化剂参与SO2催化氧化反应的机理如图。

V5+催化过程可以表示为:
①……
②O2+4V4+=4V5++2O2-
①的离子方程式是___________ 。
Ⅱ.某V2O5失活催化剂(主要含V2O5、V2O4、SiO2、SO3以及少量的Fe等)是重要的含钒二次资源。从失活催化剂提取钒的一种工艺流程如下。
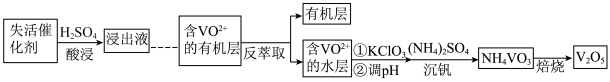
资料:
ⅰ.HA(有机酸性萃取剂)对金属阳离子的萃取能力由强到弱的顺序为:Fe3+>VO2+>VO >Fe2+;
>Fe2+;
ⅱ.溶液pH<4.0时,+5价钒的存在形式为VO ,6.0≤pH≤8.0时,正五价钒元素的存在形式为VO
,6.0≤pH≤8.0时,正五价钒元素的存在形式为VO ,且二者可相互转化:VO
,且二者可相互转化:VO +H2O
+H2O VO
VO +2H+。
+2H+。
(2)浸出液中含有VO 、VO2+、Fe3+、Fe2+等阳离子,浸出VO
、VO2+、Fe3+、Fe2+等阳离子,浸出VO 的离子方程式是
的离子方程式是___________ 。
(3)流程中“……”包含的操作顺序为___________ 。
(4)“萃取”“反萃取”过程机理为:VO2+(水层)+2HA(有机层) VOA2(有机层)+2H+(水层)。反萃取剂选择H2SO4,原因是
VOA2(有机层)+2H+(水层)。反萃取剂选择H2SO4,原因是___________ 。
(5)“沉钒”过程中需先加入KClO3,然后通入氨气调节pH为6~8,再加(NH4)2SO4。
①加入KClO3,反应的离子方程式是___________ 。
②结合平衡移动原理解释通入氨气的作用___________ 。
(6)产品中V2O5纯度的测定方法如下。

已知:此过程中,MnO 可氧化Fe2+,且不与VO2+反应。产品中的杂质不参与反应。
可氧化Fe2+,且不与VO2+反应。产品中的杂质不参与反应。
步骤iii中标准KMnO4溶液的浓度和消耗的体积分别为c和V,计算产品中V2O5的纯度还需要的实验数据有___________ 。
(1)V2O5催化剂参与SO2催化氧化反应的机理如图。

V5+催化过程可以表示为:
①……
②O2+4V4+=4V5++2O2-
①的离子方程式是
Ⅱ.某V2O5失活催化剂(主要含V2O5、V2O4、SiO2、SO3以及少量的Fe等)是重要的含钒二次资源。从失活催化剂提取钒的一种工艺流程如下。

资料:
ⅰ.HA(有机酸性萃取剂)对金属阳离子的萃取能力由强到弱的顺序为:Fe3+>VO2+>VO
 >Fe2+;
>Fe2+;ⅱ.溶液pH<4.0时,+5价钒的存在形式为VO
 ,6.0≤pH≤8.0时,正五价钒元素的存在形式为VO
,6.0≤pH≤8.0时,正五价钒元素的存在形式为VO ,且二者可相互转化:VO
,且二者可相互转化:VO +H2O
+H2O VO
VO +2H+。
+2H+。(2)浸出液中含有VO
 、VO2+、Fe3+、Fe2+等阳离子,浸出VO
、VO2+、Fe3+、Fe2+等阳离子,浸出VO 的离子方程式是
的离子方程式是(3)流程中“……”包含的操作顺序为
(4)“萃取”“反萃取”过程机理为:VO2+(水层)+2HA(有机层)
 VOA2(有机层)+2H+(水层)。反萃取剂选择H2SO4,原因是
VOA2(有机层)+2H+(水层)。反萃取剂选择H2SO4,原因是(5)“沉钒”过程中需先加入KClO3,然后通入氨气调节pH为6~8,再加(NH4)2SO4。
①加入KClO3,反应的离子方程式是
②结合平衡移动原理解释通入氨气的作用
(6)产品中V2O5纯度的测定方法如下。

已知:此过程中,MnO
 可氧化Fe2+,且不与VO2+反应。产品中的杂质不参与反应。
可氧化Fe2+,且不与VO2+反应。产品中的杂质不参与反应。步骤iii中标准KMnO4溶液的浓度和消耗的体积分别为c和V,计算产品中V2O5的纯度还需要的实验数据有
您最近一年使用:0次
解题方法
8 . 金属钼具有高强度、高熔点、耐磨抗腐性等优点,用于制火箭、卫星的合金构件。钼酸钠晶体(Na2MoO4·2H2O)是一种重要的金属缓蚀剂。利用钼矿(主要成分MoS2,还含少量钙、镁等元素)为原料冶炼金属钼和钼酸钠晶体的主要流程图如下:
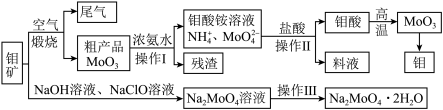
(1)Na2MoO4·2H2O中钼元素的价态为___________ ,煅烧产生的尾气引起的环境危害主要是:___________ 。
(2)用浓氨水溶解粗产品的离子方程式是___________ ,由图中信息可以判断MoO3是___________ 氧化物(填“酸性”“碱性”或“两性”)。
(3)操作Ⅰ是___________ ,操作Ⅱ所得的钼酸要水洗,检验钼酸是否洗涤干净的方法是___________ 。
(4)采用NaClO氧化钼矿的方法将矿石中的钼浸出。
①请配平以下化学反应:_________
NaClO+___________MoS2+___________NaOH=__________Na2MoO4+___________Na2SO4+___________NaCl+___________H2O。
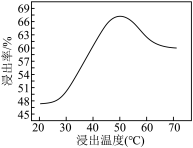
②钼的浸出率随着温度变化如图,浸出反应属于___________ 反应(放热或吸热)。

(1)Na2MoO4·2H2O中钼元素的价态为
(2)用浓氨水溶解粗产品的离子方程式是
(3)操作Ⅰ是
(4)采用NaClO氧化钼矿的方法将矿石中的钼浸出。
①请配平以下化学反应:
NaClO+___________MoS2+___________NaOH=__________Na2MoO4+___________Na2SO4+___________NaCl+___________H2O。
②钼的浸出率随着温度变化如图,浸出反应属于

您最近一年使用:0次
名校
9 . 含氯化合物在工农业生产和日常生活中用途十分广泛。
Ⅰ.使用软锰矿为原料精制高纯度的MnO2,并运用综合制取技术最终制取含氯漂白液、漂白粉的工艺流程如图。

(1)过程Ⅳ中,MnO2与浓盐酸反应的离子方程式为______ 。
(2)过程Ⅲ中,MnO2 在___________极产生。
(3)过程Ⅴ制备漂白液(有效成分NaClO)和漂白粉(有效成分Ca(ClO)2)。
①有关漂白粉的说法正确的是:______ 。
A.漂白粉是混合物,其有效成分是次氯酸钙
B.为了增强漂白粉漂白效果,使用时可加少量食醋
C.漂白粉见光不稳定,应当避光放置
D.漂白粉可与CO2 、 H2O 反应,由此可判断次氯酸的酸性弱于碳酸
②漂白液与洁厕灵(主要成分为浓盐酸)禁止混用的原因(用离子方程式表示):______ 。
Ⅱ.氯气可用于海水提溴,其工艺流程如图。

(4)进入吹出塔前海水与Cl2发生反应时往往向其中滴入一些稀硫酸,原因为________ 。
(5)从吸收塔流出的溶液中主要含的负离子有___________。
Ⅲ.为探究氯气的性质,某同学设计了如图所示的实验装置。

(6)A为氯气制备装置,装置B、C中依次放入的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,请提出合理的改进方法:________ 。E中的反应的离子方程方程式为________ 。
(7)为验证尾气吸收后的溶液中存在Cl-,正确的操作是________ 。
Ⅰ.使用软锰矿为原料精制高纯度的MnO2,并运用综合制取技术最终制取含氯漂白液、漂白粉的工艺流程如图。

(1)过程Ⅳ中,MnO2与浓盐酸反应的离子方程式为
(2)过程Ⅲ中,MnO2 在___________极产生。
| A.正极 | B.负极 | C.阳极 | D.阴极 |
(3)过程Ⅴ制备漂白液(有效成分NaClO)和漂白粉(有效成分Ca(ClO)2)。
①有关漂白粉的说法正确的是:
A.漂白粉是混合物,其有效成分是次氯酸钙
B.为了增强漂白粉漂白效果,使用时可加少量食醋
C.漂白粉见光不稳定,应当避光放置
D.漂白粉可与CO2 、 H2O 反应,由此可判断次氯酸的酸性弱于碳酸
②漂白液与洁厕灵(主要成分为浓盐酸)禁止混用的原因(用离子方程式表示):
Ⅱ.氯气可用于海水提溴,其工艺流程如图。

(4)进入吹出塔前海水与Cl2发生反应时往往向其中滴入一些稀硫酸,原因为
(5)从吸收塔流出的溶液中主要含的负离子有___________。
| A.OH- | B.Br- | C. | D. |
Ⅲ.为探究氯气的性质,某同学设计了如图所示的实验装置。

(6)A为氯气制备装置,装置B、C中依次放入的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,请提出合理的改进方法:
(7)为验证尾气吸收后的溶液中存在Cl-,正确的操作是
您最近一年使用:0次
名校
10 . 重铬酸钠(Na2Cr2O7)是一种重要的氧化剂,以铬矿石(Cr2O3,含FeO、Al2O3、SiO2等杂质)为原料制取重铬酸钠的流程如下:
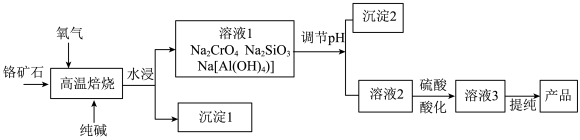
(1)写出“高温焙烧”时Cr2O3转化为Na2CrO4的化学方程式___________ 。
(2)沉淀2的主要成分为___________ 。
(3)用硫酸酸化使溶液2中主要溶质Na2CrO4转化为Na2Cr2O7,从平衡的角度 说明其原理_________ (要求:使用必要的文字和方程式 )。
(4)利用膜电解技术(装置如图所示),以Na2CrO4为主要原料制备Na2Cr2O7的总反应方程式为: 4Na2CrO4+4H2O 2Na2Cr2O7+4NaOH+2H2↑+O2↑。
2Na2Cr2O7+4NaOH+2H2↑+O2↑。
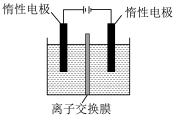
该装置应选用______ (填“阴”或“阳”)离子交换膜,电解时阴极上的电极反应式为_______ 。

(1)写出“高温焙烧”时Cr2O3转化为Na2CrO4的化学方程式
(2)沉淀2的主要成分为
(3)用硫酸酸化使溶液2中主要溶质Na2CrO4转化为Na2Cr2O7,
(4)利用膜电解技术(装置如图所示),以Na2CrO4为主要原料制备Na2Cr2O7的总反应方程式为: 4Na2CrO4+4H2O
 2Na2Cr2O7+4NaOH+2H2↑+O2↑。
2Na2Cr2O7+4NaOH+2H2↑+O2↑。
该装置应选用
您最近一年使用:0次



