 还原转化系统能把呼出的
还原转化系统能把呼出的 捕集、分离并与空间站电解水系统产生的
捕集、分离并与空间站电解水系统产生的 进行加氢处理,从而实现空间站内物料的循环利用。
进行加氢处理,从而实现空间站内物料的循环利用。(1)一种借助光将
 转化为
转化为 的催化机理如图所示。该转化过程总反应的化学方程式是
的催化机理如图所示。该转化过程总反应的化学方程式是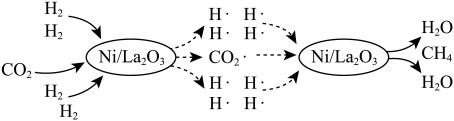
(2)一定条件下,
 和
和 还可发生如下两个平行反应:
还可发生如下两个平行反应:i.


ii.

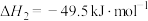
①已知相关键能数据如下表:
| 化学键 |  |  |  |  |
键能/ | 436 | 464 | 803 | 1072 |

 。
。②为了提高
 的产率,理论上应采用的措施是
的产率,理论上应采用的措施是A.低温低压 B.高温低压 C.高温高压 D.低温高压
③保持温度
 ,压强
,压强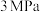 ,按投料比
,按投料比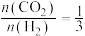 向密闭容器中充入
向密闭容器中充入 和
和 ,反应相同时间测得不同催化剂下
,反应相同时间测得不同催化剂下 转化率和
转化率和 选择性的相关实验数据如下表所示(已知
选择性的相关实验数据如下表所示(已知 选择性:转化的
选择性:转化的 中生成
中生成 的百分比)。
的百分比)。| 催化剂 |  转化率 转化率 |  选择性 选择性 |
| cat.1 | 21.9% | 67.3% |
| cat.2 | 36.1% | 100.0% |
A.气体压强不再变化 B.气体平均相对分子质量不再变化
C.
 和
和 的物质的量之比为
的物质的量之比为 D.
D. 和
和 的物质的量之比不再变化
的物质的量之比不再变化(3)一定条件下,向
 恒容密闭容器中充入
恒容密闭容器中充入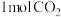 和
和 ,只发生上述反应ii,达平衡时,
,只发生上述反应ii,达平衡时, 的转化率为80%,则该温度下的平衡常数
的转化率为80%,则该温度下的平衡常数
(4)若恒容密闭容器中只发生上述反应i,在进气比
 不同、温度不同时,测得相应的
不同、温度不同时,测得相应的 平衡转化率如图所示。则B和D两点的温度
平衡转化率如图所示。则B和D两点的温度
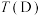 (填“<”,“>”,或“=”),其原因是
(填“<”,“>”,或“=”),其原因是
 的资源化利用成为近年来的重点研究方向。
的资源化利用成为近年来的重点研究方向。利用
 氧化丙烷脱氢制取丙烯有以下相关反应。
氧化丙烷脱氢制取丙烯有以下相关反应。反应
 :逆水煤气转换:
:逆水煤气转换:
反应II:丙烷在无氧条件下直接脱氢:

反应III:
 氧化丙烷脱氢:
氧化丙烷脱氢:
已知:
 和
和 的燃烧热分别为
的燃烧热分别为 、
、 ;
;
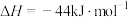 。
。(1)
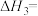
(2)下列说法不正确的是___________(填序号)。
A.反应I的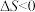 |
| B.选择合适的催化剂可提高丙烯的选择性和平衡产率 |
| C.恒温恒压下通入水蒸气有利于增大丙烷的转化率 |
| D.为得到更多的丙烯,实际生产中反应温度越高越好 |
 氧化丙烷脱氢制取丙烯可采用铬的氧化物作为催化剂,反应机理如图甲所示,请在图乙上画出反应过程能量的变化趋势图
氧化丙烷脱氢制取丙烯可采用铬的氧化物作为催化剂,反应机理如图甲所示,请在图乙上画出反应过程能量的变化趋势图
(4)
 加氢时除发生反应I外,还可产生
加氢时除发生反应I外,还可产生 ,具体反应如下:
,具体反应如下:反应IV、


在相同容积的密闭容器中按
 通入
通入 和
和 ,分别在0.1MPa和1MPa下进行反应。分析温度对平衡体系中
,分别在0.1MPa和1MPa下进行反应。分析温度对平衡体系中 、CO、
、CO、 的影响,设这三种气体物质的量分数之和为1,其中CO和
的影响,设这三种气体物质的量分数之和为1,其中CO和 的物质的量分数与温度变化关系如图丙所示。
的物质的量分数与温度变化关系如图丙所示。
①表示0.1MPa时
 物质的量分数随着温度变化关系的曲线是
物质的量分数随着温度变化关系的曲线是②N点低于M点的原因是
③590℃时反应IV的平衡常数
 为
为 ,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡体系中B的物质的量分数]。
,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡体系中B的物质的量分数]。
 2NH3(g) ΔH= -92.4 kJ/mol。
2NH3(g) ΔH= -92.4 kJ/mol。(1)判断该反应的自发性并说明理由
(2)在一定温度下,NH3溶于水的过程及其平衡常数为:
NH3(g)
 NH3(aq) K1=
NH3(aq) K1=
NH3(aq)+H2O(l)
 NH3·H2O(aq) K2
NH3·H2O(aq) K2NH3·H2O (aq)

 (aq)+OH-(aq) K3
(aq)+OH-(aq) K3忽略H2O的电离,NH3 在水中的溶解度(以物质的量浓度表示)为c,用平衡压强p和上述平衡常数表示,则c=
(3)工业合成氨流程示意图如图1:
①工业上通常在400~500℃下进行合成氨反应,用碰撞理论解释为什么不在常温下进行反应
②干燥净化的目的是
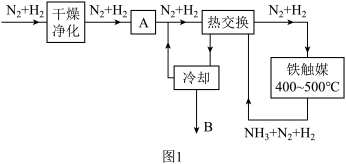
③工业上N2和H2混合气反应后经过图1中的过程再及时补充N2和H2进入合成塔反应,以一定量的N2和H2为研究对象,计算转化率时不考虑新补充进入的N2和H2,循环过程中转化率随温度变化曲线如图2所示,图2所示进程中表示热交换过程的是
A. a1→b1 B. b1→c1 C. c1→a2 D. a2→c1 E. c1→b2 F. b2→c2 G. c2→a3 H.a3→c2
(4)已知Arrhenius经验公式为Rlnk=-
 +C(Ea为活化能,k为速率常数,R和C为常数),假设使用现有合成氨催化剂铁触媒时的图象如图所示,2016 年我国科学家研制出一种新型催化剂,合成氨条件降为350℃、1MPa,在图中画出在使用该高效催化剂下Rlnk与
+C(Ea为活化能,k为速率常数,R和C为常数),假设使用现有合成氨催化剂铁触媒时的图象如图所示,2016 年我国科学家研制出一种新型催化剂,合成氨条件降为350℃、1MPa,在图中画出在使用该高效催化剂下Rlnk与 的关系图。
的关系图。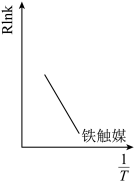
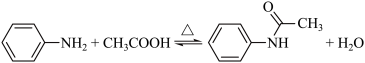
实验参数:
| 名称 | 苯胺 | 乙酸 | 乙酰苯胺 |
| 式量 | 93 | 60 | 135 |
| 性状 | 无色油状液体,具有还原性 | 无色液体 | 白色晶体 |
| 密度/(g·cm-3) | 1.02 | 1.05 | 1.22 |
| 沸点/℃ | 184.4 | 118.1 | 304 |
| 溶解度 | 微溶于水 | 易溶于水 | 微溶于冷水,溶于热水 |
| 易溶于乙醇、乙醚等 | 易溶于乙醇、乙醚 | 易溶于乙醇、乙醚 |

注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离。
实验步骤:
步骤1:在圆底烧瓶中加入无水苯胺9.30 mL,冰醋酸15.4 mL,锌粉0.100 g, 安装仪器,加入沸石,调节加热温度,使分馏柱顶温度控制在105℃左右,反应约60~80 min,反应生成的水及少量醋酸被蒸出。
步骤2:在搅拌下,趁热将烧瓶中物料以细流状倒入盛有100 mL冰水的烧杯中,剧烈搅拌,并冷却结晶,抽滤、洗涤、干燥,得到乙酰苯胺粗品。
步骤3:将此粗乙酰苯胺进行重结晶,晾干,称重,计算产率。
(1)步骤1中所选圆底烧瓶的最佳规格是
a.25 mL b.50 mL c.150 mL d.200 mL
(2)实验中加入少量锌粉的目的是
(3)步骤1加热可用
(4)步骤2中结晶时,若冷却后仍无晶体析出,可采用的方法是
a.用少量冷水洗 b.用少量热水洗 c.先用冷水洗,再用热水洗 d.用酒精洗
(5)乙酰苯胺粗品因含杂质而显色,欲用重结晶进行提纯,步骤如下:热水溶解、
a.蒸发结晶 b.冷却结晶 c.趁热过滤 d.加入活性炭
(6)该实验最终得到纯品9.18 g,则乙酰苯胺的产率是
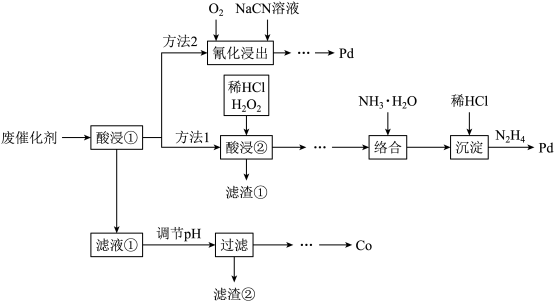
请回答下列问题:
(1)方法2比方法1后续回收流程相对简单,但工业上不常用方法2,从绿色化学角度分析原因是
(2)“酸浸②”时,Pt和Pd分别转化为
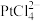 和
和 ,请写出Pd转化为
,请写出Pd转化为 的离子方程式为
的离子方程式为(3)“酸浸②”时,可用NaClO替代H2O2,两者相比,
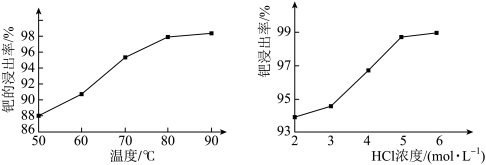
(4)酸浸②在一定温度下充分浸取钯,得到氯亚钯酸(H2PdCl4)溶液,钯的浸出率与反应的温度、HCl浓度的关系如图所示。最佳的浸取温度和HCl浓度分别为
(5)“络合”过程后得到
 和
和 ,“沉淀”时,搅拌滴加盐酸调节pH将
,“沉淀”时,搅拌滴加盐酸调节pH将 转化为
转化为 沉淀,结合平衡移动原理解释实现该转化的原因
沉淀,结合平衡移动原理解释实现该转化的原因(6)已知:常温下,
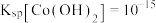 ,
, 。若滤液①中
。若滤液①中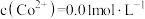 ,则分离出Al(OH)3沉淀需调节pH的范围是
,则分离出Al(OH)3沉淀需调节pH的范围是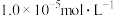 时认为已沉淀完全),调节pH可以选择的最佳物质是
时认为已沉淀完全),调节pH可以选择的最佳物质是A.
 B.
B. C.
C. D.
D.
6 . 近年来对CO2的有效控制及其高效利用的研究正引起全球广泛关注。据中国化工报报道,美国科学家发现了一种新的可将CO2转化为甲醇的高活性催化体系,比目前工业使用的常见催化剂快近90倍。由CO2制备甲醇过程可能涉及反应如下:
反应I:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H1=-49.58kJ/mol
反应II:CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H2
反应III:CO(g)+2H2(g)⇌CH3OH(g) ∆H3=-90.77kJ/mol
回答下列问题:
(1)反应II的∆H2=
(2)在一定条件下2L恒容密闭容器中充入一定量的H2和CO2仅发生反应I,实验测得在不同反应物起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线,如下图所示。

反应物起始投入量:
曲线I:n(H2)=3mol,n(CO2)=1.5mol
曲线II:n(H2)=3mol,n(CO2)=2mol
①据图可知,若要使CO2的平衡转化率大于40%,以下条件中最合适的是
A.n(H2)=3mol,n(CO2)=1.5mol;650K
B.n(H2)=3mol,n(CO2)=1.7mol;550K
C.n(H2)=3mol,n(CO2)=1.9mol;650K
D.n(H2)=3mol,n(CO2)=2.5mol;550K
②在温度为500K的条件下,充入3molH2和1.5molCO2,该反应10min时达到平衡:
a.用H2表示该反应的速率为
b.该温度下,反应I的平衡常数K=
c.在此条件下,系统中CH3OH的浓度随反应时间的变化趋势如图所示,当反应时间达到3min时,迅速将体系温度升至600K,请在图中画出3~10min内容器中CH3OH浓度的变化趋势曲线

(3)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、II、III),测得了不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图所示。据图可知当温度高于260℃后,CO的浓度随着温度的升高而

(1)已知①CH3OH(g)+H2O(l)=CO2(g)+3H2(g) ΔH=+93.0kJ·mol-1
②CH3OH(g)+
 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1③CH3OH(g)=CH3OH(l) ΔH=−38.19kJ/mol
写出表示甲醇CH3OH(l)燃烧热的热化学方程式
(2)甲醇可采用煤的气化、液化制取(CO+2H2
 CH3OH ΔH<0)。在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与
CH3OH ΔH<0)。在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与 的关系如图所示。
的关系如图所示。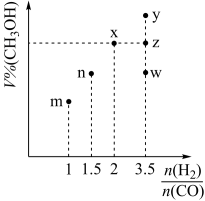
①当起始
 =2,经过5min达到平衡,0~5min内平均反应速率v(H2) = 0.1mol⋅L-1⋅min-1,则该条件CO的平衡转化率为
=2,经过5min达到平衡,0~5min内平均反应速率v(H2) = 0.1mol⋅L-1⋅min-1,则该条件CO的平衡转化率为A.33% B.30% C.25% D.20%
②当
 =3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的
=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的(3)制甲醇的CO和H2可用天然气来制取:
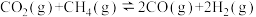 。在某一密闭容器中有浓度均为0.1mol·L−1的CH4和CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则该反应的ΔH
。在某一密闭容器中有浓度均为0.1mol·L−1的CH4和CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则该反应的ΔH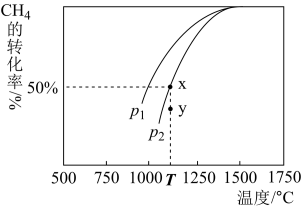
(4)研究表明:CO2和H2在一定条件下也可以合成甲醇,反应方程式为
 [反应Ⅰ]。
[反应Ⅰ]。①一定条件下,往2L恒容密闭容器中充入2.0mol CO2和4.0mol H2,在不同催化剂作用下合成甲醇,相同时间内CO2的转化率随温度变化如下图所示,其中活化能最低的反应所用的催化剂是
②在某催化剂作用下,CO2和H2除发生反应①外,还发生如下反应
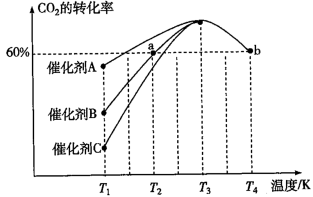
 [反应Ⅱ]。维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得实验数据:
[反应Ⅱ]。维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得实验数据:| T(K) | CO2实际转化率(%) | 甲醇选择性(%) |
| 543 | 12.3 | 42.3 |
| 553 | 15.3 | 39.1 |
表中数据说明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,其原因是
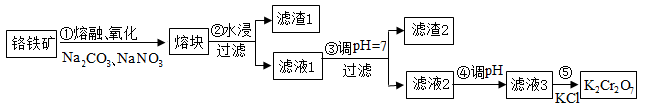
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3
 Na2CrO4+Fe2O3+CO2+NaNO2。上述反应配平后FeO·Cr2O3与NaNO3的化学计量数比(最简整数比)为
Na2CrO4+Fe2O3+CO2+NaNO2。上述反应配平后FeO·Cr2O3与NaNO3的化学计量数比(最简整数比)为(2)滤渣1中含量最多的金属元素是
(3)步骤④调滤液2的pH使之变
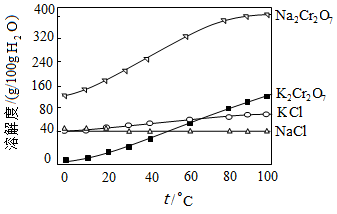
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。写出步骤⑤的化学反应方程式

(1)溶解、过滤、洗涤操作时, 均需要用到的以下仪器为

(2)第①步所得绿色溶液的主要成分为 NaCrO2,已知 Cr(OH)3不溶于水,与Al(OH)3类似,具有两性。写①步发生反应的离子方程式
(3)第②步中加入H2O2浓溶液的目的是
(4)第③步加入醋酸的目的是,防止pH 较高时,加入 Pb(NO3)2溶液会产生
(5)由于铬酸铅的溶解度比重铬酸铅的小的多,在第④ 步中逐滴滴加 Pb(NO3)2溶液后,产PbCrO4黄色沉淀, 此时为了提高铅铬黄的产率,可补加少量NaOH溶液,请用化学平衡移动原理加以解释:
(1)写出COS的电子式
(2)已知 COS(g)+ H2O(g)
 H2S(g)+ CO2(g) ΔH1 = - 34kJ/mol
H2S(g)+ CO2(g) ΔH1 = - 34kJ/molCO(g)+ H2O(g)
 H2(g)+ CO2(g) ΔH2 = - 41kJ/mol
H2(g)+ CO2(g) ΔH2 = - 41kJ/mol写出H2S与CO反应生成 COS 的热化学方程式:
(3)在充有催化剂的恒压密闭容器中进行反应。 设起始充入的 n(CO):n(H2S)=m,相同时间内测得H2S转化率与m和温度(T)的关系如图所示。

①m1
②温度高于 T0时,H2S 转化率减小的可能原因为
A 反应停止了
B 反应的 ΔH 变大
C 反应达到平衡
D 催化剂活性降低



