1 . 硫酰氯(SO2Cl2)在有机合成上可用作磺化剂和氯化剂。无水条件下合成SO2Cl2的反应为:SO2(g)+Cl2(g)⇌SO2Cl2(g) △H=-67kJ/mol。
(1)关于上述反应,下列描述错误的是___________ (填字母)。___________ kJ/mol。
(3)等温下,将等物质的量的反应物加入恒容容器中,起始压强为mkPa,发生上述反应,平衡后压强为nkPa,平衡常数Kp=___________ (kPa)-1(列出表达式)。
(4)硫酰氯对甲苯进行气相催化氯化,某反应机理如图所示(图中 为催化剂表面的催化活性位点)。
为催化剂表面的催化活性位点)。___________ 。
②根据反应机理,当催化剂表面活性位点不足时,分别增大硫酰氯和甲苯的浓度,反应速率的变化情况分别为___________ 。
(5)锂—硫酰氯电池是一种高能锂电池。该电池采用非编织玻璃隔膜,以金属Li为负极,多孔碳为正极(硫酰氯为正极活性物质),溶解有Li[AlCl4]的液态硫酰氯作为电解液。
①电解液中迁移向正极的离子为___________ 。
②负极的电极反应式为___________ 。
③放电时,若正极生成LiCl、Li2S2O4和SO2三种产物,其物质的量分别为a、b和cmol,则c=___________ (用a和b表示)。
(1)关于上述反应,下列描述错误的是

(3)等温下,将等物质的量的反应物加入恒容容器中,起始压强为mkPa,发生上述反应,平衡后压强为nkPa,平衡常数Kp=
(4)硫酰氯对甲苯进行气相催化氯化,某反应机理如图所示(图中
 为催化剂表面的催化活性位点)。
为催化剂表面的催化活性位点)。
②根据反应机理,当催化剂表面活性位点不足时,分别增大硫酰氯和甲苯的浓度,反应速率的变化情况分别为
(5)锂—硫酰氯电池是一种高能锂电池。该电池采用非编织玻璃隔膜,以金属Li为负极,多孔碳为正极(硫酰氯为正极活性物质),溶解有Li[AlCl4]的液态硫酰氯作为电解液。
①电解液中迁移向正极的离子为
②负极的电极反应式为
③放电时,若正极生成LiCl、Li2S2O4和SO2三种产物,其物质的量分别为a、b和cmol,则c=
您最近一年使用:0次
2 . 乙二醇常用作溶剂、防冻液和合成聚酯的原料。工业上有多种方法可以制备乙二醇。
(1)环氧乙烷( )直接水合法;环氧乙烷在一定条件下直接水解得到乙二醇,写出该反应的化学方程式
)直接水合法;环氧乙烷在一定条件下直接水解得到乙二醇,写出该反应的化学方程式__________ 。
生成的乙二醇可以继续与环氧乙烷发生副反应生成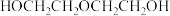 。为避免发生副反应,需要加大量的水,导致产品含水量较高,后续分离流程复杂。
。为避免发生副反应,需要加大量的水,导致产品含水量较高,后续分离流程复杂。
(2)碳酸乙烯酯合成法:
①反应温度为140℃,催化剂用量为2%,反应2h时,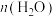 /n(碳酸乙烯酯)与反应后体系中各物质含量的关系如下表所示:
/n(碳酸乙烯酯)与反应后体系中各物质含量的关系如下表所示:
根据表中数据分析,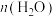 /n(碳酸乙烯酯)=1.5时,乙二醇实际含量较低的可能原因是
/n(碳酸乙烯酯)=1.5时,乙二醇实际含量较低的可能原因是__________ 、__________ 。(写出两条)
②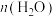 /n(碳酸乙烯酯)=2.0,催化剂用量为2%,反应2h时,碳酸乙烯酯转化率和乙二醇选择性随反应温度变化的趋势如图。反应温度大于140℃时,乙二醇选择性下降的原因是
/n(碳酸乙烯酯)=2.0,催化剂用量为2%,反应2h时,碳酸乙烯酯转化率和乙二醇选择性随反应温度变化的趋势如图。反应温度大于140℃时,乙二醇选择性下降的原因是__________ 。 、
、 、NO、
、NO、 等为原料合成草酸二甲酯,再制得乙二醇。物质转化流程如下图。
等为原料合成草酸二甲酯,再制得乙二醇。物质转化流程如下图。__________ 。
②已知乙二醇的沸点为197.3℃,甲醇的沸点为64.8℃,二者互溶。分离乙二醇和甲醇的实验操作为__________ ,解释二者互溶的原因__________ 。
(4)乙烯催化氧化一步法:有研究者发现, 能够在钛硅分子筛的催化作用下氧化乙烯,一步生成乙二醇。不同温度下,
能够在钛硅分子筛的催化作用下氧化乙烯,一步生成乙二醇。不同温度下, 的转化率与利用率如下表所示。
的转化率与利用率如下表所示。
解释60℃后 利用率变化的原因
利用率变化的原因__________ 。
(1)环氧乙烷(
 )直接水合法;环氧乙烷在一定条件下直接水解得到乙二醇,写出该反应的化学方程式
)直接水合法;环氧乙烷在一定条件下直接水解得到乙二醇,写出该反应的化学方程式生成的乙二醇可以继续与环氧乙烷发生副反应生成
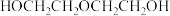 。为避免发生副反应,需要加大量的水,导致产品含水量较高,后续分离流程复杂。
。为避免发生副反应,需要加大量的水,导致产品含水量较高,后续分离流程复杂。(2)碳酸乙烯酯合成法:
第一步: (碳酸乙烯酯)
(碳酸乙烯酯) 
第二步: (碳酸乙烯酯)
(碳酸乙烯酯)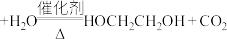
①反应温度为140℃,催化剂用量为2%,反应2h时,
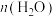 /n(碳酸乙烯酯)与反应后体系中各物质含量的关系如下表所示:
/n(碳酸乙烯酯)与反应后体系中各物质含量的关系如下表所示:
| 1.5 | 2.0 | 2.5 | 3.0 |
乙二醇含量/% | 23.2 | 96.8 | 94.4 | 90.4 |
| 0.8 | 3.2 | 5.6 | 9.6 |
碳酸乙烯酯含量/% | 72.2 | 0 | 0 | 0 |
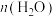 /n(碳酸乙烯酯)=1.5时,乙二醇实际含量较低的可能原因是
/n(碳酸乙烯酯)=1.5时,乙二醇实际含量较低的可能原因是②
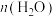 /n(碳酸乙烯酯)=2.0,催化剂用量为2%,反应2h时,碳酸乙烯酯转化率和乙二醇选择性随反应温度变化的趋势如图。反应温度大于140℃时,乙二醇选择性下降的原因是
/n(碳酸乙烯酯)=2.0,催化剂用量为2%,反应2h时,碳酸乙烯酯转化率和乙二醇选择性随反应温度变化的趋势如图。反应温度大于140℃时,乙二醇选择性下降的原因是
 、
、 、NO、
、NO、 等为原料合成草酸二甲酯,再制得乙二醇。物质转化流程如下图。
等为原料合成草酸二甲酯,再制得乙二醇。物质转化流程如下图。
②已知乙二醇的沸点为197.3℃,甲醇的沸点为64.8℃,二者互溶。分离乙二醇和甲醇的实验操作为
(4)乙烯催化氧化一步法:有研究者发现,
 能够在钛硅分子筛的催化作用下氧化乙烯,一步生成乙二醇。不同温度下,
能够在钛硅分子筛的催化作用下氧化乙烯,一步生成乙二醇。不同温度下, 的转化率与利用率如下表所示。
的转化率与利用率如下表所示。温度(℃) | 50 | 60 | 80 |
| 84.9 | 98.4 | 99.8 |
| 67.2 | 67.8 | 55.5 |
 利用率变化的原因
利用率变化的原因
您最近一年使用:0次
名校
解题方法
3 . 以 和
和 为原料制备甲醇是实现
为原料制备甲醇是实现 资源化利用的方式之一,反应原理为:
资源化利用的方式之一,反应原理为:
反应Ⅰ: 。
。
已知: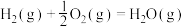
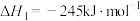
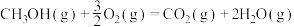
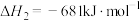
回答下列问题:
(1)计算上述合成甲醇反应的焓变
__________  。合成过程中借助高分子选择性吸水膜可有效提高
。合成过程中借助高分子选择性吸水膜可有效提高 平衡利用率,其原因是
平衡利用率,其原因是__________ 。
(2)关于反应Ⅰ的说法,正确的是__________ 。
A.有利于减少碳排放,实现碳中和
B.降低温度可提高 含量,工业生产时应控制温度越低越好
含量,工业生产时应控制温度越低越好
C.当气体密度保持不变时,反应一定达到平衡状态
(3)在恒压密闭容器中通入 和
和 的混合气体制备甲醇。过程中测得甲醇的时空收率(STY)(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度(T)变化如下表:
的混合气体制备甲醇。过程中测得甲醇的时空收率(STY)(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度(T)变化如下表:__________ ℃。
②随着温度升高,反应速率加快,甲醇的时空收率增大。继续升高温度,甲醇的时空收率反而降低的原因可能是__________ 。
③220℃时,氢气的平均反应速率为__________ 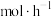 。
。
(4) 催化加氢制甲醇过程中,存在竞争的副反应主要是:
催化加氢制甲醇过程中,存在竞争的副反应主要是:

在恒温、压强为p的反应条件中, 和
和 反应并达到平衡状态,
反应并达到平衡状态, 平衡转化率为20%,甲醇选择性为50%,该温度下主反应的平衡常数
平衡转化率为20%,甲醇选择性为50%,该温度下主反应的平衡常数
__________ 。(列出计算式即可,用平衡分压代替平衡浓度,分压=总压×物质的量分数,甲醇的选择性 %)
%)
 和
和 为原料制备甲醇是实现
为原料制备甲醇是实现 资源化利用的方式之一,反应原理为:
资源化利用的方式之一,反应原理为:反应Ⅰ:
 。
。已知:
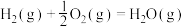
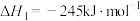
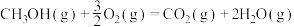
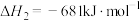
回答下列问题:
(1)计算上述合成甲醇反应的焓变

 。合成过程中借助高分子选择性吸水膜可有效提高
。合成过程中借助高分子选择性吸水膜可有效提高 平衡利用率,其原因是
平衡利用率,其原因是(2)关于反应Ⅰ的说法,正确的是
A.有利于减少碳排放,实现碳中和
B.降低温度可提高
 含量,工业生产时应控制温度越低越好
含量,工业生产时应控制温度越低越好C.当气体密度保持不变时,反应一定达到平衡状态
(3)在恒压密闭容器中通入
 和
和 的混合气体制备甲醇。过程中测得甲醇的时空收率(STY)(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度(T)变化如下表:
的混合气体制备甲醇。过程中测得甲醇的时空收率(STY)(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度(T)变化如下表:
②随着温度升高,反应速率加快,甲醇的时空收率增大。继续升高温度,甲醇的时空收率反而降低的原因可能是
③220℃时,氢气的平均反应速率为
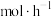 。
。(4)
 催化加氢制甲醇过程中,存在竞争的副反应主要是:
催化加氢制甲醇过程中,存在竞争的副反应主要是:

在恒温、压强为p的反应条件中,
 和
和 反应并达到平衡状态,
反应并达到平衡状态, 平衡转化率为20%,甲醇选择性为50%,该温度下主反应的平衡常数
平衡转化率为20%,甲醇选择性为50%,该温度下主反应的平衡常数
 %)
%)
您最近一年使用:0次
解题方法
4 . 铜基催化剂催化甲醇水蒸气重整制氢是液体燃料制氢的重要方向,主要包含甲醇水蒸气重整反应。甲醇分解反应和水气变换反应,具体反应方程式如下:
Ⅰ.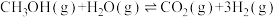
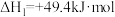
Ⅱ.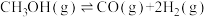

Ⅲ.
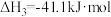
回答下列问题:
(1)则
_______ kJ⋅mol 。
。
(2)有利于提高甲醇平衡转化率的是_______ (填标号)。
A.增加 的用量
的用量
B.恒温恒压条件下通入Ar
C.升高温度
D.选择更高效的催化剂
E.及时分离出
(3)一定条件下,向压强为 的恒压密闭容器中通入
的恒压密闭容器中通入 、
、 物质的量比为1∶1的混合气体,发生上述反应,达到平衡时,容器中
物质的量比为1∶1的混合气体,发生上述反应,达到平衡时,容器中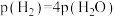 ,
,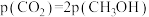 ,此时
,此时 的产率为
的产率为_______ ,反应Ⅱ的以分压表示的化学平衡常数 为
为_____ (用含 的代数式表示)。
的代数式表示)。
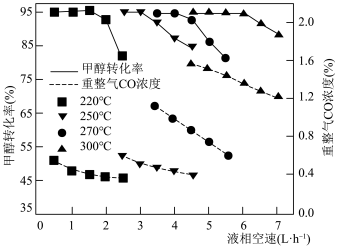
(4)液相空速表示进料速度的快慢。不同温度下,平衡时甲醇转化率和CO浓度随甲醇液相空速的变化如图所示。随温度升高,CO浓度变化的原因是_______ ,制氢产物可以用于车载燃料电池,CO含量太高会对电池产生巨大危害。甲醇水蒸气重整制氢的适宜条件是_______ ℃,_______ L·h 。
。 制乙烯的原理如图所示。因电解前后电解液浓度几乎不变,故可实现
制乙烯的原理如图所示。因电解前后电解液浓度几乎不变,故可实现 的连续转化。
的连续转化。_______ 。
Ⅰ.
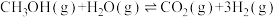
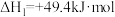
Ⅱ.
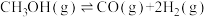

Ⅲ.

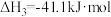
回答下列问题:
(1)则

 。
。(2)有利于提高甲醇平衡转化率的是
A.增加
 的用量
的用量B.恒温恒压条件下通入Ar
C.升高温度
D.选择更高效的催化剂
E.及时分离出

(3)一定条件下,向压强为
 的恒压密闭容器中通入
的恒压密闭容器中通入 、
、 物质的量比为1∶1的混合气体,发生上述反应,达到平衡时,容器中
物质的量比为1∶1的混合气体,发生上述反应,达到平衡时,容器中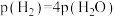 ,
,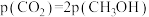 ,此时
,此时 的产率为
的产率为 为
为 的代数式表示)。
的代数式表示)。(4)液相空速表示进料速度的快慢。不同温度下,平衡时甲醇转化率和CO浓度随甲醇液相空速的变化如图所示。随温度升高,CO浓度变化的原因是
 。
。
 制乙烯的原理如图所示。因电解前后电解液浓度几乎不变,故可实现
制乙烯的原理如图所示。因电解前后电解液浓度几乎不变,故可实现 的连续转化。
的连续转化。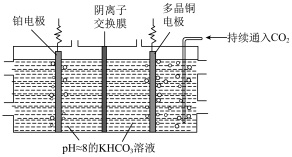
您最近一年使用:0次
名校
解题方法
5 . 工业上以软锰矿(主要成分为MnO2,还含有少量Fe2O3)和辉钼矿(主要成分为MoS2,还含有少量Si、Ni的氧化物)为原料,制备四钼酸铵晶体[(NH4)2Mo4O13 2H2O]和硫酸锰晶体的工艺流程如下:
2H2O]和硫酸锰晶体的工艺流程如下:  分别为19.4和12.6;
分别为19.4和12.6; 。
。
回答下列问题:
(1)为了提高焙烧效率,可以采取的措施有___________ (写一条即可);“高温焙烧”时MnO2、MoS2转化为MnMoO4、MnSO4,写出该反应的化学方程式___________ 。
(2)“除铁”过程中加入碳酸钠调节溶液的pH至2,生成难溶于水的黄钠铁矾[NaFe3(SO4)2(OH)6],写出该反应的离子方程式___________ 。
(3)“除铁”后的溶液中c(Mn2+)=0.5 mol L-1,当溶液中可溶组分浓度c≤10-5mol
L-1,当溶液中可溶组分浓度c≤10-5mol L-1时,可认为已除尽,则“除镍”应控制溶液pH的范围是
L-1时,可认为已除尽,则“除镍”应控制溶液pH的范围是___________ [已知pc(S2-)=-lgc(S2-),该溶液中pc(S2-)和pH的关系为pc(S2-)=15.1-pH;忽略溶液体积变化]。
(4)硫酸锰在不同温度下的溶解度和该温度范围内析出晶体的组成如下图所示。从过滤所得的滤液中获得较高纯度MnSO4 H2O的操作是:控制温度在80~90 ℃之间蒸发结晶,
H2O的操作是:控制温度在80~90 ℃之间蒸发结晶,___________ ,使固体MnSO4 H2O与溶液分离,
H2O与溶液分离,___________ ,真空干燥。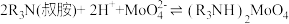 ,则“反萃取”中的试剂X最适宜选用
,则“反萃取”中的试剂X最适宜选用___________ (填标号)。
a.稀硫酸 b.(NH4)2SO4溶液 c.NaOH溶液 d.氨水
从“母液”中回收的副产品主要是___________ (填名称)。
 2H2O]和硫酸锰晶体的工艺流程如下:
2H2O]和硫酸锰晶体的工艺流程如下: 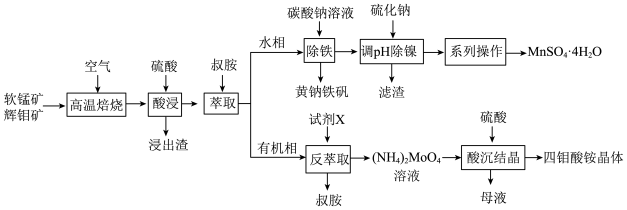
 分别为19.4和12.6;
分别为19.4和12.6; 。
。回答下列问题:
(1)为了提高焙烧效率,可以采取的措施有
(2)“除铁”过程中加入碳酸钠调节溶液的pH至2,生成难溶于水的黄钠铁矾[NaFe3(SO4)2(OH)6],写出该反应的离子方程式
(3)“除铁”后的溶液中c(Mn2+)=0.5 mol
 L-1,当溶液中可溶组分浓度c≤10-5mol
L-1,当溶液中可溶组分浓度c≤10-5mol L-1时,可认为已除尽,则“除镍”应控制溶液pH的范围是
L-1时,可认为已除尽,则“除镍”应控制溶液pH的范围是(4)硫酸锰在不同温度下的溶解度和该温度范围内析出晶体的组成如下图所示。从过滤所得的滤液中获得较高纯度MnSO4
 H2O的操作是:控制温度在80~90 ℃之间蒸发结晶,
H2O的操作是:控制温度在80~90 ℃之间蒸发结晶, H2O与溶液分离,
H2O与溶液分离,
 ,则“反萃取”中的试剂X最适宜选用
,则“反萃取”中的试剂X最适宜选用a.稀硫酸 b.(NH4)2SO4溶液 c.NaOH溶液 d.氨水
从“母液”中回收的副产品主要是
您最近一年使用:0次
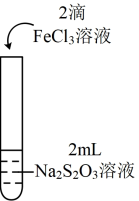
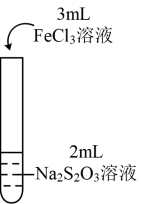
6 . 为探究 能否氧化
能否氧化 ,某兴趣小组用0.1
,某兴趣小组用0.1 的
的 溶液(pH≈7)和0.1
溶液(pH≈7)和0.1 的
的 溶液(pH≈1)进行如下操作并记录现象。
溶液(pH≈1)进行如下操作并记录现象。
已知:
① (紫色)
(紫色)
② 遇
遇 无明显现象
无明显现象
③ 能显著减慢
能显著减慢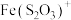 的紫色褪去
的紫色褪去
④在水溶液中 能自发的发生反应
能自发的发生反应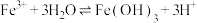
(1)分析实验Ⅰ:若向紫色溶液中加入酸,会使体系Ⅰ中___________ (填离子符号)浓度增大,导致 平衡
平衡___________ (填“正向”或“逆向”)移动;出现淡黄色浑浊是因为 与
与 发生了反应,该反应的离子方程式为
发生了反应,该反应的离子方程式为___________ 。
(2)分析实验Ⅱ:溶液紫色褪去,是因为 被
被___________ (填“氧化”或“还原”)生成 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(3)实验Ⅰ中出现淡黄色浑浊,而实验Ⅱ中未出现淡黄色浑浊的原因是___________ 。
 能否氧化
能否氧化 ,某兴趣小组用0.1
,某兴趣小组用0.1 的
的 溶液(pH≈7)和0.1
溶液(pH≈7)和0.1 的
的 溶液(pH≈1)进行如下操作并记录现象。
溶液(pH≈1)进行如下操作并记录现象。已知:
①
 (紫色)
(紫色)②
 遇
遇 无明显现象
无明显现象③
 能显著减慢
能显著减慢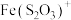 的紫色褪去
的紫色褪去④在水溶液中
 能自发的发生反应
能自发的发生反应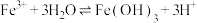
| 实验编号 | Ⅰ | Ⅱ |
| 实验操作 |
|
|
| 实验现象 | 溶液呈紫色,静置后紫色迅速褪去,久置后出现淡黄色浑浊 | 溶液呈紫色,静置后紫色较快褪去,久置后未出现淡黄色浑浊 |
(1)分析实验Ⅰ:若向紫色溶液中加入酸,会使体系Ⅰ中
 平衡
平衡 与
与 发生了反应,该反应的离子方程式为
发生了反应,该反应的离子方程式为(2)分析实验Ⅱ:溶液紫色褪去,是因为
 被
被 ,该反应的离子方程式为
,该反应的离子方程式为(3)实验Ⅰ中出现淡黄色浑浊,而实验Ⅱ中未出现淡黄色浑浊的原因是
您最近一年使用:0次
名校
解题方法
7 . 工业上利用锌焙砂(主要成分为 ,含有少量
,含有少量 、
、 、
、 等)生产高纯
等)生产高纯 的流程示意图如下。
的流程示意图如下。 溶液和氨水“浸出”锌焙砂。
溶液和氨水“浸出”锌焙砂。
①“浸出”前,锌焙砂预先粉碎的目的是_____ 。
②通过“浸出”步骤,锌焙砂中的 转化为
转化为 ,该反应的离子方程式为
,该反应的离子方程式为_____ 。
(2)“浸出”时 转化为
转化为 。“除砷”步骤①中用
。“除砷”步骤①中用 作氧化剂。
作氧化剂。
i.指出 中
中 与
与 的化合价:
的化合价:_____ 。
ii.步骤①的离子方程式为_____ 。
(3)“除重金属”时加入 溶液。滤渣Ⅱ中含有的主要物质是
溶液。滤渣Ⅱ中含有的主要物质是_____ 和 。
。
(4)“蒸氨”时会出现白色固体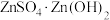 ,运用平衡移动原理解释原因:
,运用平衡移动原理解释原因:_____ 。
(5)“沉锌”步骤①中加入足量 溶液将白色固体转化为
溶液将白色固体转化为 的离子方程式为
的离子方程式为_____ 。
(6)“煅烧”步骤中,不同温度下, 分解的失重曲线和产品
分解的失重曲线和产品 的比表面积变化情况如图甲、图乙所示。
的比表面积变化情况如图甲、图乙所示。
已知:i.固体失重质量分数=
ii.比表面积指单位质量固体所具有的总面积;比表面积越大,产品 的活性越高。
的活性越高。 ,300min后固体失重质量分数为33.3%,则
,300min后固体失重质量分数为33.3%,则 的分解率为
的分解率为_____ %(保留到小数点后一位)。
②根据图1和图2,获得高产率( 分解率
分解率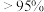 )、高活性(
)、高活性( 比表面积
比表面积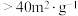 )产品
)产品 的最佳条件是
的最佳条件是_____ (填字母序号)。
a.恒温280℃,60~120min
b.恒温300℃,240~300min
c.恒温350℃,240~300min
d.恒温550℃,60~120min
(7)该流程中可循环利用的物质有_____ 。
 ,含有少量
,含有少量 、
、 、
、 等)生产高纯
等)生产高纯 的流程示意图如下。
的流程示意图如下。
已知: 结构如图所示
结构如图所示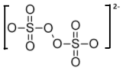
 溶液和氨水“浸出”锌焙砂。
溶液和氨水“浸出”锌焙砂。①“浸出”前,锌焙砂预先粉碎的目的是
②通过“浸出”步骤,锌焙砂中的
 转化为
转化为 ,该反应的离子方程式为
,该反应的离子方程式为(2)“浸出”时
 转化为
转化为 。“除砷”步骤①中用
。“除砷”步骤①中用 作氧化剂。
作氧化剂。i.指出
 中
中 与
与 的化合价:
的化合价:ii.步骤①的离子方程式为
(3)“除重金属”时加入
 溶液。滤渣Ⅱ中含有的主要物质是
溶液。滤渣Ⅱ中含有的主要物质是 。
。(4)“蒸氨”时会出现白色固体
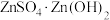 ,运用平衡移动原理解释原因:
,运用平衡移动原理解释原因:(5)“沉锌”步骤①中加入足量
 溶液将白色固体转化为
溶液将白色固体转化为 的离子方程式为
的离子方程式为(6)“煅烧”步骤中,不同温度下,
 分解的失重曲线和产品
分解的失重曲线和产品 的比表面积变化情况如图甲、图乙所示。
的比表面积变化情况如图甲、图乙所示。已知:i.固体失重质量分数=

ii.比表面积指单位质量固体所具有的总面积;比表面积越大,产品
 的活性越高。
的活性越高。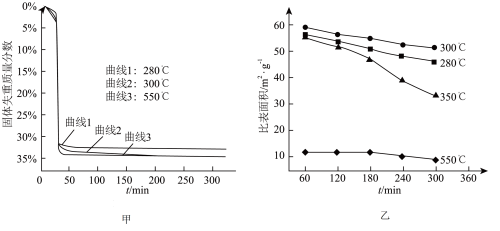
 ,300min后固体失重质量分数为33.3%,则
,300min后固体失重质量分数为33.3%,则 的分解率为
的分解率为②根据图1和图2,获得高产率(
 分解率
分解率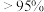 )、高活性(
)、高活性( 比表面积
比表面积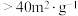 )产品
)产品 的最佳条件是
的最佳条件是a.恒温280℃,60~120min
b.恒温300℃,240~300min
c.恒温350℃,240~300min
d.恒温550℃,60~120min
(7)该流程中可循环利用的物质有
您最近一年使用:0次
8 . 异丁烯是一种重要的化工原料,主要用于制备甲基叔丁基醚、丁基橡胶、甲基丙烯腈等。将异丁烷脱氢制备异丁烯,可提高异丁烷的附加值,具有良好的经济与社会效益。回答下列问题。
(1)利用下列燃烧热数据,计算异丁烷直接脱氢生成异丁烯反应的∆H:
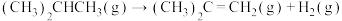 ∆H=
∆H=____________ kJ·mol-1。
(2)在恒温853K、恒压100kPa条件下,初始反应气体组成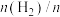 (异丁烷)或
(异丁烷)或 (异丁烷)与平衡时异丁烷的物质的量分数x的关系如下图所示。
(异丁烷)与平衡时异丁烷的物质的量分数x的关系如下图所示。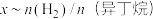 为曲线
为曲线_________ (填“M”或“N”),催化剂易被副反应产生的加聚产物__________ (填写结构简式)影响而失活。
(3)有人提出在恒温恒压条件下加入适量空气,采用异丁烷氧化脱氢的方法制备异丁烯。比较异丁烷直接脱氢制备异丁烯,从平衡产率角度分析该方法的优点是_____________ ,若生产过程中加入的空气过多,产生的主要问题是_____________ 。
(4)有人提出加入适量CO2,采用MgFe2O4催化CO2氧化异丁烷脱氢的方法制备异丁烯。催化过程中,反应物异丁烷、CO2先各自被催化剂上的不同位点吸附。催化剂中电负性较大的金属_____________ (填元素符号)是酸性位点;而电负性较小的金属是碱性位点,吸附________________ (填“异丁烷”或“CO2”)。
(1)利用下列燃烧热数据,计算异丁烷直接脱氢生成异丁烯反应的∆H:
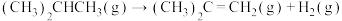 ∆H=
∆H=| 物质 | 异丁烷(g) | 异丁烯(g) | 氢气(g) |
| 燃烧热/(kJ·mol-1) | 2868 | 2700 | 286 |
(2)在恒温853K、恒压100kPa条件下,初始反应气体组成
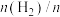 (异丁烷)或
(异丁烷)或 (异丁烷)与平衡时异丁烷的物质的量分数x的关系如下图所示。
(异丁烷)与平衡时异丁烷的物质的量分数x的关系如下图所示。
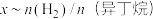 为曲线
为曲线(3)有人提出在恒温恒压条件下加入适量空气,采用异丁烷氧化脱氢的方法制备异丁烯。比较异丁烷直接脱氢制备异丁烯,从平衡产率角度分析该方法的优点是
(4)有人提出加入适量CO2,采用MgFe2O4催化CO2氧化异丁烷脱氢的方法制备异丁烯。催化过程中,反应物异丁烷、CO2先各自被催化剂上的不同位点吸附。催化剂中电负性较大的金属
您最近一年使用:0次
2024-03-22更新
|
112次组卷
|
2卷引用:江苏省南京市金陵中学2022-2023学年高二下学期期中考试 化学试卷
解题方法
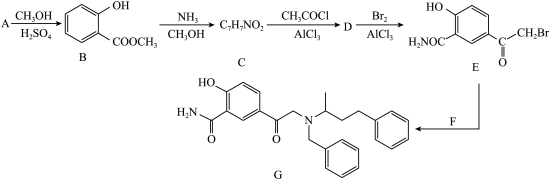
9 . 药物Labetalol适用于治疗轻度至重度高血压和心绞痛,化合物G是合成它的前体,其合成路线如图:
已知:苯胺( )与甲基吡啶(
)与甲基吡啶(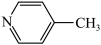 )互为同分异构体,吡啶(
)互为同分异构体,吡啶(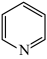 )是类似于苯的芳香化合物。回答下列问题:
)是类似于苯的芳香化合物。回答下列问题:
(1)A的化学名称为_______ 。
(2)在A→B的转化中,加入过量CH3OH的作用除作溶剂外还有_______ 。
(3)B中所含官能团的名称为_______ 。
(4)C→D的反应方程式为_______ 。
(5)由B生成C的反应类型为_______ 。
(6)F的结构简式为_______ 。
(7)C有多种同分异构体,其中满足以下条件的结构简式为______ 、______ 。
①含有六元芳香环
②能与NaHCO3溶液反应
③核磁共振氢谱的峰面积之比为2∶2∶2∶1

已知:苯胺(
 )与甲基吡啶(
)与甲基吡啶( )互为同分异构体,吡啶(
)互为同分异构体,吡啶( )是类似于苯的芳香化合物。回答下列问题:
)是类似于苯的芳香化合物。回答下列问题:(1)A的化学名称为
(2)在A→B的转化中,加入过量CH3OH的作用除作溶剂外还有
(3)B中所含官能团的名称为
(4)C→D的反应方程式为
(5)由B生成C的反应类型为
(6)F的结构简式为
(7)C有多种同分异构体,其中满足以下条件的结构简式为
①含有六元芳香环
②能与NaHCO3溶液反应
③核磁共振氢谱的峰面积之比为2∶2∶2∶1
您最近一年使用:0次
名校
解题方法
10 . 探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.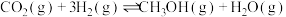
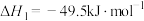
Ⅱ.

Ⅲ.

回答下列问题:
(1)
___________ kJ⋅mol-1。
(2)一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平衡时,容器中 为a mol,CO为b mol,此时
为a mol,CO为b mol,此时 的浓度为
的浓度为___________ mol/L(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为___________ 。
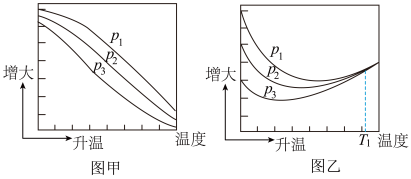
(3)不同压强下,按照 投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
已知: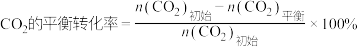
CH3OH的平衡产率=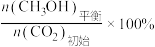
其中纵坐标表示CO2平衡转化率的是图___________ (填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为___________ ;图乙中T1温度时,三条曲线几乎交于一点的原因是___________ 。
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为___________(填标号)。
(5)甲醇燃料电池中甲醇在___________ (填“正”或“负”)极发生反应,酸性条件下其正极的电极反应式为___________ 。
(6)在允许O2-自由迁移的固体电解质燃料电池中,CnH2n+2放电的电极反应式为___________ 。
Ⅰ.
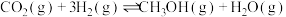
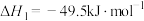
Ⅱ.


Ⅲ.


回答下列问题:
(1)

(2)一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平衡时,容器中
 为a mol,CO为b mol,此时
为a mol,CO为b mol,此时 的浓度为
的浓度为(3)不同压强下,按照
 投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
已知:
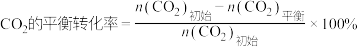
CH3OH的平衡产率=
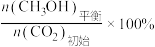
其中纵坐标表示CO2平衡转化率的是图
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为___________(填标号)。
| A.低温、高压 | B.高温、低压 | C.低温、低压 | D.高温、高压 |
(5)甲醇燃料电池中甲醇在
(6)在允许O2-自由迁移的固体电解质燃料电池中,CnH2n+2放电的电极反应式为
您最近一年使用:0次
2024-03-16更新
|
237次组卷
|
2卷引用:山西省晋城市第一中学校2023-2024学年高三下学期开学考试理综化学试题

 含量/%
含量/%