名校
1 . 反应Fe3+ +SCN− Fe(SCN)2+(血红色),一定温度下达到平衡时,c(Fe3+)=0.04 mol·L−1,c(SCN−) = 0.1 mol·L−1,c[Fe(SCN)2+] = 0.68 mol·L−1.下列说法
Fe(SCN)2+(血红色),一定温度下达到平衡时,c(Fe3+)=0.04 mol·L−1,c(SCN−) = 0.1 mol·L−1,c[Fe(SCN)2+] = 0.68 mol·L−1.下列说法不正确 的是
 Fe(SCN)2+(血红色),一定温度下达到平衡时,c(Fe3+)=0.04 mol·L−1,c(SCN−) = 0.1 mol·L−1,c[Fe(SCN)2+] = 0.68 mol·L−1.下列说法
Fe(SCN)2+(血红色),一定温度下达到平衡时,c(Fe3+)=0.04 mol·L−1,c(SCN−) = 0.1 mol·L−1,c[Fe(SCN)2+] = 0.68 mol·L−1.下列说法| A.加入固体KSCN后,平衡正向移动 |
| B.加水稀释,溶液颜色变浅,据此判断平衡逆向移动 |
| C.该温度下,该反应的平衡常数K=170 |
| D.加入铁粉,平衡逆向移动 |
您最近一年使用:0次
2021-04-09更新
|
277次组卷
|
3卷引用:浙江省丽水、湖州、衢州三地市2021届高三4月教学质量检测化学试题
名校
解题方法
2 . 实验小组探究酸对Fe3++3SCN-⇌Fe(SCN)3平衡的影响。将0.005mol·L-1FeCl3溶液(接近无色)和0.01mol·L-1KSCN溶液等体积混合,得到红色溶液。
(1)FeCl3溶液呈酸性的原因是___ (用离子方程式表示)。
(2)甲同学认为加入酸后,会使Fe3++3SCN-⇌Fe(SCN)3体系中___ 增大,导致该平衡正向移动,溶液颜色加深。
【设计并实施实验】
取两等份红色溶液,进行如下操作并记录现象。
[查阅资料]
Fe3+和Cl-、SO 均能发生络合反应:Fe3++4Cl-⇌ [FeCl4]-(黄色);Fe3++2SO
均能发生络合反应:Fe3++4Cl-⇌ [FeCl4]-(黄色);Fe3++2SO ⇌[Fe(SO4)2]-(无色)。
⇌[Fe(SO4)2]-(无色)。
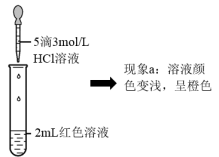
实验I.探究现象a中溶液颜色变化的原因
(3)实验①的目的是___ 。
(4)根据实验①和实验②的结果,从平衡移动角度解释现象a:___ 。
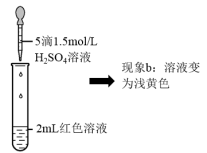
实验II.探究现象b中溶液呈浅黄色的原因
(5)结合实验③可推测现象b中使溶液呈浅黄色的微粒可能有两种,分别是___ 。
(6)乙同学进一步补充了实验④,确证了现象b中使溶液呈浅黄色的微粒只是(5)中的一种,请将实验④的操作及现象补充完整:___ 、___ 。
(1)FeCl3溶液呈酸性的原因是
(2)甲同学认为加入酸后,会使Fe3++3SCN-⇌Fe(SCN)3体系中
【设计并实施实验】
取两等份红色溶液,进行如下操作并记录现象。
 |  |
Fe3+和Cl-、SO
 均能发生络合反应:Fe3++4Cl-⇌ [FeCl4]-(黄色);Fe3++2SO
均能发生络合反应:Fe3++4Cl-⇌ [FeCl4]-(黄色);Fe3++2SO ⇌[Fe(SO4)2]-(无色)。
⇌[Fe(SO4)2]-(无色)。实验I.探究现象a中溶液颜色变化的原因
| 编号 | 操作 | 现象 |
| ① | 向2mL红色溶液中滴加5滴水 | 溶液颜色无明显变化 |
| ② | 向2mL红色溶液中滴加5滴3mol·L-1KCl溶液 | 溶液颜色变浅,呈橙色 |
(4)根据实验①和实验②的结果,从平衡移动角度解释现象a:
实验II.探究现象b中溶液呈浅黄色的原因
| 编号 | 操作 | 现象 |
| ③ | 取1mL0.0025mol·L-1Fe2(SO4)3溶液(无色)。加入1mL0.01mol·L-1KSCN溶液,再加入5滴1.5mol·L-1H2SO4溶液 | 溶液先变红,加硫酸后变为浅黄色 |
| ④ | 取1mL0.005mol·L-1FeCl3溶液, |
(6)乙同学进一步补充了实验④,确证了现象b中使溶液呈浅黄色的微粒只是(5)中的一种,请将实验④的操作及现象补充完整:
您最近一年使用:0次
2021-04-01更新
|
558次组卷
|
9卷引用:考点32 化学反应条件的控制-备战2022年高考化学一轮复习考点帮(浙江专用)
(已下线)考点32 化学反应条件的控制-备战2022年高考化学一轮复习考点帮(浙江专用)北京市海淀区2021届高三上学期期末考试化学试题(已下线)大题04 无机定量与探究实验-【考前抓大题】备战2021年高考化学(全国通用)河北省石家庄市第二中学2021届高三3月学情考试化学试题北京市顺义牛栏山第一中学2022届高三下学期保温练习化学试题北京市清华大学附属中学2022-2023学年高三上学期12月统练六化学试题(已下线)北京市海淀区2022届高三一模(实验探究题)江苏省宜兴市张渚高级中学2020-2021学年高二下学期期中考试化学试题北京市第十五中学2021-2022学年高二上学期期中考试化学试题
3 . 某温度下,1 mol乙醇和氢溴酸的混合溶液共20 mL,发生反应 ,30 min时测得生成溴乙烷的产量为0.3 mol(反应中体积变化忽略不计)。下列说法正确的是
,30 min时测得生成溴乙烷的产量为0.3 mol(反应中体积变化忽略不计)。下列说法正确的是
 ,30 min时测得生成溴乙烷的产量为0.3 mol(反应中体积变化忽略不计)。下列说法正确的是
,30 min时测得生成溴乙烷的产量为0.3 mol(反应中体积变化忽略不计)。下列说法正确的是| A.加入适量水,有利于生成溴乙烷 |
| B.若将反应物的量加倍,则两种反应物平衡转化率之比变大 |
C.0~10 min的平均反应速率: |
D.若将氢溴酸改用 与浓硫酸,溴乙烷的产量可能会上升 与浓硫酸,溴乙烷的产量可能会上升 |
您最近一年使用:0次
解题方法
4 . 下列有关实验的说法正确的是
| A.在4mL0.1mol•L-1的K2Cr2O7溶液中滴加数滴1mol•L-1的NaOH溶液,溶液颜色从橙色变成黄色 |
| B.向氯化铝溶液中滴加饱和NaF溶液再滴加氨水,振荡后,能观察到白色沉淀 |
| C.纸层析以滤纸为惰性支持物滤纸纤维上的羟基具有亲水性,它所吸附的水作为流动相 |
| D.抽滤过程中洗涤沉淀时,应关小水龙头,加洗涤剂浸没沉淀,用玻璃棒在过滤器上搅拌以使沉淀跟洗涤剂充分接触,以便洗得更干净 |
您最近一年使用:0次
解题方法
5 . 大气中CO2含量的增多除了导致地球表面温度升高外,还会影响海洋生态环境。某研究小组在实验室测得不同温度下(T1,T2)海水中CO 浓度与模拟空气中CO2浓度的关系曲线。已知:海水中存在以下平衡:CO2(aq)+CO
浓度与模拟空气中CO2浓度的关系曲线。已知:海水中存在以下平衡:CO2(aq)+CO (aq)+H2O(aq)
(aq)+H2O(aq)  2HCO
2HCO (aq),下列说法不正确的是
(aq),下列说法不正确的是
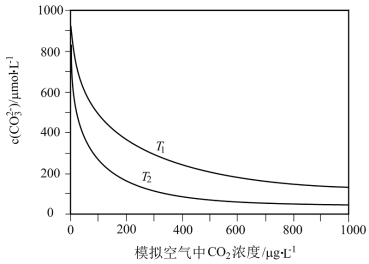
 浓度与模拟空气中CO2浓度的关系曲线。已知:海水中存在以下平衡:CO2(aq)+CO
浓度与模拟空气中CO2浓度的关系曲线。已知:海水中存在以下平衡:CO2(aq)+CO (aq)+H2O(aq)
(aq)+H2O(aq)  2HCO
2HCO (aq),下列说法不正确的是
(aq),下列说法不正确的是
| A.T1>T2 |
B.海水温度一定时,大气中CO2浓度增加,海水中溶解的CO2随之增大,CO 浓度降低 浓度降低 |
C.当大气中CO2浓度确定时,海水温度越高,CO 浓度越低 浓度越低 |
| D.大气中CO2含量增加时,海水中的珊瑚礁将逐渐溶解 |
您最近一年使用:0次
2021-03-13更新
|
407次组卷
|
6卷引用:浙江省绍兴市柯桥区2020届高三上学期1月模拟普通高校招生考试化学试题
浙江省绍兴市柯桥区2020届高三上学期1月模拟普通高校招生考试化学试题(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)浙江省绍兴市柯桥区2021-2022 学年高三下学期选考科目6月适应性考试化学试题(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练安徽省蚌埠四校2021-2022学年高三下学期三模化学试题(已下线)第5讲 难溶电解质的溶解平衡
名校
解题方法
6 . 在催化剂作用下,向刚性容器中按物质的量比1︰1充入甲醇和异丁烯(用R表示),分别在T1和T2两个温度下发生反应生成有机物W:CH3OH(g)+R(g)⇌W(g) ΔH。异丁烯的转化率随时间的变化关系如图所示。下列说法正确的是
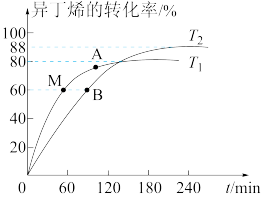

| A.T1>T2,ΔH>0 |
| B.vM正=vB正>vA逆 |
| C.维持T2不变,再向容器中充入1 mol W,新平衡时W的百分含量减小 |
D.T1时,容器内起始总压为p0 kPa,则用分压表示的该反应的平衡常数Kp= kPa-1 kPa-1 |
您最近一年使用:0次
2021-03-07更新
|
1365次组卷
|
8卷引用:考点17 化学反应速率及其影响因素-备战2022年高考化学一轮复习考点帮(浙江专用)
(已下线)考点17 化学反应速率及其影响因素-备战2022年高考化学一轮复习考点帮(浙江专用)重庆市强基联合体2021届高三下学期质量检测化学试题山东省济南市平阴县第一中学2021届高三下学期3月月考化学试题(已下线)考点17 化学反应速率及其影响因素-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)专题10 化学反应速率与平衡-2023年高考化学一轮复习小题多维练(全国通用)河南省鹤壁市高中2020-2021学年高二下学期第三次段考化学试题安徽省马鞍山市第二中学2021-2022学年高二上学期期中考试化学试题重庆市第一中学校2020-2021学年高二下学期期末考试化学试题
7 . NO的处理与减排是烟气污染物控制的重点和难点,相关研究引起了国内外的广泛关注。
(1)理论上可采用加热使NO分解的方法处理: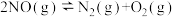 ,反应的部分数据如下表:
,反应的部分数据如下表:
通过计算得出高于7089℃时反应无法自发进行,试判断b____ 0(填“<”、“>”或“=”);反应的平衡常数表达式为____ ;实际反应时发现加热至600℃时NO仍没有明显分解,试解释原因___ 。
(2)科学家发现活性炭表面的有机结构可以被强氧化剂氧化成酚羟基、羧基(均可表示为C—OH,其电离平衡可表示为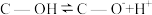 ),这些官能团可以使活性炭表面活性化,有利于NO的吸附。不同氧化剂的预氧化与吸附原理可表示为(未配平):
),这些官能团可以使活性炭表面活性化,有利于NO的吸附。不同氧化剂的预氧化与吸附原理可表示为(未配平):
预氧化: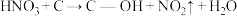
预氧化:
预氧化:
吸附: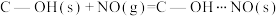
NO吸附实验分别在25℃和55℃下进行,将一定比例的 与NO混合气体在10 MPa恒压下,以相同速率持续通入到等量的、不同预氧化试剂处理的活性炭中(图象中“原始-C”表示未经处理的活性炭),获得两个温度下“NO捕获率-通气时间”的变化图:
与NO混合气体在10 MPa恒压下,以相同速率持续通入到等量的、不同预氧化试剂处理的活性炭中(图象中“原始-C”表示未经处理的活性炭),获得两个温度下“NO捕获率-通气时间”的变化图:
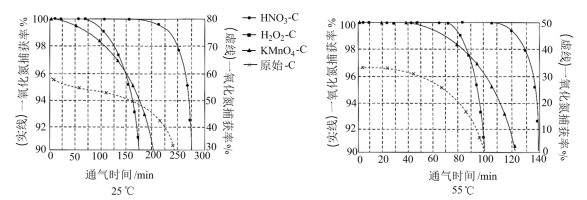
已知:NO捕获率=
请回答:
①下列描述正确的是_______
A.25℃下原始-C在通气约175分钟后吸附效果超过了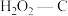
B.若其他条件不变,增大混合气体中 物质的量分数,吸附平衡会逆向移动
物质的量分数,吸附平衡会逆向移动
C.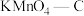 在实验中吸附效果不佳,可能是活性炭表面孔隙被堵塞
在实验中吸附效果不佳,可能是活性炭表面孔隙被堵塞
D.由图象可知升温有利于吸附平衡正向移动,故吸附过程的
②其他条件不变,55℃下增大烟气中水蒸气含量后,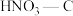 的NO捕获率会迅速降低,通气1小时后为40%,70 min后吸附到达平衡。请在对应图象中用虚线画出通气1小时后至吸附平衡为止NO捕获率的变化曲线
的NO捕获率会迅速降低,通气1小时后为40%,70 min后吸附到达平衡。请在对应图象中用虚线画出通气1小时后至吸附平衡为止NO捕获率的变化曲线____________ 。
③相比其他预氧化试剂处理的活性炭,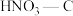 吸附效果更佳,有研究者认为可能是
吸附效果更佳,有研究者认为可能是 引入了
引入了 ,增强了活性炭的表面活性。试利用勒夏特列原理予以解释
,增强了活性炭的表面活性。试利用勒夏特列原理予以解释_______ 。
(1)理论上可采用加热使NO分解的方法处理:
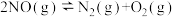 ,反应的部分数据如下表:
,反应的部分数据如下表:项目 |
|
| 正反应活化能 | 逆反应活化能 |
数据/ | a | b | 728 | 910 |
通过计算得出高于7089℃时反应无法自发进行,试判断b
(2)科学家发现活性炭表面的有机结构可以被强氧化剂氧化成酚羟基、羧基(均可表示为C—OH,其电离平衡可表示为
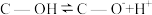 ),这些官能团可以使活性炭表面活性化,有利于NO的吸附。不同氧化剂的预氧化与吸附原理可表示为(未配平):
),这些官能团可以使活性炭表面活性化,有利于NO的吸附。不同氧化剂的预氧化与吸附原理可表示为(未配平):预氧化:
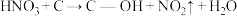
预氧化:

预氧化:

吸附:
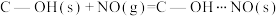
NO吸附实验分别在25℃和55℃下进行,将一定比例的
 与NO混合气体在10 MPa恒压下,以相同速率持续通入到等量的、不同预氧化试剂处理的活性炭中(图象中“原始-C”表示未经处理的活性炭),获得两个温度下“NO捕获率-通气时间”的变化图:
与NO混合气体在10 MPa恒压下,以相同速率持续通入到等量的、不同预氧化试剂处理的活性炭中(图象中“原始-C”表示未经处理的活性炭),获得两个温度下“NO捕获率-通气时间”的变化图:
已知:NO捕获率=

请回答:
①下列描述正确的是
A.25℃下原始-C在通气约175分钟后吸附效果超过了
B.若其他条件不变,增大混合气体中
 物质的量分数,吸附平衡会逆向移动
物质的量分数,吸附平衡会逆向移动C.
 在实验中吸附效果不佳,可能是活性炭表面孔隙被堵塞
在实验中吸附效果不佳,可能是活性炭表面孔隙被堵塞D.由图象可知升温有利于吸附平衡正向移动,故吸附过程的

②其他条件不变,55℃下增大烟气中水蒸气含量后,
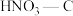 的NO捕获率会迅速降低,通气1小时后为40%,70 min后吸附到达平衡。请在对应图象中用虚线画出通气1小时后至吸附平衡为止NO捕获率的变化曲线
的NO捕获率会迅速降低,通气1小时后为40%,70 min后吸附到达平衡。请在对应图象中用虚线画出通气1小时后至吸附平衡为止NO捕获率的变化曲线③相比其他预氧化试剂处理的活性炭,
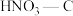 吸附效果更佳,有研究者认为可能是
吸附效果更佳,有研究者认为可能是 引入了
引入了 ,增强了活性炭的表面活性。试利用勒夏特列原理予以解释
,增强了活性炭的表面活性。试利用勒夏特列原理予以解释
您最近一年使用:0次
名校
8 . 人体内的血红蛋白(Hb)可与O2结合形成HbO2,Hb(aq)也可以与CO结合,人体发生CO中毒的原理为:HbO2(aq)+CO(g) HbCO(aq)+O2(g) ΔH<0.下列说法
HbCO(aq)+O2(g) ΔH<0.下列说法不正确 的是
 HbCO(aq)+O2(g) ΔH<0.下列说法
HbCO(aq)+O2(g) ΔH<0.下列说法| A.海拔较高的地区由于气压较低,所以血红蛋白较难与O2结合,容易产生缺氧现象 |
| B.已知CO中毒为熵减过程,则理论上冬天比夏天可能更容易发生CO中毒现象 |
| C.把CO中毒的人转到高压氧仓中有助于缓解症状 |
D.此反应的平衡常数K=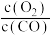 |
您最近一年使用:0次
2021-03-05更新
|
572次组卷
|
8卷引用:浙江省金华十校2021届高三11月选考化学模拟试卷
浙江省金华十校2021届高三11月选考化学模拟试卷(已下线)考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)专题10 化学反应速率与化学平衡-备战2022年高考化学学霸纠错(全国通用)(已下线)专题10 化学反应速率与平衡-2023年高考化学一轮复习小题多维练(全国通用)重庆市第七中学校2021-2022学年高二上学期第一次月考化学试题重庆市石柱中学校2021-2022学年高二上学期第一次月考化学试题甘肃省礼县第一中学2020-2021学年高一上学期期中测试化学试题
9 . (1)用一个离子反应方程式说明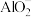 和
和 结合
结合 能力的相对强弱
能力的相对强弱______ 。
(2)冰的密度比水的密度小,能浮在水面上。主要原因是______ 。
(3)用平衡移动原理解释为什么用饱和食盐水除去氯气中的杂质气体
______ 。
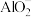 和
和 结合
结合 能力的相对强弱
能力的相对强弱(2)冰的密度比水的密度小,能浮在水面上。主要原因是
(3)用平衡移动原理解释为什么用饱和食盐水除去氯气中的杂质气体

您最近一年使用:0次
解题方法
10 . COCl2 的分解反应为 COCl2(g)⇌ CO(g)+Cl2(g) △H=+108kJ•mol-1。某容器中,反应体系达到平衡后,分别只改变一个条件,各物质浓度的变化状况如下图1所示(第 10min 到第14min的COCl2浓度变化曲线未示出):

下列说法正确的是

下列说法正确的是
| A.在 10~12min 内,以 Cl2 浓度变化表示的该反应平均反应速率为 5×10-3mol•L-1•s-1 |
| B.改变的条件分别是:第 4min 时,升高了温度;第 10min 时,移走了部分 CO;第 14min时,将容器体积压缩了 1.5 倍 |
| C.第13min 时,COCl2 的浓度为 0.03mol•L-1 |
| D.第18min 时,向容器中加入催化剂,各物质的浓度变化状况可能如上图2所示 |
您最近一年使用:0次