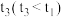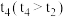名校
1 . 在2A(g)+B(g)  4C(g)+D(s) (ΔH>0)已达化学平衡时,能使正、逆反应速率同时加快,又使平衡向正反应方向移动,应采取的措施
4C(g)+D(s) (ΔH>0)已达化学平衡时,能使正、逆反应速率同时加快,又使平衡向正反应方向移动,应采取的措施
 4C(g)+D(s) (ΔH>0)已达化学平衡时,能使正、逆反应速率同时加快,又使平衡向正反应方向移动,应采取的措施
4C(g)+D(s) (ΔH>0)已达化学平衡时,能使正、逆反应速率同时加快,又使平衡向正反应方向移动,应采取的措施| A.减小C的浓度 | B.增大压强 | C.升高温度 | D.使用催化剂 |
您最近一年使用:0次
名校
2 . 完成下列问题
(1)如图中,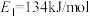 ,
,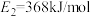 ,根据要求回答问题:
,根据要求回答问题:
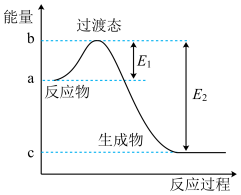
如图是1mol NO2和1molCO反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大, 的变化是
的变化是___________ (填“增大”“减小”或“不变”),请写出NO2和CO反应的热化学方程式:___________ 。
(2)在某温度下,将H2和I2各1mol的气态混合物充入10L的密闭容器中发生反应H2(g)+I2(g) 2HI(g) ΔH<0,达到平衡后,测得c(H2)=0.08mol/L。
2HI(g) ΔH<0,达到平衡后,测得c(H2)=0.08mol/L。
 保持容器容积不变,向其中再加入1molH2,反应速率
保持容器容积不变,向其中再加入1molH2,反应速率___________ (填“增大”、“减小”或“不变”),平衡___________ 移动(填“向正反应方向”、“向逆反应方向”或“不”)。
②保持容器内气体压强不变,向其中加入1molN2(N2不参加反应),反应速率___________ (填“增大”、“减小”或“不变”),平衡___________ 移动(填“向正反应方向”、“向逆反应方向”或“不”)。
③该反应的化学平衡常数K=___________ 。
(1)如图中,
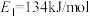 ,
,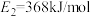 ,根据要求回答问题:
,根据要求回答问题:
如图是1mol NO2和1molCO反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,
 的变化是
的变化是(2)在某温度下,将H2和I2各1mol的气态混合物充入10L的密闭容器中发生反应H2(g)+I2(g)
 2HI(g) ΔH<0,达到平衡后,测得c(H2)=0.08mol/L。
2HI(g) ΔH<0,达到平衡后,测得c(H2)=0.08mol/L。 保持容器容积不变,向其中再加入1molH2,反应速率
保持容器容积不变,向其中再加入1molH2,反应速率②保持容器内气体压强不变,向其中加入1molN2(N2不参加反应),反应速率
③该反应的化学平衡常数K=
您最近一年使用:0次
名校
解题方法
3 . 某兴趣小组以重铬酸钾(K2Cr2O7)溶液为研究对象,结合所学反应原理的知识改变条件使其发生“色彩变幻”。
已知:①K2Cr2O7溶液存在平衡:Cr2O (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+。
(黄色)+2H+。
②Cr3+(绿色)
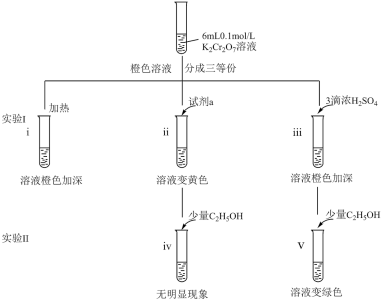
(1)i可证明反应Cr2O +H2O
+H2O 2CrO
2CrO +2H+的正反应是
+2H+的正反应是___ (填“吸热”或“放热”)。
(2)ii是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是______ 。
(3)iii的目的是要验证“增大生成物浓度,该平衡逆向移动”,此实验是否能达到预期目的____ (填“能”或“不能”),理由是_______ 。
(4)根据实验Ⅱ中不同现象,可以得出的结论是_____ 。
已知:①K2Cr2O7溶液存在平衡:Cr2O
 (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+。
(黄色)+2H+。②Cr3+(绿色)

(1)i可证明反应Cr2O
 +H2O
+H2O 2CrO
2CrO +2H+的正反应是
+2H+的正反应是(2)ii是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是
(3)iii的目的是要验证“增大生成物浓度,该平衡逆向移动”,此实验是否能达到预期目的
(4)根据实验Ⅱ中不同现象,可以得出的结论是
您最近一年使用:0次
名校
4 . 重铬酸钾(K2Cr2O7)又名红矾钾,是化学实验室中的一种重要分析试剂,在工业上用途广泛。已知K2Cr2O7溶液中存在平衡:
请回答下列问题:
(1)K2Cr2O7溶液中反应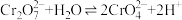 平衡常数的表达式为
平衡常数的表达式为
___________ 。
(2)复分解法制备重铬酸钾:以Na2CrO4溶液为原料,步骤如下:
①先向Na2CrO4溶液中加入酸调节溶液pH,其目的是___________ 。
②再向①的溶液中加入适量KCl,搅拌溶解、蒸发浓缩、冷却结晶,抽滤得到K2Cr2O7粗产品。则相同温度时的溶解度:Na2Cr2O7___________ K2Cr2O7(填“>”“<”或“=”)。
(3)K2Cr2O7溶液中存在的平衡又可分解为以下两步:
(ⅰ)

(ⅱ)

①下列有关K2Cr2O7溶液的说法正确的有_______ 。
A.加入少量硫酸,溶液颜色由橙色向黄色转变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量NaOH溶液,反应(ⅰ)的平衡逆向移动
D.加入少量K2Cr2O7固体,平衡时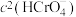 与
与 的比值保持不变
的比值保持不变
②在0.10 mol⋅L-1 K2Cr2O7溶液中设 、
、 、
、 的平衡浓度分别为x、y、z mol·L-1,则x、y、z之间的关系式为
的平衡浓度分别为x、y、z mol·L-1,则x、y、z之间的关系式为_______ =0.10。
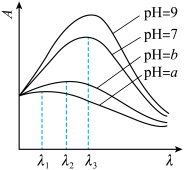
③已知在稀溶液中,一种物质对光的吸收程度(A)与其所吸收光的波长(λ)有关;在一定波长范围内,最大A对应的波长(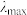 )取决于物质的结构特征;浓度越高,A越大。混合溶液在某一波长的A是各组分吸收程度之和。为研究对反应(ⅰ)和(ⅱ)平衡的影响,配制浓度相同、pH不同的K2Cr2O7稀溶液,测得其A随λ的变化曲线如右上图所示,波长λ1、λ2和λ3中,与
)取决于物质的结构特征;浓度越高,A越大。混合溶液在某一波长的A是各组分吸收程度之和。为研究对反应(ⅰ)和(ⅱ)平衡的影响,配制浓度相同、pH不同的K2Cr2O7稀溶液,测得其A随λ的变化曲线如右上图所示,波长λ1、λ2和λ3中,与 的
的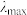 最接近的是
最接近的是_______ ;溶液pH从a变到b的过程中, 的值
的值_______ (填“增大”“减小”或“不变”)。

请回答下列问题:
(1)K2Cr2O7溶液中反应
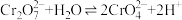 平衡常数的表达式为
平衡常数的表达式为
(2)复分解法制备重铬酸钾:以Na2CrO4溶液为原料,步骤如下:
①先向Na2CrO4溶液中加入酸调节溶液pH,其目的是
②再向①的溶液中加入适量KCl,搅拌溶解、蒸发浓缩、冷却结晶,抽滤得到K2Cr2O7粗产品。则相同温度时的溶解度:Na2Cr2O7
(3)K2Cr2O7溶液中存在的平衡又可分解为以下两步:
(ⅰ)


(ⅱ)



①下列有关K2Cr2O7溶液的说法正确的有
A.加入少量硫酸,溶液颜色由橙色向黄色转变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量NaOH溶液,反应(ⅰ)的平衡逆向移动
D.加入少量K2Cr2O7固体,平衡时
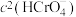 与
与 的比值保持不变
的比值保持不变②在0.10 mol⋅L-1 K2Cr2O7溶液中设
 、
、 、
、 的平衡浓度分别为x、y、z mol·L-1,则x、y、z之间的关系式为
的平衡浓度分别为x、y、z mol·L-1,则x、y、z之间的关系式为③已知在稀溶液中,一种物质对光的吸收程度(A)与其所吸收光的波长(λ)有关;在一定波长范围内,最大A对应的波长(
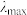 )取决于物质的结构特征;浓度越高,A越大。混合溶液在某一波长的A是各组分吸收程度之和。为研究对反应(ⅰ)和(ⅱ)平衡的影响,配制浓度相同、pH不同的K2Cr2O7稀溶液,测得其A随λ的变化曲线如右上图所示,波长λ1、λ2和λ3中,与
)取决于物质的结构特征;浓度越高,A越大。混合溶液在某一波长的A是各组分吸收程度之和。为研究对反应(ⅰ)和(ⅱ)平衡的影响,配制浓度相同、pH不同的K2Cr2O7稀溶液,测得其A随λ的变化曲线如右上图所示,波长λ1、λ2和λ3中,与 的
的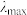 最接近的是
最接近的是 的值
的值
您最近一年使用:0次
名校
5 . Ⅰ.在硫酸工业中,通过下列反应使SO2转化为SO3:其中一步反应为2SO2(g)+O2(g)  2SO3(g) ΔH= −196.6kJ·mol-1。
2SO3(g) ΔH= −196.6kJ·mol-1。
(1)利用下表实验数据回答问题:
①应选择的温度是___________ 。
②应采用的压强是___________ ,理由是___________ 。
③实际生产中原料气含SO2为7%(体积分数)、O2为11%。O2相对过量的理由是___________ 。
Ⅱ.在一定温度下,将4.0 mol SO2与2.0 mol O2的混合气体充入容积为2 L的密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g),经过2 min达到平衡状态,SO2的平衡转化率90.0%。
2SO3(g),经过2 min达到平衡状态,SO2的平衡转化率90.0%。
(2)①该温度下此反应的化学平衡常数为K=___________ 。
②在相同温度下,某容器内c(SO2) = c(O2) = c(SO3) = 1.0 mol·L-1,则此时反应速率 v(正)___________ v(逆) (填“>”、“<”或“=”)。
Ⅲ.下图表示在密闭容器中反应:2SO2+O2 2SO3 ΔH<0 达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况。
2SO3 ΔH<0 达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况。
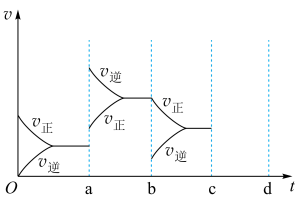
(3)若在c时刻压缩体积增大压强,请在图上将反应速率和化学平衡变化情况画在c~d处(每一时刻只改变浓度、温度、压强、催化剂条件之一)________ 。
 2SO3(g) ΔH= −196.6kJ·mol-1。
2SO3(g) ΔH= −196.6kJ·mol-1。(1)利用下表实验数据回答问题:
| 温度 | 平衡时SO2的转化率(%) | ||||
| 1×105Pa | 5×105Pa | 1×106Pa | 5×106Pa | 1×107Pa | |
| 450℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
②应采用的压强是
③实际生产中原料气含SO2为7%(体积分数)、O2为11%。O2相对过量的理由是
Ⅱ.在一定温度下,将4.0 mol SO2与2.0 mol O2的混合气体充入容积为2 L的密闭容器中发生反应:2SO2(g)+O2(g)
 2SO3(g),经过2 min达到平衡状态,SO2的平衡转化率90.0%。
2SO3(g),经过2 min达到平衡状态,SO2的平衡转化率90.0%。(2)①该温度下此反应的化学平衡常数为K=
②在相同温度下,某容器内c(SO2) = c(O2) = c(SO3) = 1.0 mol·L-1,则此时反应速率 v(正)
Ⅲ.下图表示在密闭容器中反应:2SO2+O2
 2SO3 ΔH<0 达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况。
2SO3 ΔH<0 达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况。
(3)若在c时刻压缩体积增大压强,请在图上将反应速率和化学平衡变化情况画在c~d处(每一时刻只改变浓度、温度、压强、催化剂条件之一)
您最近一年使用:0次
名校
解题方法
6 . 根据下列实验设计,回答问题:

(1)利用实验(I)探究锌与 硫酸和
硫酸和 硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):
硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):___________ 。
(2)实验(II)探究浓度对化学化学平衡影响。已知重铬酸钾溶液存在: (橙色)和
(橙色)和 (黄色)的平衡,如图操作,C中溶液颜色变深,D中溶液颜色变浅,
(黄色)的平衡,如图操作,C中溶液颜色变深,D中溶液颜色变浅,
①依据题意写出其中的离子方程式___________ ,
②用平衡移动原理解释D颜色变浅的原因:___________ ;
③加水稀释,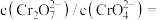
___________ (答“变大”、“变小”或“不变”)
(3)实验(III)目的是探究浓度对反应速率的影响,实验中发生反应: 。某小组也用酸性
。某小组也用酸性 溶液和草酸
溶液和草酸 溶液进行实验,实验操作及现象如下表:
溶液进行实验,实验操作及现象如下表:
①由实验i、实验ii可得出的结论是___________ 。
②关于实验i中 后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的
后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的 对反应有催化作用。利用提供的试剂设计实验ⅲ,验证猜想。
对反应有催化作用。利用提供的试剂设计实验ⅲ,验证猜想。
提供的试剂: 酸性
酸性 溶液,
溶液, 草酸溶液,
草酸溶液, 硫酸,
硫酸, 溶波,
溶波, 固体,蒸馏水。
固体,蒸馏水。
补全实验ⅲ的操作:向试管中先加入 酸性
酸性 溶液,
溶液,___________ ,最后加入 草酸溶液。
草酸溶液。
③基于以上实验与分析,推测实验(III)设计___________ (填“能”或“不能”)达到实验目的。

(1)利用实验(I)探究锌与
 硫酸和
硫酸和 硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):
硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):(2)实验(II)探究浓度对化学化学平衡影响。已知重铬酸钾溶液存在:
 (橙色)和
(橙色)和 (黄色)的平衡,如图操作,C中溶液颜色变深,D中溶液颜色变浅,
(黄色)的平衡,如图操作,C中溶液颜色变深,D中溶液颜色变浅,①依据题意写出其中的离子方程式
②用平衡移动原理解释D颜色变浅的原因:
③加水稀释,
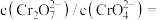
(3)实验(III)目的是探究浓度对反应速率的影响,实验中发生反应:
 。某小组也用酸性
。某小组也用酸性 溶液和草酸
溶液和草酸 溶液进行实验,实验操作及现象如下表:
溶液进行实验,实验操作及现象如下表:| 编号 | 实验操作 | 实验现象 |
| i | 向一支试管中先加入 酸性 酸性 溶液,再加入1滴 溶液,再加入1滴 硫酸和9滴蒸馏水、最后加入 硫酸和9滴蒸馏水、最后加入 草酸溶液 草酸溶液 | 前 内溶液紫色无明显变化,后颜色逐渐变浅, 内溶液紫色无明显变化,后颜色逐渐变浅, 后几乎变为无色 后几乎变为无色 |
| ii | 向另一支试管中先加入 酸性 酸性 溶液,再加入10滴 溶液,再加入10滴 硫酸,最后加入 硫酸,最后加入 草酸溶液 草酸溶液 |  内溶液紫色无明显变化,后颜色迅速变浅,约 内溶液紫色无明显变化,后颜色迅速变浅,约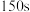 后几乎变为无色 后几乎变为无色 |
②关于实验i中
 后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的
后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的 对反应有催化作用。利用提供的试剂设计实验ⅲ,验证猜想。
对反应有催化作用。利用提供的试剂设计实验ⅲ,验证猜想。提供的试剂:
 酸性
酸性 溶液,
溶液, 草酸溶液,
草酸溶液, 硫酸,
硫酸, 溶波,
溶波, 固体,蒸馏水。
固体,蒸馏水。补全实验ⅲ的操作:向试管中先加入
 酸性
酸性 溶液,
溶液, 草酸溶液。
草酸溶液。③基于以上实验与分析,推测实验(III)设计
您最近一年使用:0次
7 . 能使反应 的反应速率增大,且平衡向正反应方向移动的是
的反应速率增大,且平衡向正反应方向移动的是
 的反应速率增大,且平衡向正反应方向移动的是
的反应速率增大,且平衡向正反应方向移动的是A.及时分离出 气体 气体 | B.增大 的浓度 的浓度 |
| C.适当降低温度 | D.选择高效催化剂 |
您最近一年使用:0次
名校
解题方法
8 . 实验小组探究外界因素对 平衡的影响。
平衡的影响。
Ⅰ.探究 对该平衡的影响。
对该平衡的影响。
将1 mL 0.005 mol⋅L
 溶液(接近无色)和1 mL 0.01 mol⋅L
溶液(接近无色)和1 mL 0.01 mol⋅L KSCN溶液混合,得到红色溶液。(
KSCN溶液混合,得到红色溶液。( 在溶液中存在平衡:
在溶液中存在平衡: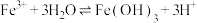 )
)
(1)甲同学认为加入酸后,会使体系中___________ 浓度增大,导致平衡 正向移动,溶液颜色加深。
正向移动,溶液颜色加深。
【设计并实施实验】用上述试剂制备两等份红色溶液,进行如下操作并记录现象。

【查阅资料】 与
与 、
、 均能以下反应:
均能以下反应:
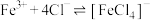 (黄色);
(黄色); (无色)
(无色)
【实验1】探究现象a中溶液颜色变化的原因(实验①②均重新制备红色溶液)
(2)实验①的目的是___________ 。
(3)根据实验①和实验②的结果,从平衡移动角度解释现象a:___________ 。
【实验2】探究现象b中溶液呈浅黄色的原因
乙同学认为,原溶液中存在 和
和 ,现象b中使溶液呈浅黄色的微粒可能是
,现象b中使溶液呈浅黄色的微粒可能是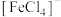 或
或 。乙同学通过下列实验,证实了现象b中使溶液呈浅黄色的微粒只是
。乙同学通过下列实验,证实了现象b中使溶液呈浅黄色的微粒只是 。
。
(4)请将实验③、④的操作补充完整: A.___________ ;B.___________ 。
Ⅱ.探究加水稀释对该平衡的影响。
(5)该小组按下表配制总体积相同的系列溶液,测定平衡时 浓度,记录数据。
浓度,记录数据。

___________ ,
___________ 。理论预测,加水稀释,该平衡向___________ (填“正反应”或“逆反应”)方向移动。 和
和 的关系是
的关系是___________ (用含 和
和 的不等式表示),该关系可以作为判断稀释对该平衡移动方向影响的证据。
的不等式表示),该关系可以作为判断稀释对该平衡移动方向影响的证据。
 平衡的影响。
平衡的影响。Ⅰ.探究
 对该平衡的影响。
对该平衡的影响。将1 mL 0.005 mol⋅L

 溶液(接近无色)和1 mL 0.01 mol⋅L
溶液(接近无色)和1 mL 0.01 mol⋅L KSCN溶液混合,得到红色溶液。(
KSCN溶液混合,得到红色溶液。( 在溶液中存在平衡:
在溶液中存在平衡: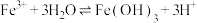 )
)(1)甲同学认为加入酸后,会使体系中
 正向移动,溶液颜色加深。
正向移动,溶液颜色加深。【设计并实施实验】用上述试剂制备两等份红色溶液,进行如下操作并记录现象。

【查阅资料】
 与
与 、
、 均能以下反应:
均能以下反应: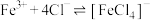 (黄色);
(黄色); (无色)
(无色)【实验1】探究现象a中溶液颜色变化的原因(实验①②均重新制备红色溶液)
| 编号 | 操作 | 现象 |
| ① | 向2 mL红色溶液中滴加5滴水 | 溶液颜色无明显变化 |
| ② | 向2 mL红色溶液中滴加5滴3 mol·L KCl溶液 KCl溶液 | 溶液颜色变浅,呈橙色 |
(2)实验①的目的是
(3)根据实验①和实验②的结果,从平衡移动角度解释现象a:
【实验2】探究现象b中溶液呈浅黄色的原因
乙同学认为,原溶液中存在
 和
和 ,现象b中使溶液呈浅黄色的微粒可能是
,现象b中使溶液呈浅黄色的微粒可能是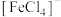 或
或 。乙同学通过下列实验,证实了现象b中使溶液呈浅黄色的微粒只是
。乙同学通过下列实验,证实了现象b中使溶液呈浅黄色的微粒只是 。
。| 编号 | 操作 | 现象 |
| ③ | 取1 mL 0.0025 mol·L A溶液,加入1 mL 0.01 mol·L A溶液,加入1 mL 0.01 mol·L KSCN溶液,再加入5滴1.5 mol·L KSCN溶液,再加入5滴1.5 mol·L  溶液 溶液 | 溶液先变红,加硫酸后变为浅黄色 |
| ④ | 取1 mL 0.005 mol·L  溶液,加入B,再加入5滴1.5 mol·L 溶液,加入B,再加入5滴1.5 mol·L  溶液 溶液 | 无明显现象 |
(4)请将实验③、④的操作补充完整: A.
Ⅱ.探究加水稀释对该平衡的影响。
(5)该小组按下表配制总体积相同的系列溶液,测定平衡时
 浓度,记录数据。
浓度,记录数据。| 编号 | 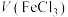 /mL /mL | V(KSCN)/mL |  /mL /mL |  /mol·L /mol·L |
| ⑤ | 10 | 10 | 0 |  |
| ⑥ | 2 | a | b |  |


 和
和 的关系是
的关系是 和
和 的不等式表示),该关系可以作为判断稀释对该平衡移动方向影响的证据。
的不等式表示),该关系可以作为判断稀释对该平衡移动方向影响的证据。
您最近一年使用:0次
名校
解题方法
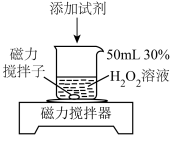
9 . 过氧化氢是一种常用的绿色试剂,某学习小组针对 性质进行如图实验。
性质进行如图实验。
Ⅰ.验证 的还原性
的还原性
查阅资料: 溶液与氯水发生反应时表现还原性。
溶液与氯水发生反应时表现还原性。
(1)制取氯水
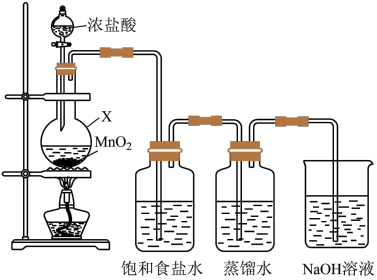
① 不溶于饱和食盐水的原因是
不溶于饱和食盐水的原因是________ (用平衡移动原理解释)。
②取5mL上述新制饱和氯水于试管中,向其中加入 溶液至过量,产生大量气泡(该气体可使余烬复燃),还观察到溶液颜色发生的变化是
溶液至过量,产生大量气泡(该气体可使余烬复燃),还观察到溶液颜色发生的变化是________ 。
Ⅱ.探究 、
、 对
对 分解的影响。记录数据如下:
分解的影响。记录数据如下:
(2)实验结果显示 ,可得出的结论是:
,可得出的结论是:________ (填化学式)更有利于 分解。
分解。
(3)甲同学查阅资料得知: 能加速
能加速 分解,
分解, 对
对 分解无影响。为排除
分解无影响。为排除 干扰,该同学进行实验:向两份
干扰,该同学进行实验:向两份 溶液中分别加入amL浓度均为
溶液中分别加入amL浓度均为________  的
的________ (填化学式)溶液和________ (填化学式)溶液。 内,发现
内,发现 均几乎不分解。甲同学认为:在无
均几乎不分解。甲同学认为:在无 存在的情况下,
存在的情况下, 、
、 对
对 催化分解无影响。
催化分解无影响。
(4)乙同学又提出猜想: 、
、 对
对 催化
催化 分解会产生影响。于是进行如表实验。限选试剂及其标号如下:
分解会产生影响。于是进行如表实验。限选试剂及其标号如下:
A. 溶液,B.少量KCl固体,C.
溶液,B.少量KCl固体,C. 溶液,D.少量
溶液,D.少量 固体
固体
(5)根据实验1~4中测得的 完全分解所需时间,小组同学认为
完全分解所需时间,小组同学认为
________ (填“增强”或“减弱”,下同) 的催化效果,
的催化效果,
________  的催化效果。
的催化效果。
 性质进行如图实验。
性质进行如图实验。Ⅰ.验证
 的还原性
的还原性查阅资料:
 溶液与氯水发生反应时表现还原性。
溶液与氯水发生反应时表现还原性。(1)制取氯水

①
 不溶于饱和食盐水的原因是
不溶于饱和食盐水的原因是②取5mL上述新制饱和氯水于试管中,向其中加入
 溶液至过量,产生大量气泡(该气体可使余烬复燃),还观察到溶液颜色发生的变化是
溶液至过量,产生大量气泡(该气体可使余烬复燃),还观察到溶液颜色发生的变化是Ⅱ.探究
 、
、 对
对 分解的影响。记录数据如下:
分解的影响。记录数据如下:
| 实验序号 | 添加试剂及用量 |
|
1 |
|
| |
2 |
|
|
(2)实验结果显示
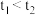 ,可得出的结论是:
,可得出的结论是: 分解。
分解。(3)甲同学查阅资料得知:
 能加速
能加速 分解,
分解, 对
对 分解无影响。为排除
分解无影响。为排除 干扰,该同学进行实验:向两份
干扰,该同学进行实验:向两份 溶液中分别加入amL浓度均为
溶液中分别加入amL浓度均为 的
的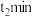 内,发现
内,发现 均几乎不分解。甲同学认为:在无
均几乎不分解。甲同学认为:在无 存在的情况下,
存在的情况下, 、
、 对
对 催化分解无影响。
催化分解无影响。(4)乙同学又提出猜想:
 、
、 对
对 催化
催化 分解会产生影响。于是进行如表实验。限选试剂及其标号如下:
分解会产生影响。于是进行如表实验。限选试剂及其标号如下:A.
 溶液,B.少量KCl固体,C.
溶液,B.少量KCl固体,C.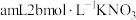 溶液,D.少量
溶液,D.少量 固体
固体
| 实验序号 | 添加试剂 |
|
3 | 需同时加入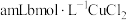 溶液和① 溶液和① |
| |
4 | 需同时加入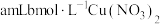 溶液和② 溶液和② |
|
(5)根据实验1~4中测得的
 完全分解所需时间,小组同学认为
完全分解所需时间,小组同学认为
 的催化效果,
的催化效果,
 的催化效果。
的催化效果。
您最近一年使用:0次
10 . 下列叙述中,不能用勒夏特列原理解释的是
A.合成氨工业的反应: ,增大压强有利于氨的合成 ,增大压强有利于氨的合成 |
| B.向双氧水中加入二氧化锰有利于氧气生成 |
| C.开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| D.用饱和食盐水吸收氯气中的HCl |
您最近一年使用:0次

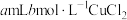 溶液
溶液
 溶液
溶液