名校
解题方法
1 .  新型材料应用前景广泛,其制备与性质研究成为热点。相关数据如下:
新型材料应用前景广泛,其制备与性质研究成为热点。相关数据如下:
(1) 的制备。
的制备。
①化学气相沉积法。
Ⅰ.一定温度下,以 气体和
气体和 为原料制备
为原料制备 ,反应的化学方程式是
,反应的化学方程式是______ 。
Ⅱ.上述反应适宜的温度范围是________ ℃(填字母)。
a.75~100 b.600~1100 c.2000~2300
②铝粉直接氮化法。
 与
与 可直接化合为
可直接化合为 固体,
固体, 能将
能将 包裹,反应难以继续进行。控制温度,在
包裹,反应难以继续进行。控制温度,在 粉中均匀掺入适量
粉中均匀掺入适量 粉,可使
粉,可使 几乎全部转化为
几乎全部转化为 固体。该过程发生的反应有:
固体。该过程发生的反应有:___________ 、___________ 和 。
。
③碳热还原法。
以 、C(石墨)和
、C(石墨)和 为原料,在高温下制备
为原料,在高温下制备 。
。
已知:i.
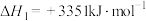
ii.
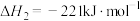
iii.
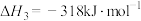
运用平衡移动原理分析反应ii对反应i的可能影响:___________ 。
(2) 的性质。
的性质。 粉末可发生水解的化学方程式是
粉末可发生水解的化学方程式是 。相同条件下,不同粒径的
。相同条件下,不同粒径的 粉末水解时溶液
粉末水解时溶液 的变化如图所示。
的变化如图所示。
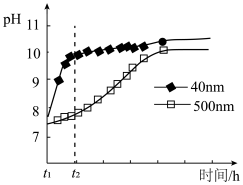
解释 时间内两条曲线差异的可能原因:
时间内两条曲线差异的可能原因:___________ 。
(3) 含量检测。向
含量检测。向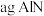 样品中加入足量浓
样品中加入足量浓 溶液,然后通入水蒸气将
溶液,然后通入水蒸气将 全部蒸出,将
全部蒸出,将 用过量的
用过量的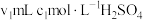 溶液吸收完全,剩余的
溶液吸收完全,剩余的 用
用 溶液恰好中和,则样品中
溶液恰好中和,则样品中 的质量分数是
的质量分数是___________ 。
 新型材料应用前景广泛,其制备与性质研究成为热点。相关数据如下:
新型材料应用前景广泛,其制备与性质研究成为热点。相关数据如下:| 物质 | 熔点/℃ | 沸点/℃ | 与 反应温度 /℃ 反应温度 /℃ | 相应化合物分解温度/℃ |
| Al | 660 | 2467 | >800 |  :>2000(>1400升华) :>2000(>1400升华) :(>181升华) :(>181升华) |
| Mg | 649 | 1090 | >300 |  :>800 :>800 |
(1)
 的制备。
的制备。①化学气相沉积法。
Ⅰ.一定温度下,以
 气体和
气体和 为原料制备
为原料制备 ,反应的化学方程式是
,反应的化学方程式是Ⅱ.上述反应适宜的温度范围是
a.75~100 b.600~1100 c.2000~2300
②铝粉直接氮化法。
 与
与 可直接化合为
可直接化合为 固体,
固体, 能将
能将 包裹,反应难以继续进行。控制温度,在
包裹,反应难以继续进行。控制温度,在 粉中均匀掺入适量
粉中均匀掺入适量 粉,可使
粉,可使 几乎全部转化为
几乎全部转化为 固体。该过程发生的反应有:
固体。该过程发生的反应有: 。
。③碳热还原法。
以
 、C(石墨)和
、C(石墨)和 为原料,在高温下制备
为原料,在高温下制备 。
。已知:i.

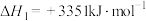
ii.

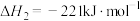
iii.

运用平衡移动原理分析反应ii对反应i的可能影响:
(2)
 的性质。
的性质。 粉末可发生水解的化学方程式是
粉末可发生水解的化学方程式是 。相同条件下,不同粒径的
。相同条件下,不同粒径的 粉末水解时溶液
粉末水解时溶液 的变化如图所示。
的变化如图所示。
解释
 时间内两条曲线差异的可能原因:
时间内两条曲线差异的可能原因:(3)
 含量检测。向
含量检测。向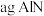 样品中加入足量浓
样品中加入足量浓 溶液,然后通入水蒸气将
溶液,然后通入水蒸气将 全部蒸出,将
全部蒸出,将 用过量的
用过量的 溶液吸收完全,剩余的
溶液吸收完全,剩余的 用
用 溶液恰好中和,则样品中
溶液恰好中和,则样品中 的质量分数是
的质量分数是
您最近一年使用:0次
2 . 过氧乙酸是具有重要用途的有机合成氧化剂和化工原料,实验室拟合成过氧乙酸并测定其含量。
(1)浓缩
在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30% 溶液,最终得到质量分数约68%的
溶液,最终得到质量分数约68%的 溶液。
溶液。
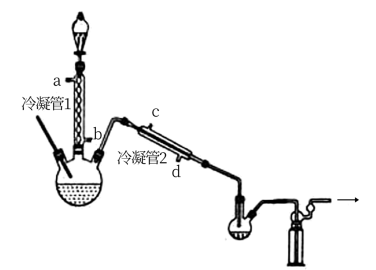
冷凝管1、冷凝管2中进水接口依次为___________ 、___________ (填字母)。
②加热温度不宜超过60℃的原因是___________ 。
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68% 溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
(已知:CH3COOH+H2O2
 +H2O)
+H2O)
①用浓缩的68% 溶液代替常见的30%
溶液代替常见的30% 溶液的目的是
溶液的目的是___________ 。
②充分搅拌的目的是___________ 。
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mL 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。
步骤c:向滴定后的溶液中再加1.0gKI( ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去( )。重复步骤b,步骤c三次,测得平均消耗
)。重复步骤b,步骤c三次,测得平均消耗 标准溶液的体积为20.00mL。
标准溶液的体积为20.00mL。
①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶,玻璃棒和量筒外,还需要___________
②设计步骤b的目的是___________
③过氧乙酸的质量分数为___________ %。
(1)浓缩

在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30%
 溶液,最终得到质量分数约68%的
溶液,最终得到质量分数约68%的 溶液。
溶液。
冷凝管1、冷凝管2中进水接口依次为
②加热温度不宜超过60℃的原因是
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68%
 溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。(已知:CH3COOH+H2O2
 +H2O)
+H2O)①用浓缩的68%
 溶液代替常见的30%
溶液代替常见的30% 溶液的目的是
溶液的目的是②充分搅拌的目的是
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mL
 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。步骤c:向滴定后的溶液中再加1.0gKI(
 ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去( )。重复步骤b,步骤c三次,测得平均消耗
)。重复步骤b,步骤c三次,测得平均消耗 标准溶液的体积为20.00mL。
标准溶液的体积为20.00mL。①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶,玻璃棒和量筒外,还需要
②设计步骤b的目的是
③过氧乙酸的质量分数为
您最近一年使用:0次
名校
解题方法
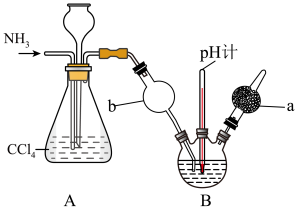
3 . 重铬酸铵[(NH4)2Cr2O7]可用作媒染剂和有机合成催化剂,具有强氧化性。实验室将NH3通入重铬酸(H2Cr2O7)溶液中制备[(NH4)2Cr2O7]的装置如图所示(夹持装置略)。回答下列问题:
已知: (橙色)+H2O⇌2
(橙色)+H2O⇌2 (黄色)+2H+。
(黄色)+2H+。
(1)仪器a的名称是_______ ,A装置的作用为_______ 。
(2)在试管中加入少量(NH4)2Cr2O7固体,加水溶解,再滴加足量KOH浓溶液,振荡,微热,观察到的主要现象是_______ 。
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的产品中(NH4)2Cr2O7的质量分数,其反应原理为2Ba2++ +H2O=2BaCrO4+2H+、4
+H2O=2BaCrO4+2H+、4 +6HCHO=(CH2)6N4H++6H2O+3H+,然后用NaOH标准溶液滴定反应生成的酸。
+6HCHO=(CH2)6N4H++6H2O+3H+,然后用NaOH标准溶液滴定反应生成的酸。
实验步骤:
I.称取样品12.00g,配成250mL溶液。
II.量取25.00mL样品溶液,用氯化钡溶液使Cr2O72-完全沉淀后,加入足量的20%中性甲醛溶液,摇匀,静置5min。
III.以酚酞作指示剂,用1.00mol·L-1的NaOH标准溶液滴定,记录数据。
IV.重复步骤II、III2~3次,处理数据。
①滴定终点的颜色变化为_______ 。
②用_______ (填“酸式”或“碱式”)滴定管量取25.00mL样品溶液于250mL锥形瓶中。
③与NaOH反应时,1mol(CH2)6N4H+与1molH+相当,步骤III中(CH2)6N4H+与NaOH发生反应的离子方程式是_______ 。
④若实验平均消耗NaOH溶液的体积为16.00mL,则所得产物中(NH4)2Cr2O7(摩尔质量为252g·mol-1)的质量分数为_______ %。
⑤若滴定终点时仰视读数,则测定的质量分数将_______ (填“偏大”、“偏小”或“不变”)。

已知:
 (橙色)+H2O⇌2
(橙色)+H2O⇌2 (黄色)+2H+。
(黄色)+2H+。(1)仪器a的名称是
(2)在试管中加入少量(NH4)2Cr2O7固体,加水溶解,再滴加足量KOH浓溶液,振荡,微热,观察到的主要现象是
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的产品中(NH4)2Cr2O7的质量分数,其反应原理为2Ba2++
 +H2O=2BaCrO4+2H+、4
+H2O=2BaCrO4+2H+、4 +6HCHO=(CH2)6N4H++6H2O+3H+,然后用NaOH标准溶液滴定反应生成的酸。
+6HCHO=(CH2)6N4H++6H2O+3H+,然后用NaOH标准溶液滴定反应生成的酸。实验步骤:
I.称取样品12.00g,配成250mL溶液。
II.量取25.00mL样品溶液,用氯化钡溶液使Cr2O72-完全沉淀后,加入足量的20%中性甲醛溶液,摇匀,静置5min。
III.以酚酞作指示剂,用1.00mol·L-1的NaOH标准溶液滴定,记录数据。
IV.重复步骤II、III2~3次,处理数据。
①滴定终点的颜色变化为
②用
③与NaOH反应时,1mol(CH2)6N4H+与1molH+相当,步骤III中(CH2)6N4H+与NaOH发生反应的离子方程式是
④若实验平均消耗NaOH溶液的体积为16.00mL,则所得产物中(NH4)2Cr2O7(摩尔质量为252g·mol-1)的质量分数为
⑤若滴定终点时仰视读数,则测定的质量分数将
您最近一年使用:0次
名校
解题方法
4 . 现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的正反应为____ 热反应,且m+n____ p(填“>”、“=”或“<”)。
(2)若容积不变加入B,则A的转化率____ ,B的转化率____ 。(填“增大”、“减小”或“不变”,下同)
(3)若升高温度,则平衡时B、C的浓度之比 将
将____ 。
(4)若加入催化剂,平衡时气体混合物的总物质的量____ 。
(5)若B是有色物质,A、C均无色,体积不变、加入C时混合物颜色____ ;维持容器内压强不变,充入氖气时,混合物颜色____ 。(填“变深”、“变浅”或“不变”)
 pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:(1)该反应的正反应为
(2)若容积不变加入B,则A的转化率
(3)若升高温度,则平衡时B、C的浓度之比
 将
将(4)若加入催化剂,平衡时气体混合物的总物质的量
(5)若B是有色物质,A、C均无色,体积不变、加入C时混合物颜色
您最近一年使用:0次
2022-09-27更新
|
183次组卷
|
2卷引用:江苏省如皋中学2022-2023学年高二上学期8月综合测试化学试题
名校
解题方法
5 . 铅铬黄是一种颜料,主要成分是铬酸铅 (摩尔质量323g/mol)。现以
(摩尔质量323g/mol)。现以 和
和 等为原料制备该物质,并测定产物纯度。
等为原料制备该物质,并测定产物纯度。
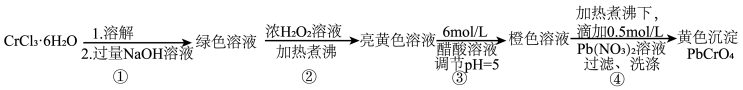
回答下列问题:
(1)已知 不溶于水,具有两性。第①步所得绿色溶液中的有色离子是
不溶于水,具有两性。第①步所得绿色溶液中的有色离子是_______ 。
(2)第②步生成了 ,写出该步骤的离子方程式
,写出该步骤的离子方程式_______ 。为了使 反应充分而不剩余,以下方案中最合理的是
反应充分而不剩余,以下方案中最合理的是_______ (填序号)。
A.首先加热绿色溶液,然后将一定量 浓溶液滴入其中
浓溶液滴入其中
B.首先加热 浓溶液,然后转入热的绿色溶液中
浓溶液,然后转入热的绿色溶液中
C.首先将一定量 浓溶液滴入绿色溶液中,然后加热煮沸
浓溶液滴入绿色溶液中,然后加热煮沸
(3)第③步调节pH=5的目的是为了将 转化为
转化为_______ (填写离子符号),并且防止在碱性条件下_______ 形成沉淀。
(4)由于铬酸铅的溶解度比重铬酸铅的小的多,在第④步中逐滴滴加 溶液后,产生
溶液后,产生 黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:
黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:_______ 。
(5)测定铅铬黄的纯度:取mg铅铭黄样品用盐酸酸化溶解,加足量KI将其还原为 ,再用
,再用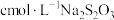 标准溶液滴定至淡黄绿色,发生反应
标准溶液滴定至淡黄绿色,发生反应 。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=
。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=_______ (用含c、m和V的式子表示)。
 (摩尔质量323g/mol)。现以
(摩尔质量323g/mol)。现以 和
和 等为原料制备该物质,并测定产物纯度。
等为原料制备该物质,并测定产物纯度。
回答下列问题:
(1)已知
 不溶于水,具有两性。第①步所得绿色溶液中的有色离子是
不溶于水,具有两性。第①步所得绿色溶液中的有色离子是(2)第②步生成了
 ,写出该步骤的离子方程式
,写出该步骤的离子方程式 反应充分而不剩余,以下方案中最合理的是
反应充分而不剩余,以下方案中最合理的是A.首先加热绿色溶液,然后将一定量
 浓溶液滴入其中
浓溶液滴入其中B.首先加热
 浓溶液,然后转入热的绿色溶液中
浓溶液,然后转入热的绿色溶液中C.首先将一定量
 浓溶液滴入绿色溶液中,然后加热煮沸
浓溶液滴入绿色溶液中,然后加热煮沸(3)第③步调节pH=5的目的是为了将
 转化为
转化为(4)由于铬酸铅的溶解度比重铬酸铅的小的多,在第④步中逐滴滴加
 溶液后,产生
溶液后,产生 黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:
黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:(5)测定铅铬黄的纯度:取mg铅铭黄样品用盐酸酸化溶解,加足量KI将其还原为
 ,再用
,再用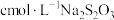 标准溶液滴定至淡黄绿色,发生反应
标准溶液滴定至淡黄绿色,发生反应 。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=
。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=
您最近一年使用:0次
2022-08-30更新
|
242次组卷
|
2卷引用:四川省成都市第七中学2023届高三上学期入学考试化学试题
名校
解题方法
6 . 湿法炼铅可用铅精矿(主要成分为 )作原料,在制备金属铅的同时,还可制得硫磺,相对环保。湿法炼铅的工艺流程如下:
)作原料,在制备金属铅的同时,还可制得硫磺,相对环保。湿法炼铅的工艺流程如下:

已知: 是一种难溶于冷水,易溶于热水的弱电解质。在
是一种难溶于冷水,易溶于热水的弱电解质。在 浓度较大的溶液中,存在平衡:
浓度较大的溶液中,存在平衡: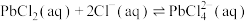 。回答下列问题:
。回答下列问题:
(1)写出铅精矿在浸取液中溶解并生成硫单质的离子方程式______ 。
(2)操作a是______ 。
(3)操作b为加适量水稀释并冷却,该操作有利于滤液1中 的析出,从平衡移动的角度分析可能的原因是
的析出,从平衡移动的角度分析可能的原因是______ 。
(4)将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的 再生。
再生。
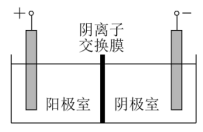
①溶液3应置于_______ (填“阴极室”或“阳极室”)中。
②简述滤液2电解后再生为 的原理:
的原理:_______ 。
③若铅精矿的质量为 ,铅浸出率为b,当电解池中通过
,铅浸出率为b,当电解池中通过 电子时,金属铅全部析出,铅精矿中
电子时,金属铅全部析出,铅精矿中 的质量分数为
的质量分数为_______ (用含a、b、c的代数式表示)。
 )作原料,在制备金属铅的同时,还可制得硫磺,相对环保。湿法炼铅的工艺流程如下:
)作原料,在制备金属铅的同时,还可制得硫磺,相对环保。湿法炼铅的工艺流程如下:
已知:
 是一种难溶于冷水,易溶于热水的弱电解质。在
是一种难溶于冷水,易溶于热水的弱电解质。在 浓度较大的溶液中,存在平衡:
浓度较大的溶液中,存在平衡: 。回答下列问题:
。回答下列问题:(1)写出铅精矿在浸取液中溶解并生成硫单质的离子方程式
(2)操作a是
(3)操作b为加适量水稀释并冷却,该操作有利于滤液1中
 的析出,从平衡移动的角度分析可能的原因是
的析出,从平衡移动的角度分析可能的原因是(4)将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的
 再生。
再生。
①溶液3应置于
②简述滤液2电解后再生为
 的原理:
的原理:③若铅精矿的质量为
 ,铅浸出率为b,当电解池中通过
,铅浸出率为b,当电解池中通过 电子时,金属铅全部析出,铅精矿中
电子时,金属铅全部析出,铅精矿中 的质量分数为
的质量分数为
您最近一年使用:0次
解题方法
7 . 工业上以铬铁矿(主要成分为 ,含Al、Si氧化物等杂质)为主要原料制备红矾钠
,含Al、Si氧化物等杂质)为主要原料制备红矾钠 的工艺流程如图。回答下列问题:
的工艺流程如图。回答下列问题:

(1) 中Fe元素的化合价
中Fe元素的化合价___________ ,焙烧的目的是将 转化为
转化为 并将Al、Si氧化物转化为可溶性钠盐,焙烧时气体与矿料逆流而行,目的是
并将Al、Si氧化物转化为可溶性钠盐,焙烧时气体与矿料逆流而行,目的是___________ 。
(2)滤渣2的成分___________ (填化学式)滤渣提纯后的用途___________ 。
(3)加入 酸化的作用是
酸化的作用是___________ (结合化学用语简述)。
(4)蒸发结晶时,过度蒸发将导致___________
(5)该小组用 铬铁矿(
铬铁矿( 的质量分数60%)制备
的质量分数60%)制备 ,最终得到产品
,最终得到产品 ,产率为
,产率为___________ (列出计算式)
 ,含Al、Si氧化物等杂质)为主要原料制备红矾钠
,含Al、Si氧化物等杂质)为主要原料制备红矾钠 的工艺流程如图。回答下列问题:
的工艺流程如图。回答下列问题:
(1)
 中Fe元素的化合价
中Fe元素的化合价 转化为
转化为 并将Al、Si氧化物转化为可溶性钠盐,焙烧时气体与矿料逆流而行,目的是
并将Al、Si氧化物转化为可溶性钠盐,焙烧时气体与矿料逆流而行,目的是(2)滤渣2的成分
(3)加入
 酸化的作用是
酸化的作用是(4)蒸发结晶时,过度蒸发将导致
(5)该小组用
 铬铁矿(
铬铁矿( 的质量分数60%)制备
的质量分数60%)制备 ,最终得到产品
,最终得到产品 ,产率为
,产率为
您最近一年使用:0次
名校
解题方法
8 . 重铬酸铵[(NH4)2Cr2O7]用作分析试剂、催化剂及媒染剂等。某化学兴趣小组对重铬酸铵的一些性质及组成进行探究。已知: (橙色)
(橙色) (黄色)
(黄色) 。回答下列问题:
。回答下列问题:
(1)在试管中加入少量重铬酸铵样品,滴加足量6 mol/LNaOH溶液,振荡、微热。产生的现象是_______ ,写出该反应的化学方程式:_______ 。
(2)为探究重铬酸铵的分解产物,按下图连接好装置,在A中加入2.520 g重铬酸铵样品进行实验。
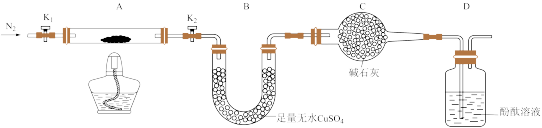
①实验过程中通入N2的主要目的是_______ 。
②加热A至恒重,观察到B中固体由白变蓝,D中酚酞溶液不变色,同时测得A、B中质量变化分别为1.00 g、0.720 g,则重铬酸铵受热分解的化学方程式为_______ 。
(3)实验室常利用甲醛法测定重铬酸铵样品中氮的质量分数,其反应原理为2Ba2++ +H2O=2BaCrO4↓+2H+,4
+H2O=2BaCrO4↓+2H+,4 +6HCHO=3H++6H2O+(CH2)6N4H+,滴定时1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。(不考虑甲醛与硝酸的反应)
+6HCHO=3H++6H2O+(CH2)6N4H+,滴定时1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。(不考虑甲醛与硝酸的反应)
实验步骤:称取样品2.600 g,配成250 mL溶液,移取25.00 mL样品溶液于锥形瓶中,加入硝酸钡溶液使 完全沉淀后,加入10 mL 20%的中性甲醛溶液,摇匀,静置5 min后,加入1~2滴酚酞溶液,用0.200 mol/LNaOH标准溶液滴定至终点,重复上述操作3次。
完全沉淀后,加入10 mL 20%的中性甲醛溶液,摇匀,静置5 min后,加入1~2滴酚酞溶液,用0.200 mol/LNaOH标准溶液滴定至终点,重复上述操作3次。
①碱式滳定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数_______ (填“偏大”“偏小”或“无影响”);滴定时边滴边摇动锥形㼛,眼睛应观察_______ 。
②滳定结果如下表所示:
该样品中氮的质量分数为_______ (结果保留两位小数)。
 (橙色)
(橙色) (黄色)
(黄色) 。回答下列问题:
。回答下列问题:(1)在试管中加入少量重铬酸铵样品,滴加足量6 mol/LNaOH溶液,振荡、微热。产生的现象是
(2)为探究重铬酸铵的分解产物,按下图连接好装置,在A中加入2.520 g重铬酸铵样品进行实验。

①实验过程中通入N2的主要目的是
②加热A至恒重,观察到B中固体由白变蓝,D中酚酞溶液不变色,同时测得A、B中质量变化分别为1.00 g、0.720 g,则重铬酸铵受热分解的化学方程式为
(3)实验室常利用甲醛法测定重铬酸铵样品中氮的质量分数,其反应原理为2Ba2++
 +H2O=2BaCrO4↓+2H+,4
+H2O=2BaCrO4↓+2H+,4 +6HCHO=3H++6H2O+(CH2)6N4H+,滴定时1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。(不考虑甲醛与硝酸的反应)
+6HCHO=3H++6H2O+(CH2)6N4H+,滴定时1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。(不考虑甲醛与硝酸的反应)实验步骤:称取样品2.600 g,配成250 mL溶液,移取25.00 mL样品溶液于锥形瓶中,加入硝酸钡溶液使
 完全沉淀后,加入10 mL 20%的中性甲醛溶液,摇匀,静置5 min后,加入1~2滴酚酞溶液,用0.200 mol/LNaOH标准溶液滴定至终点,重复上述操作3次。
完全沉淀后,加入10 mL 20%的中性甲醛溶液,摇匀,静置5 min后,加入1~2滴酚酞溶液,用0.200 mol/LNaOH标准溶液滴定至终点,重复上述操作3次。①碱式滳定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数
②滳定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.05 | 21.06 |
| 2 | 25.00 | 1.98 | 21.97 |
| 3 | 25.00 | 0.20 | 21.20 |
| 4 | 25.00 | 0.45 | 20.45 |
您最近一年使用:0次
2022-11-02更新
|
233次组卷
|
2卷引用:湖南省长沙市长郡中学2022-2023学年高二上学期期中考试化学试题
解题方法
9 . 工业上用含三价钒(V2O3)为主的某石煤为原料(含有Al2O3、SiO2、Fe2O3等杂质),低温硫酸化焙烧—水浸工艺制备V2O5,其流程如图:

资料:
ⅰ.VOSO4高温易分解
ⅱ.含磷有机试剂对溶液中离子萃取能力为Fe(III)>V(IV)>V(V)>Fe(II)
ⅲ.含磷有机试剂萃取过程中溶液的H+浓度越高,萃取率越低,萃取钒效果越差
ⅳ.10VO +8H2O
+8H2O H2V10O
H2V10O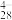 +14H+
+14H+
ⅴ.氢氧化物完全沉淀时溶液的pH表
(1)焙烧过程中向石煤中加硫酸焙烧,将V2O3转化为VOSO4的化学方程式是____ 。
(2)预处理过程中先加入Na2SO3溶液进行还原预处理,加入Na2SO3溶液的第一个作用是将V(V)还原为V(IV)减少钒的损失,再用氨水混合并调节溶液pH。
①请结合相关离子方程式,说明加入Na2SO3的第二个作用____ 。
②解释加氨水调节pH≈5的原因是____ 。
(3)上述I的具体操作为____ 。
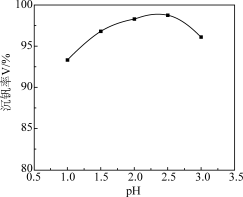
(4)沉钒过程中先加入NaClO3进行氧化,再加氨水调节pH,铵盐会将H2V10O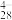 中的钒元素以多钒酸铵((NH4)2V6O16)的形式沉淀。溶液pH值与沉钒率的关系如图,请结合反应原理解释沉钒的pH=2.5的原因是
中的钒元素以多钒酸铵((NH4)2V6O16)的形式沉淀。溶液pH值与沉钒率的关系如图,请结合反应原理解释沉钒的pH=2.5的原因是____ 。
(5)测定产品中V2O5的纯度:
称取ag产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1mLc1mol·L-1(NH4)2Fe(SO4)2溶液(VO +2H++Fe2+=VO2++Fe3++H2O)最后用c2mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知MnO
+2H++Fe2+=VO2++Fe3++H2O)最后用c2mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知MnO 被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是
被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是____ 。(V2O5的摩尔质量:182g•mol-1)

资料:
ⅰ.VOSO4高温易分解
ⅱ.含磷有机试剂对溶液中离子萃取能力为Fe(III)>V(IV)>V(V)>Fe(II)
ⅲ.含磷有机试剂萃取过程中溶液的H+浓度越高,萃取率越低,萃取钒效果越差
ⅳ.10VO
 +8H2O
+8H2O H2V10O
H2V10O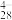 +14H+
+14H+ⅴ.氢氧化物完全沉淀时溶液的pH表
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 完全沉淀 | 3.2 | 9.0 | 4.7 |
(2)预处理过程中先加入Na2SO3溶液进行还原预处理,加入Na2SO3溶液的第一个作用是将V(V)还原为V(IV)减少钒的损失,再用氨水混合并调节溶液pH。
①请结合相关离子方程式,说明加入Na2SO3的第二个作用
②解释加氨水调节pH≈5的原因是
(3)上述I的具体操作为
(4)沉钒过程中先加入NaClO3进行氧化,再加氨水调节pH,铵盐会将H2V10O
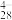 中的钒元素以多钒酸铵((NH4)2V6O16)的形式沉淀。溶液pH值与沉钒率的关系如图,请结合反应原理解释沉钒的pH=2.5的原因是
中的钒元素以多钒酸铵((NH4)2V6O16)的形式沉淀。溶液pH值与沉钒率的关系如图,请结合反应原理解释沉钒的pH=2.5的原因是
(5)测定产品中V2O5的纯度:
称取ag产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1mLc1mol·L-1(NH4)2Fe(SO4)2溶液(VO
 +2H++Fe2+=VO2++Fe3++H2O)最后用c2mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知MnO
+2H++Fe2+=VO2++Fe3++H2O)最后用c2mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知MnO 被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是
被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是
您最近一年使用:0次
名校
解题方法
10 . 合成氨工业中采用循环操作,主要是为了
| A.增大化学反应速率 | B.提高平衡混合物中氨的含量 |
| C.降低氨的沸点 | D.提高氮气和氢气的利用率 |
您最近一年使用:0次
2023-06-30更新
|
504次组卷
|
16卷引用:河北省石家庄市2021-2022学年高二上学期期末考试化学试题
河北省石家庄市2021-2022学年高二上学期期末考试化学试题(已下线)2.4 化学反应的调控-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)吉林省吉林市2022-2023学年高二上学期期中调研测试化学试题黑龙江省虎林市高级中学2022-2023学年高二上学期期中考试化学试题云南省玉溪市华宁县第二中学2021-2022年高二下学期开学考试化学试题湖北省武汉市长虹中学2021-2022学年高二上学期10月月考化学试卷山西省怀仁市2021-2022学年高二上学期期中化学试题人教2019版选择性必修一第二章 第四节 化学反应的调控 课后习题新疆喀什地区疏附县第一中学2022-2023学年高二上学期期末考试化学试题(已下线)化学反应速率与化学平衡——课时7化学反应的调控(已下线)第08讲 化学反应的调控-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)陕西省西安市鄠邑区2022-2023学年高一下学期6月期末考试化学试题 广东实验中学越秀学校2023-2024学年高二上学期期中考试化学试题四川省遂宁市射洪中学校2023-2024学年高二上学期11月期中化学试题青海省西宁市大通县2023-2024学年高二上学期期末考试化学试题贵州神贵阳市2023-2024学年清镇市博雅实验学校高二上学期第四次月考化学试卷



