名校
1 . 小组同学探究盐溶液对反应 (血红色)的影响。将
(血红色)的影响。将
 的
的 溶液与
溶液与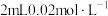 的
的 溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
ii. (黄色)
(黄色)
iii.已知 对实验无影响
对实验无影响
下列说法不正确的是
 (血红色)的影响。将
(血红色)的影响。将
 的
的 溶液与
溶液与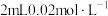 的
的 溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。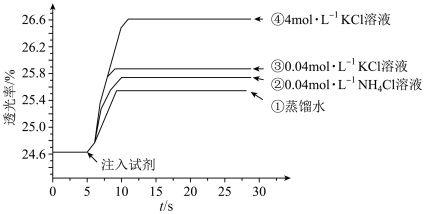
ii.
 (黄色)
(黄色)iii.已知
 对实验无影响
对实验无影响下列说法不正确的是
A.注入试剂①后溶液透光率增大,证明 逆向移动 逆向移动 |
B.透光率③比②高,可能是阳离子种类或溶液 不同导致的 不同导致的 |
C.透光率④比③高,可能发生了反应 |
D.若要证明试剂③中 对平衡体系有影响,还应使用 对平衡体系有影响,还应使用 的 的 溶液进行对照实验 溶液进行对照实验 |
您最近半年使用:0次
2023-11-21更新
|
337次组卷
|
7卷引用:北京市对外经济贸易大学附属中学2022-2023学年高二上学期期中考试化学试题
2 . 某同学为探究浓度对化学平衡的影响设计了如下实验:已知:
反应i:
反应ii: (黄色)
(黄色)
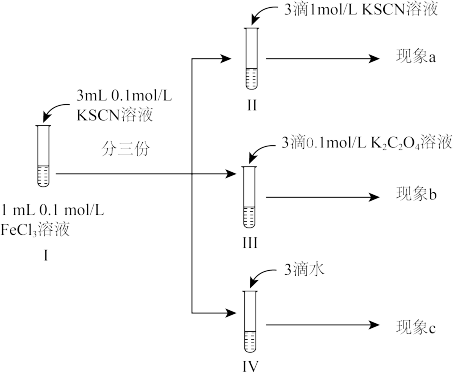
下列说法不正确 的是
反应i:

反应ii:
 (黄色)
(黄色)
下列说法
| A.观察到现象a比现象c中红色更深,即可证明增加反应物浓度,反应i平衡正向移动 |
| B.观察到现象b比现象c中红色浅,即可说明反应i平衡逆向移动,反应ⅱ平衡正向移动 |
| C.进行IV对比实验的主要目的是防止出于溶液体积变化引起各离子浓度变化而干扰实验结论得出 |
D.III中溶液一开始无 ,12小时后检出 ,12小时后检出 ,可能的原因是 ,可能的原因是 还原 还原 的速率较慢,反应ⅱ速率较快 的速率较慢,反应ⅱ速率较快 |
您最近半年使用:0次
2023-01-06更新
|
305次组卷
|
3卷引用:北京市昌平区2022-2023学年高二上学期期末考试化学试题
3 . 某兴趣小组以重铬酸钾( )溶液为研究对象,改变条件使其发生“色彩变幻”。
)溶液为研究对象,改变条件使其发生“色彩变幻”。
已知:① 溶液存在平衡:
溶液存在平衡: 。
。
②含铬元素的离子在溶液中的颜色: (橙色);
(橙色); (黄色);Cr3+(绿色)。
(黄色);Cr3+(绿色)。 的正反应是
的正反应是_____ (填“吸热”或“放热”)反应。
(2)ⅱ是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是_____ (填化学式)。
(3)ⅲ的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验不能达到预期目的,理由是______ 。
(4)根据实验Ⅱ中不同现象,可以得出的结论是______ 。
(5)继续实验Ⅲ:______ 。
②第二步溶液变绿色:该反应的离子方程式是_______ 。
 )溶液为研究对象,改变条件使其发生“色彩变幻”。
)溶液为研究对象,改变条件使其发生“色彩变幻”。已知:①
 溶液存在平衡:
溶液存在平衡: 。
。②含铬元素的离子在溶液中的颜色:
 (橙色);
(橙色); (黄色);Cr3+(绿色)。
(黄色);Cr3+(绿色)。
 的正反应是
的正反应是(2)ⅱ是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是
(3)ⅲ的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验不能达到预期目的,理由是
(4)根据实验Ⅱ中不同现象,可以得出的结论是
(5)继续实验Ⅲ:
实验Ⅲ: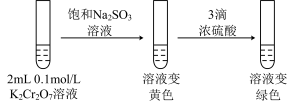
②第二步溶液变绿色:该反应的离子方程式是
您最近半年使用:0次
4 . 某校化学学习小组探究 与
与 溶液的反应,装置如下图所示,分液漏斗中盛有浓硫酸,锥形瓶中装有
溶液的反应,装置如下图所示,分液漏斗中盛有浓硫酸,锥形瓶中装有 固体。回答下列问题:
固体。回答下列问题:
(1)写出实验中制备 的化学方程式
的化学方程式________ 。
(2)配制100mL
 溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和
溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和________ 。
【实验探究】
向3mL
 溶液中通入
溶液中通入 ,观察到溶液立即由黄色变成红棕色,放置12小时后,,红棕色消失,溶液变为浅绿色。结合已有知识,针对溶液呈红棕色学习小组提出以下猜想:
,观察到溶液立即由黄色变成红棕色,放置12小时后,,红棕色消失,溶液变为浅绿色。结合已有知识,针对溶液呈红棕色学习小组提出以下猜想:
猜想1: 水解产生了红棕色的
水解产生了红棕色的 胶体;
胶体;
猜想2: 与溶液中某种
与溶液中某种 价含硫微粒形成了红棕色的配合物。
价含硫微粒形成了红棕色的配合物。
(3)为验证上述猜想,甲同学用激光笔照射该红棕色溶液,________ ,证明猜想1不成立。
(4)乙同学查阅文献得知猜想2正确,并设计了下表3组实验,以确定红棕色配合物的配体是 、
、 、
、 中的哪一种(实验均在常温下进行)。
中的哪一种(实验均在常温下进行)。
已知:常温下,溶液中 价含硫微粒物质的量分数随pH变化曲线如图所示。
价含硫微粒物质的量分数随pH变化曲线如图所示。________ (填写微粒符号),依据的实验证据是________ 。
(5)丙同学查阅资料得知:
利用分光光度计可测定溶液中有色物质的吸光度,吸光度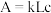 ,其中k为摩尔吸收系数;L为液层厚度即光路长度,在实验中液层厚度保持一致;c为有色物质的浓度。
,其中k为摩尔吸收系数;L为液层厚度即光路长度,在实验中液层厚度保持一致;c为有色物质的浓度。
丙同学经过思考,认为乙同学的实验方案不严谨,除了pH会影响溶液红棕色的深浅,还有一个因素也可能会影响溶液红棕色的深浅。于是设计如下实验进行探究,请帮助该同学完成实验方案,填写下表中空白处。
实验结果讨论:若 ,则该因素不影响溶液红棕色的深浅;若
,则该因素不影响溶液红棕色的深浅;若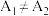 ,则该因素会影响溶液红棕色的深浅。
,则该因素会影响溶液红棕色的深浅。
(6)丁同学查阅资料得知:
配合物在溶液中存在解离平衡,如: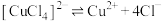 。
。
丁同学设计实验,利用分光光度计测定上述溶液中红棕色物质的吸光度,证明解离平衡的存在。请完成表中内容。
实验限选试剂为: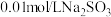 溶液,
溶液,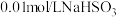 溶液,
溶液, 固体,
固体,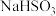 固体
固体
 与
与 溶液的反应,装置如下图所示,分液漏斗中盛有浓硫酸,锥形瓶中装有
溶液的反应,装置如下图所示,分液漏斗中盛有浓硫酸,锥形瓶中装有 固体。回答下列问题:
固体。回答下列问题: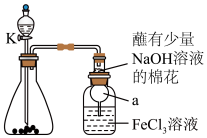
(1)写出实验中制备
 的化学方程式
的化学方程式(2)配制100mL

 溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和
溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和【实验探究】
向3mL

 溶液中通入
溶液中通入 ,观察到溶液立即由黄色变成红棕色,放置12小时后,,红棕色消失,溶液变为浅绿色。结合已有知识,针对溶液呈红棕色学习小组提出以下猜想:
,观察到溶液立即由黄色变成红棕色,放置12小时后,,红棕色消失,溶液变为浅绿色。结合已有知识,针对溶液呈红棕色学习小组提出以下猜想:猜想1:
 水解产生了红棕色的
水解产生了红棕色的 胶体;
胶体;猜想2:
 与溶液中某种
与溶液中某种 价含硫微粒形成了红棕色的配合物。
价含硫微粒形成了红棕色的配合物。(3)为验证上述猜想,甲同学用激光笔照射该红棕色溶液,
(4)乙同学查阅文献得知猜想2正确,并设计了下表3组实验,以确定红棕色配合物的配体是
 、
、 、
、 中的哪一种(实验均在常温下进行)。
中的哪一种(实验均在常温下进行)。组别 | 溶液1(1mL) | 溶液2(2mL) | 现象 |
a |
|
| 溶液1和溶液2混合后,组别a、b、c所得溶液红棕色依次加深。 |
b |  的饱和溶液,用 的饱和溶液,用 固体调节. 固体调节. | ||
c |  的饱和溶液,用 的饱和溶液,用 固体调节 固体调节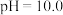 |
 价含硫微粒物质的量分数随pH变化曲线如图所示。
价含硫微粒物质的量分数随pH变化曲线如图所示。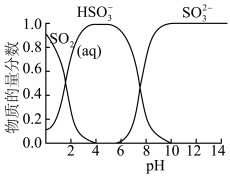
(5)丙同学查阅资料得知:
利用分光光度计可测定溶液中有色物质的吸光度,吸光度
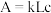 ,其中k为摩尔吸收系数;L为液层厚度即光路长度,在实验中液层厚度保持一致;c为有色物质的浓度。
,其中k为摩尔吸收系数;L为液层厚度即光路长度,在实验中液层厚度保持一致;c为有色物质的浓度。丙同学经过思考,认为乙同学的实验方案不严谨,除了pH会影响溶液红棕色的深浅,还有一个因素也可能会影响溶液红棕色的深浅。于是设计如下实验进行探究,请帮助该同学完成实验方案,填写下表中空白处。
实验序号 | 操作 | 吸光度 |
1 | 把1mL 0.1mol/L 溶液与2mL 溶液与2mL 饱和溶液混合均匀,溶液变成红棕色,测定溶液中红棕色物质的吸光度。 饱和溶液混合均匀,溶液变成红棕色,测定溶液中红棕色物质的吸光度。 |
|
2 |
|
 ,则该因素不影响溶液红棕色的深浅;若
,则该因素不影响溶液红棕色的深浅;若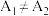 ,则该因素会影响溶液红棕色的深浅。
,则该因素会影响溶液红棕色的深浅。(6)丁同学查阅资料得知:
配合物在溶液中存在解离平衡,如:
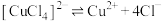 。
。丁同学设计实验,利用分光光度计测定上述溶液中红棕色物质的吸光度,证明解离平衡的存在。请完成表中内容。
实验限选试剂为:
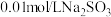 溶液,
溶液,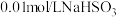 溶液,
溶液, 固体,
固体,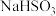 固体
固体实验序号 | 操作 | 吸光度 | 结论 |
3 | 向3mL 0.1mol/L 溶液中通入 溶液中通入 ,溶液立即由黄色变成红棕色,测定溶液中红棕色物质的吸光度 ,溶液立即由黄色变成红棕色,测定溶液中红棕色物质的吸光度 |
| |
4 |
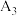 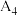 (填“大于”、“小于”或“等于”) (填“大于”、“小于”或“等于”) | 平衡向 |
您最近半年使用:0次
解题方法
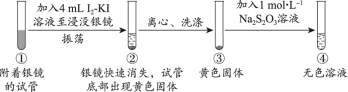
5 . 资料显示,I2-KI溶液可以清洗银镜。某小组同学设计实验探究银镜在I2-KI溶液中的溶解情况。
已知:I2微溶于水,易溶于KI溶液,并发生反应I2+I− I
I (棕色),I2和I
(棕色),I2和I 氧化性几乎相同;[Ag(S2O3)2]3−在水溶液中无色。
氧化性几乎相同;[Ag(S2O3)2]3−在水溶液中无色。
探究1:I2-KI溶液(向1mol·L−1KI溶液中加入I2至饱和)溶解银镜
【实验i】_____ 。
(2)能证明②中Ag已全部反应、未被包裹在黄色固体内的实验证据是_____ 。
探究2:I2-KI溶液能快速溶解银镜的原因
【实验ii~iv】向附着银镜的试管中加入相应试剂至浸没银镜,记录如下:
(3)ⅰi中,搅拌后银镜继续溶解的原因是_____ 。
(4)由i、iii可得到的结论是_____ 。
(5)设计iv的目的是_____ 。
探究3:I−的作用
【实验v】
说明:本实验中,检流计读数越大,说明氧化剂氧化性(或还原剂还原性)越强。
(6)步骤1接通电路后,正极的电极反应物为_____ 。
(7)补全步骤3的操作及现象:_____ ,_____ 。
(8)综合上述探究,从反应速率和物质性质的角度分析i中I2-KI溶液能快速全部溶解银镜的原因:_____ 。
已知:I2微溶于水,易溶于KI溶液,并发生反应I2+I−
 I
I (棕色),I2和I
(棕色),I2和I 氧化性几乎相同;[Ag(S2O3)2]3−在水溶液中无色。
氧化性几乎相同;[Ag(S2O3)2]3−在水溶液中无色。探究1:I2-KI溶液(向1mol·L−1KI溶液中加入I2至饱和)溶解银镜
【实验i】
(2)能证明②中Ag已全部反应、未被包裹在黄色固体内的实验证据是
探究2:I2-KI溶液能快速溶解银镜的原因
【实验ii~iv】向附着银镜的试管中加入相应试剂至浸没银镜,记录如下:
| 序号 | 加入试剂 | 实验现象 |
| ⅰi | 4mL饱和碘水(向水中加入I2至饱和, | 30min后,银镜少部分溶解,溶液棕黄色变浅;放置24h后,与紫黑色固体接触部分银镜消失,紫黑色固体表面上有黄色固体,上层溶液接近无色;搅拌后,银镜继续溶解 |
| ⅱi | 4mL饱和碘水和0.66gKI固体(溶液中KI约1mol·L−1) | 15min后银镜部分溶解,溶液棕黄色变浅;放置24h后,试管壁上仍有未溶解的银镜,溶液无色 |
| iv | 4mL1mol·L−1KI溶液 | 放置24h,银镜不溶解,溶液无明显变化 |
(4)由i、iii可得到的结论是
(5)设计iv的目的是
探究3:I−的作用
【实验v】
| 实验装置 | 实验步骤及现象 |
| 1.按左图搭好装置,接通电路,检流计指针向 右微弱偏转,检流计读数为amA; 2.向石墨电极附近滴加饱和碘水,指针继续向 右偏转,检流计读数为bmA(b>a); 3.向左侧烧杯中加入_____,指针继续向右偏转,检流计读数cmA(c>b),有_____生成。 |
(6)步骤1接通电路后,正极的电极反应物为
(7)补全步骤3的操作及现象:
(8)综合上述探究,从反应速率和物质性质的角度分析i中I2-KI溶液能快速全部溶解银镜的原因:
您最近半年使用:0次
解题方法
6 . 某学习小组欲利用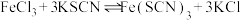 平衡体系探究影响平衡的因素,将
平衡体系探究影响平衡的因素,将
 溶液和
溶液和 溶液混合,得血红色溶液X,进行下列实验:
溶液混合,得血红色溶液X,进行下列实验:
实验Ⅰ.改变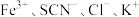 等离子浓度对平衡的影响
等离子浓度对平衡的影响
(1)取 溶液X,加入5滴
溶液X,加入5滴 溶液,得到溶液A;另取
溶液,得到溶液A;另取 溶液X,插入经砂纸打磨过的铁丝得到溶液B,A、B两溶液颜更深的是
溶液X,插入经砂纸打磨过的铁丝得到溶液B,A、B两溶液颜更深的是___________ (填A或B)。原因是:___________ 。
(2)取 溶液X,加入5滴
溶液X,加入5滴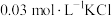 溶液,观察到溶液红色变浅,产生该现象的原因可能是:①
溶液,观察到溶液红色变浅,产生该现象的原因可能是:①___________ 对平衡产生了影响;②不直接参与平衡体系的 或
或 对平衡产生了影响。
对平衡产生了影响。
实验Ⅱ.为了探究KCl对 平衡体系的影响某学习小组同学进行如下探究:各取
平衡体系的影响某学习小组同学进行如下探究:各取 溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
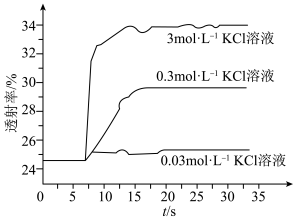
(3)上述实验可以得到以下结论:一是KCl对 平衡有影响,且KCl浓度越大,影响
平衡有影响,且KCl浓度越大,影响___________ 移动(填“正向、逆向或不”)。
(4)针对产生上述影响的可能原因,学习小组同学提出以下猜想:
猜想①: 产生的影响。
产生的影响。
猜想②: 产生的影响。
产生的影响。
猜想③:___________ 。
实验Ⅲ.探究盐对 和
和 平衡体系产生的影响资料信息:
平衡体系产生的影响资料信息:
a.溶液中的 离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
b.在 溶液中存在反应
溶液中存在反应 。
。
(5)根据上述信息,学习小组同学各取 溶液X,分别加入5滴①去离子水、②
溶液X,分别加入5滴①去离子水、②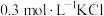 溶液、③
溶液、③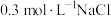 溶液、④
溶液、④ 溶液、⑤
溶液、⑤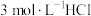 溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
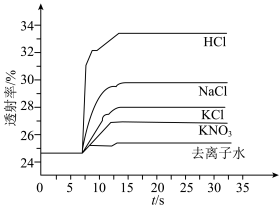
上述实验能证明阳离子盐效应影响 平衡体系的实验组是
平衡体系的实验组是___________ 。盐效应影响较大的阳离子是___________ 。
A.实验①②③ B.实验①②④ C.实验①③④
(6)已知 对平衡没有明显的影响,解释出现实验⑤现象的原因:
对平衡没有明显的影响,解释出现实验⑤现象的原因:___________ 。
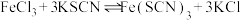 平衡体系探究影响平衡的因素,将
平衡体系探究影响平衡的因素,将
 溶液和
溶液和 溶液混合,得血红色溶液X,进行下列实验:
溶液混合,得血红色溶液X,进行下列实验:实验Ⅰ.改变
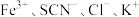 等离子浓度对平衡的影响
等离子浓度对平衡的影响(1)取
 溶液X,加入5滴
溶液X,加入5滴 溶液,得到溶液A;另取
溶液,得到溶液A;另取 溶液X,插入经砂纸打磨过的铁丝得到溶液B,A、B两溶液颜更深的是
溶液X,插入经砂纸打磨过的铁丝得到溶液B,A、B两溶液颜更深的是(2)取
 溶液X,加入5滴
溶液X,加入5滴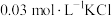 溶液,观察到溶液红色变浅,产生该现象的原因可能是:①
溶液,观察到溶液红色变浅,产生该现象的原因可能是:① 或
或 对平衡产生了影响。
对平衡产生了影响。实验Ⅱ.为了探究KCl对
 平衡体系的影响某学习小组同学进行如下探究:各取
平衡体系的影响某学习小组同学进行如下探究:各取 溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
(3)上述实验可以得到以下结论:一是KCl对
 平衡有影响,且KCl浓度越大,影响
平衡有影响,且KCl浓度越大,影响(4)针对产生上述影响的可能原因,学习小组同学提出以下猜想:
猜想①:
 产生的影响。
产生的影响。 猜想②:
 产生的影响。
产生的影响。 猜想③:
实验Ⅲ.探究盐对
 和
和 平衡体系产生的影响资料信息:
平衡体系产生的影响资料信息:a.溶液中的
 离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。b.在
 溶液中存在反应
溶液中存在反应 。
。(5)根据上述信息,学习小组同学各取
 溶液X,分别加入5滴①去离子水、②
溶液X,分别加入5滴①去离子水、②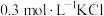 溶液、③
溶液、③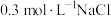 溶液、④
溶液、④ 溶液、⑤
溶液、⑤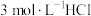 溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
上述实验能证明阳离子盐效应影响
 平衡体系的实验组是
平衡体系的实验组是A.实验①②③ B.实验①②④ C.实验①③④
(6)已知
 对平衡没有明显的影响,解释出现实验⑤现象的原因:
对平衡没有明显的影响,解释出现实验⑤现象的原因:
您最近半年使用:0次
名校
7 . 氯化银的还原精炼技术是银回收精炼过程中的重要环节,有多种方法还原精炼。
(一)、甲小组选择强还原剂:肼(N2H4)。
在还原AgCl制取银的过程中有对环境无污染气体产生。
(1)①写出相关的化学反应方程式:___________ 。
【资料】工业上一般先向氯化银中加入氨水浆化,然后用N2H4还原,可有利于反应的进行。
②写出浆化过程中的离子反应式:___________ 。从N2H4发生的氧化反应(半反应)的角度分析加入氨水的作用___________ 。
(二)、乙小组换用铁粉还原AgCl制取银,探究其过程和影响因素。
【实验A】在试管中加入NaCl溶液,然后滴入AgNO3溶液,产生白色沉淀。滤出白色沉淀,继续实验如下:
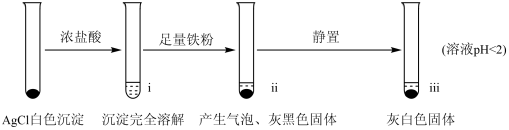
【资料】①AgCl+Cl- AgCl
AgCl
②Fe3++4Cl- FeCl
FeCl
(2)检验ⅱ中产物
①取ⅱ中上层清液,滴加K3[Fe(CN)6]溶液,___________ (填现象),说明溶液中含有Fe2+。
②取ⅱ中少量灰黑色固体,洗涤后将固体等分两份。取其中一份,加入___________ (填试剂)溶解,再加入NaCl溶液生成白色沉淀,证明灰黑色固体中含有Ag。向另一份加入KI溶液,无明显现象。
(3)检验ⅲ中产物。
①取ⅲ中灰白色固体,洗涤。进行如下实验,确认灰白色固体中含AgCl:
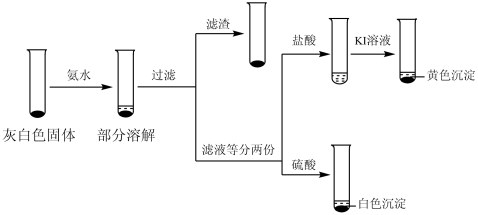
滤液加盐酸未产生沉淀,但加入硫酸后产生了白色沉淀,请结合离子方程式解释原因:___________ 。
②取iii中上层溶液,加几滴KSCN溶液。取样时间与溶液颜色如下表。
用离子方程式表示溶液变红的原因___________ ,Fe3++SCN- Fe(SCN)3。
Fe(SCN)3。
(4)小组同学认为不能排除O2直接氧化Ag继而生成AgCl,对此设计实验:___________ 。结果发现,该实验产生AgCl所需的时间更长。说明AgCl的产生主要与Fe3+有关。
(5)实验A中的i~iii中,i中AgCl溶解,iii中又生成AgCl的原因是:___________ 。
乙组实验反思:铁粉还原AgCl制取银时应控制铁粉、盐酸的浓度和浸泡时间等因素
(一)、甲小组选择强还原剂:肼(N2H4)。
在还原AgCl制取银的过程中有对环境无污染气体产生。
(1)①写出相关的化学反应方程式:
【资料】工业上一般先向氯化银中加入氨水浆化,然后用N2H4还原,可有利于反应的进行。
②写出浆化过程中的离子反应式:
(二)、乙小组换用铁粉还原AgCl制取银,探究其过程和影响因素。
【实验A】在试管中加入NaCl溶液,然后滴入AgNO3溶液,产生白色沉淀。滤出白色沉淀,继续实验如下:

【资料】①AgCl+Cl-
 AgCl
AgCl
②Fe3++4Cl-
 FeCl
FeCl
(2)检验ⅱ中产物
①取ⅱ中上层清液,滴加K3[Fe(CN)6]溶液,
②取ⅱ中少量灰黑色固体,洗涤后将固体等分两份。取其中一份,加入
(3)检验ⅲ中产物。
①取ⅲ中灰白色固体,洗涤。进行如下实验,确认灰白色固体中含AgCl:

滤液加盐酸未产生沉淀,但加入硫酸后产生了白色沉淀,请结合离子方程式解释原因:
②取iii中上层溶液,加几滴KSCN溶液。取样时间与溶液颜色如下表。
| 取样时间 | 10分钟 | 12小时 | 24小时 |
| 溶液颜色 | 浅红色 | 红色 | 深红色 |
 Fe(SCN)3。
Fe(SCN)3。(4)小组同学认为不能排除O2直接氧化Ag继而生成AgCl,对此设计实验:
(5)实验A中的i~iii中,i中AgCl溶解,iii中又生成AgCl的原因是:
乙组实验反思:铁粉还原AgCl制取银时应控制铁粉、盐酸的浓度和浸泡时间等因素
您最近半年使用:0次
8 . 某小组同学探究铁离子与苯酚的反应。
已知:Fe3++6C6H5O [Fe(C6H5O)6]3;[Fe(C6H5O)6]3为紫色配合物。
[Fe(C6H5O)6]3;[Fe(C6H5O)6]3为紫色配合物。
(1)配制100mL0.1mol·L-1苯酚溶液,需要用到的玻璃仪器有:烧杯、玻璃棒、胶头滴管、___________ 。
(2)氯化铁溶液呈___________ (填“酸性”或“碱性”),用离子方程式表示原因___________ 。
(3)[Fe(C6H5O)6]3中,提供空轨道用以形成配位键的微粒是___________ 。
(4)进行如下实验。
实验1:

实验2:

【提出猜想】
i.Cl对铁离子与苯酚的反应有促进作用;
ii.SO 对铁离子与苯酚的反应有抑制作用。
对铁离子与苯酚的反应有抑制作用。
①向实验2反应后溶液中加入___________ ,溶液颜色无变化,证明猜想i不成立。
②实验证明猜想ii成立,请写出实验操作和现象___________ 。
(5)实验证明,H+对Fe3+与苯酚反应生成的配合物有抑制作用,请从平衡角度结合化学用语进行解释___________ 。
(6)有同学提出,溶液pH越大,越利于铁离子与苯酚发生显色反应。你认为是否合理,并说明理由___________ 。
(7)由以上研究可知,影响铁离子与苯酚反应的因素有___________ 。
已知:Fe3++6C6H5O
 [Fe(C6H5O)6]3;[Fe(C6H5O)6]3为紫色配合物。
[Fe(C6H5O)6]3;[Fe(C6H5O)6]3为紫色配合物。(1)配制100mL0.1mol·L-1苯酚溶液,需要用到的玻璃仪器有:烧杯、玻璃棒、胶头滴管、
(2)氯化铁溶液呈
(3)[Fe(C6H5O)6]3中,提供空轨道用以形成配位键的微粒是
(4)进行如下实验。
实验1:

实验2:

【提出猜想】
i.Cl对铁离子与苯酚的反应有促进作用;
ii.SO
 对铁离子与苯酚的反应有抑制作用。
对铁离子与苯酚的反应有抑制作用。①向实验2反应后溶液中加入
②实验证明猜想ii成立,请写出实验操作和现象
(5)实验证明,H+对Fe3+与苯酚反应生成的配合物有抑制作用,请从平衡角度结合化学用语进行解释
(6)有同学提出,溶液pH越大,越利于铁离子与苯酚发生显色反应。你认为是否合理,并说明理由
(7)由以上研究可知,影响铁离子与苯酚反应的因素有
您最近半年使用:0次
9 . 下列方案设计、现象和结论都正确的是
| 实验方案 | 现象 | 结论 | |
| A | 检验铜和浓硫酸反应之后是否有酸剩余 | 取少量反应后的溶液于试管中,依次加入盐酸和BaCl2溶液 | 若出现白色沉淀,则硫酸剩余 |
| B | 探究淀粉在酸性条件下的水解程度 | 取少量淀粉溶液,加入适量稀硫酸加热5min后,再加NaOH中和硫酸,最后滴加碘水 | 溶液无明显现象,则淀粉完全水解 |
| C | 比较CH3COOH和HClO的酸性强弱 | 相同条件下分别用pH试纸测定0.1mol•L-1CH3COONa溶液、0.1mol•L-1NaClO溶液的pH | NaClO溶液pH>CH3COONa溶液的pH,证明CH3COOH的酸性比HClO的酸性强 |
| D | 探究浓度对化学平衡的影响 | 在4mL0.1mol•L-1K2Cr2O7溶液中加入数滴1mol•L-1NaOH溶液 | 若溶液由橙色变为黄色,则H+浓度减小,Cr2O +H2O +H2O 2CrO 2CrO +2H+平衡正移 +2H+平衡正移 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
10 . 某学习小组欲利用 平衡体系探究影响平衡的因素,将220 mL 0.005 mol⋅L
平衡体系探究影响平衡的因素,将220 mL 0.005 mol⋅L
 溶液和20 mL 0.015 mol⋅L
溶液和20 mL 0.015 mol⋅L KSCN溶液混合,得血红色溶液X,进行下列实验:
KSCN溶液混合,得血红色溶液X,进行下列实验:
实验Ⅰ.改变 、
、 、
、 、
、 等离子浓度对平衡的影响
等离子浓度对平衡的影响
(1)取2 mL溶液X,加入5滴0.01 mol⋅L KSCN溶液,溶液红色
KSCN溶液,溶液红色_______ (填“变深”、“变浅”或“不变”,下同);取2 mL溶液X,插入经砂纸打磨过的铁丝,溶液红色_______ 。基于上述两个实验可以得到的结论是_______ 。
(2)取2 mL溶液X,加入5滴0.03 mol⋅L KCl溶液,观察到溶液红色变浅,产生该现象的原因可能是
KCl溶液,观察到溶液红色变浅,产生该现象的原因可能是_______ 或者不直接参与平衡体系的 或
或 对平衡产生了影响。
对平衡产生了影响。
实验Ⅱ.探究KCl对 平衡体系的影响为了确定KCl是否对平衡产生影响,学习小组同学进行如下探究:各取2mL溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
平衡体系的影响为了确定KCl是否对平衡产生影响,学习小组同学进行如下探究:各取2mL溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
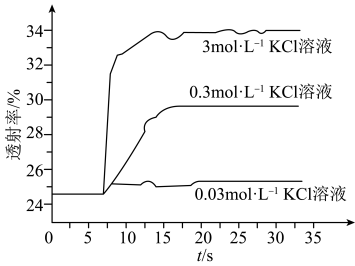
(3)上述实验可以得到以下结论:一是KCl对 平衡有影响,且KCl浓度越大,影响
平衡有影响,且KCl浓度越大,影响_______ 。二是_______ 。
(4)针对产生上述影响的可能原因,学习小组同学提出以下猜想:
猜想①: 产生的影响。
产生的影响。
猜想②: 产生的影响。
产生的影响。
猜想③:_______ 。
实验Ⅲ.探究盐对 和
和 平衡体系产生的影响
平衡体系产生的影响
资料信息:
a.溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
b.在 溶液中存在反应
溶液中存在反应 。
。
(5)根据上述信息,学习小组同学各取2 mL溶液X,分别加入5滴①去离子水、②0.3 mol⋅L KCl溶液、③0.3 mol⋅L
KCl溶液、③0.3 mol⋅L NaCl溶液、④0.3 mol⋅L
NaCl溶液、④0.3 mol⋅L
 溶液、⑤3 mol⋅L
溶液、⑤3 mol⋅L HCl溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
HCl溶液进行实验,测得各溶液的透射率随时间的变化如图所示。

上述实验能证明阳离子盐效应影响 平衡体系的实验组是
平衡体系的实验组是_______ 。盐效应影响较大的阳离子是_______ 。
A.实验①②③ B.实验①②④ C.实验①③④
(6)解释出现实验⑤现象的原因:_______ 。
 平衡体系探究影响平衡的因素,将220 mL 0.005 mol⋅L
平衡体系探究影响平衡的因素,将220 mL 0.005 mol⋅L
 溶液和20 mL 0.015 mol⋅L
溶液和20 mL 0.015 mol⋅L KSCN溶液混合,得血红色溶液X,进行下列实验:
KSCN溶液混合,得血红色溶液X,进行下列实验:实验Ⅰ.改变
 、
、 、
、 、
、 等离子浓度对平衡的影响
等离子浓度对平衡的影响(1)取2 mL溶液X,加入5滴0.01 mol⋅L
 KSCN溶液,溶液红色
KSCN溶液,溶液红色(2)取2 mL溶液X,加入5滴0.03 mol⋅L
 KCl溶液,观察到溶液红色变浅,产生该现象的原因可能是
KCl溶液,观察到溶液红色变浅,产生该现象的原因可能是 或
或 对平衡产生了影响。
对平衡产生了影响。实验Ⅱ.探究KCl对
 平衡体系的影响为了确定KCl是否对平衡产生影响,学习小组同学进行如下探究:各取2mL溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
平衡体系的影响为了确定KCl是否对平衡产生影响,学习小组同学进行如下探究:各取2mL溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
(3)上述实验可以得到以下结论:一是KCl对
 平衡有影响,且KCl浓度越大,影响
平衡有影响,且KCl浓度越大,影响(4)针对产生上述影响的可能原因,学习小组同学提出以下猜想:
猜想①:
 产生的影响。
产生的影响。猜想②:
 产生的影响。
产生的影响。猜想③:
实验Ⅲ.探究盐对
 和
和 平衡体系产生的影响
平衡体系产生的影响资料信息:
a.溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
b.在
 溶液中存在反应
溶液中存在反应 。
。(5)根据上述信息,学习小组同学各取2 mL溶液X,分别加入5滴①去离子水、②0.3 mol⋅L
 KCl溶液、③0.3 mol⋅L
KCl溶液、③0.3 mol⋅L NaCl溶液、④0.3 mol⋅L
NaCl溶液、④0.3 mol⋅L
 溶液、⑤3 mol⋅L
溶液、⑤3 mol⋅L HCl溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
HCl溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
上述实验能证明阳离子盐效应影响
 平衡体系的实验组是
平衡体系的实验组是A.实验①②③ B.实验①②④ C.实验①③④
(6)解释出现实验⑤现象的原因:
您最近半年使用:0次
2023-05-21更新
|
320次组卷
|
2卷引用:山东省泰安市2023届高三下学期三模化学试题

 溶液
溶液




