名校
解题方法
1 . 下列事实能用勒夏特列原理解释的是( )
| A.实验室常用排饱和食盐水法收集Cl2 |
| B.由H2、I2、HI三种气体组成的平衡体系加压后颜色变深 |
| C.煅烧粉碎的硫铁矿有利于SO2生成 |
| D.配制FeCl2溶液时加入少量铁屑 |
您最近一年使用:0次
2020-11-12更新
|
133次组卷
|
3卷引用:成都市实验外国语学校(西区)2020-2021学年高二上学期化学学科期中测试卷
名校
2 . 下列事实不能用勒夏特列原理(平衡移动原理)解释的是( )
①溴水中存在化学平衡:Br2+H2O HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
②铁在潮湿的空气中易生锈
③二氧化氮与四氧化二氮的平衡体系,增大压强后颜色加深
④合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
⑤钠与氯化钾共融制备钾:Na(l)+KCl(l) K(g)+NaCl(l)
K(g)+NaCl(l)
⑥反应CO(g)+NO2(g) CO2(g)+NO(g) ΔH<0,达到化学平衡后,升高温度体系的颜色加深
CO2(g)+NO(g) ΔH<0,达到化学平衡后,升高温度体系的颜色加深
①溴水中存在化学平衡:Br2+H2O
 HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅②铁在潮湿的空气中易生锈
③二氧化氮与四氧化二氮的平衡体系,增大压强后颜色加深
④合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
⑤钠与氯化钾共融制备钾:Na(l)+KCl(l)
 K(g)+NaCl(l)
K(g)+NaCl(l)⑥反应CO(g)+NO2(g)
 CO2(g)+NO(g) ΔH<0,达到化学平衡后,升高温度体系的颜色加深
CO2(g)+NO(g) ΔH<0,达到化学平衡后,升高温度体系的颜色加深| A.①④ | B.②⑥ | C.②③ | D.②③⑥ |
您最近一年使用:0次
2020-10-28更新
|
80次组卷
|
6卷引用:四川省成都市实验中学2018-2019学年高二上学期期中模拟考试化学试题
名校
3 . 一定条件下,通过下列反应可以制备特种陶瓷的原料 MgO, MgSO4(s) + CO(g) ⇌ MgO(s) + CO2(g) + SO2(g) ΔH > 0。该反应在恒容的密闭容器中达到平衡后(A 点),若仅改变图中横坐标 x 的值, 重新达到平衡后,纵坐标 y 随 x 变化趋势合理的是( )(忽略固体物质所占有的体积)
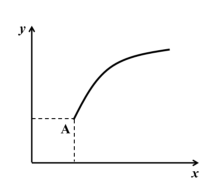

| A.x 为温度,y 为容器内混合气体的密度 |
| B.x 为 MgSO4的质量,y 为 CO 的平衡转化率 |
| C.x 为 CO2的物质的量,y 为 CO 的平衡转化率 |
| D.x 为 SO2的浓度,y 为 CO2的平衡浓度 |
您最近一年使用:0次
2020-10-28更新
|
347次组卷
|
4卷引用:四川省巴中市巴中中学、南江中学2021-2022学年高二上学期半期联考化学试题
名校
4 . 下列叙述及解释正确的是
A. 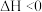 ,在达到平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅 ,在达到平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅 |
B. 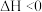 ,在达到平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变 ,在达到平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变 |
C. ,在达到平衡后,加少量 ,在达到平衡后,加少量 固体,因为平衡向逆反应方向移动,故体系颜色变浅 固体,因为平衡向逆反应方向移动,故体系颜色变浅 |
D.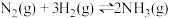 ,在达到平衡后,保持压强不变,充入 ,在达到平衡后,保持压强不变,充入 ,平衡向左移动 ,平衡向左移动 |
您最近一年使用:0次
2020-09-13更新
|
381次组卷
|
14卷引用:四川省成都市实验中学2018-2019学年高二上学期期中模拟考试化学试题
四川省成都市实验中学2018-2019学年高二上学期期中模拟考试化学试题内蒙古包头市第四中学2021-2022学年高二上学期期中考试化学试题【全国百强校】天津市静海县第一中学2018-2019学年高二上学期9月学生学业能力调研化学试题黑龙江省齐齐哈尔市第八中学2018-2019学年高二上学期9月月考化学试题吉林省通化市梅河口市博文学校2019-2020学年高二上学期第一次月考化学试题天津市静海区第一中学2020届高三下学期第六周周末训练化学试题河南省鹤壁市高级中学2020-2021学年高二上学期阶段性检测(一)化学试题鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2节 化学反应的限度 课时2 反应条件对化学平衡的影响高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时3 影响化学平衡的因素(已下线)2.3.2影响化学平衡状态的因素(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)湖南省衡阳市第八中学2020-2021学年高二上学期10月月考化学试题辽宁省沈阳市法库县高级中学2020-2021学年高二9月月考化学试题河南省洛阳市第三中学东城校区2020-2021学年高二9月月考化学试题山东省山大附中卧龙学校2021-2022学年高二上学期第一次月考化学试题
5 . 已知 呈粉红色,
呈粉红色, 呈蓝色,
呈蓝色,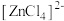 为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下:
 呈粉红色,
呈粉红色, 呈蓝色,
呈蓝色,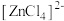 为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下:
A.等物质的量的 和 和 中σ键数之比为3:2 中σ键数之比为3:2 |
| B.由实验①可推知△H<0 |
| C.实验②是由于c(H2O)增大,导致平衡逆向移动 |
D.由实验③可知配离子的稳定性: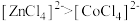 |
您最近一年使用:0次
2020-07-11更新
|
5788次组卷
|
30卷引用:四川省巴中市恩阳区2022-2023学年高二下学期4月期中考试化学试题
四川省巴中市恩阳区2022-2023学年高二下学期4月期中考试化学试题四川省遂宁市2020-2021学年高二上学期期末教学水平监测化学试题江苏省盐城市阜宁中学2020-2021学年高二下学期期中考试化学试题福建省三明市教研联盟2021-2022学年高二下学期期中联考化学试题2020年天津卷化学高考试题(已下线)专题09 反应速率、化学平衡-2020年高考真题和模拟题化学分项汇编(已下线)小题必刷28 化学平衡及平衡移动——2021年高考化学一轮复习小题必刷(通用版本)(已下线)专题06 化学反应速率和化学平衡——备战2021年高考化学纠错笔记(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)热点8 无机化工流程分析(选择题)-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)课时36 化学平衡及平衡移动-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第十一单元 物质结构与性质(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)2020年天津卷化学高考真题变式题1-12福建省龙岩第一中学2021-2022学年高二下学期第一次月考化学试题北京市第二十二中学2021-2022学年高三上学期12月阶段性测试理科化学试题(已下线)卷14 物质结构与性质选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)黑龙江省牡丹江市第一高级中学2021-2022学年高二下学期4月月考化学试题(已下线)专题9 平衡移动专练天津市2023届高三上学期第一次模拟测试化学试题新疆石河子第一中学2021-2022学年高二4月月考化学试题河北省邯郸市第一中学2022-2023学年高三上学期一轮复习(四)化学试题甘肃省张掖市高台县第一中学2022-2023学年高二下学期5月月考化学试题广东省广州市执信中学2023-2024学年高三上学期开学考试化学试题(已下线)第7讲 配合物与超分子江苏省海安高级中学2023-2024学年高二上学期第一次考试化学试题广东省广州市执信中学2023-2024学年高三上学期 开学化学试卷山东省滨州市阳信县第一中学2023-2024学年高二上学期第三次月考化学试题
名校
6 . 已知K2Cr2O7溶液中存在平衡: +H2O
+H2O 2
2 +2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
+2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
Ⅰ.方案讨论
(1)ⅰ~ⅴ中依据减少生成物浓度可导致平衡移动的原理设计的是_____ (填序号)。
(2)已知BaCrO4为黄色沉淀。某同学认为试剂X还可设计为Ba(NO3)2溶液,加入该试剂后,溶液颜色将_____ 。(填“变深”、“变浅”或“不变”)。
Ⅱ.实验分析
(1)实验ⅰ没有观察到预期现象的原因是_____ ,实验ⅱ的原因与其相似。
(2)通过实验ⅲ和ⅴ得出的结论为_____ 。
(3)实验ⅳ无明显现象,可能的原因是____________ 。
(4)某同学查阅资料发现:K2Cr2O7溶液与浓盐酸可发生氧化还原反应。但实验ⅳ中没有观察到明显现象,小组同学设计了下实验,验证了该反应的发生。
方案:取5 mL浓盐酸,向其中加入15滴0.1mol·L-1 K2Cr2O7溶液,一段时间后,溶液变为绿色(CrCl3水溶液呈绿色),有黄绿色气体生成。写出该变化的化学方程式______ 。
 +H2O
+H2O 2
2 +2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
+2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。 5mL0.1mol/LK2Cr2O7溶液 | 序号 | 试剂X |
| ⅰ | 1mL1mol·L-1 K2Cr2O7溶液 | |
| ⅱ | 1mL1 mol·L-1 K2CrO4溶液 | |
| ⅲ | 5~15滴浓硫酸 | |
| ⅳ | 5~15滴浓盐酸 | |
| ⅴ | 5~15滴6 mol·L-1 NaOH溶液 |
(1)ⅰ~ⅴ中依据减少生成物浓度可导致平衡移动的原理设计的是
(2)已知BaCrO4为黄色沉淀。某同学认为试剂X还可设计为Ba(NO3)2溶液,加入该试剂后,溶液颜色将
Ⅱ.实验分析
| 序号 | 试剂X | 预期现象 | 实际现象 |
| ⅰ | 1 mL1 mol·L-1 K2Cr2O7溶液 | 溶液变黄 | 溶液橙色加深 |
| ⅱ | 1mL1 mol·L-1 K2CrO4溶液 | 溶液橙色加深 | 溶液颜色变浅 |
| ⅲ | 5~15滴浓硫酸 | 溶液橙色加深 | 溶液橙色加深 |
| ⅳ | 5~15滴浓盐酸 | 溶液橙色加深 | 无明显现象 |
| ⅴ | 5~15滴6mol·L-1NaOH溶液 | 溶液变黄 | 溶液变黄 |
(2)通过实验ⅲ和ⅴ得出的结论为
(3)实验ⅳ无明显现象,可能的原因是
(4)某同学查阅资料发现:K2Cr2O7溶液与浓盐酸可发生氧化还原反应。但实验ⅳ中没有观察到明显现象,小组同学设计了下实验,验证了该反应的发生。
方案:取5 mL浓盐酸,向其中加入15滴0.1mol·L-1 K2Cr2O7溶液,一段时间后,溶液变为绿色(CrCl3水溶液呈绿色),有黄绿色气体生成。写出该变化的化学方程式
您最近一年使用:0次
名校
7 . 常温常压下,O3溶于水产生的游离氧原子[O]有很强的杀菌消毒能力,发生的反应如下:( )
反应①:O3 O2+[O] ΔH>0 平衡常数为K1
O2+[O] ΔH>0 平衡常数为K1
反应②:[O]+O3 2O2 ΔH<0 平衡常数为K2
2O2 ΔH<0 平衡常数为K2
总反应:2O3 3O2 ΔH<0 平衡常数为K
3O2 ΔH<0 平衡常数为K
下列叙述正确的是
反应①:O3
 O2+[O] ΔH>0 平衡常数为K1
O2+[O] ΔH>0 平衡常数为K1反应②:[O]+O3
 2O2 ΔH<0 平衡常数为K2
2O2 ΔH<0 平衡常数为K2总反应:2O3
 3O2 ΔH<0 平衡常数为K
3O2 ΔH<0 平衡常数为K下列叙述正确的是
| A.降低温度,K减小 | B.K=K1+K2 |
| C.增大压强,K2减小 | D.适当升温,可提高消毒效率 |
您最近一年使用:0次
2020-02-21更新
|
319次组卷
|
12卷引用:【全国百强校】四川省成都市第七中学2018-2019学年高二上学期半期考试化学试题
【全国百强校】四川省成都市第七中学2018-2019学年高二上学期半期考试化学试题广东省广州市第八十九中学2020-2021学年高二上学期期中考试化学试题07-2023新东方高二上期中考化学江西省宜春市上高二中2017-2018学年高二第一次月考化学试题【全国百强校】山西省太原市第五中学2018-2019学年高二(理)上学期10月月考化学试题【市级联考】广东省清远市2018-2019学年高二第一学期期末质量检测化学试题【全国百强校】黑龙江省大庆市第一中学2018-2019学年高二下学期开学检测化学试题江西省南昌市新建县第一中学2019-2020学年高二上学期第一次月考化学试题福建三明市2020届高三毕业班第一次教学质量检测卷化学试题(已下线)考点10 化学平衡常数及其图象分析-2020年高考化学命题预测与模拟试题分类精编河南省豫南九校2020-2021学年高二上学期第二次联考化学试题(已下线)课时37 化学平衡常数-2022年高考化学一轮复习小题多维练(全国通用)
解题方法
8 . Ⅰ.在水溶液中橙色的Cr2O72—与黄色的CrO42—有下列平衡关系:Cr2O72—+H2O 2CrO42—+2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。
2CrO42—+2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。
(1)向上述溶液中加入NaOH溶液,溶液呈________ 色,因为_________________ 。
(2)向已加入NaOH溶液的(1)溶液中再加入过量稀硫酸,则溶液呈_____ 色,因为________ 。
Ⅱ.现有浓度均为0.1 mol/L的盐酸、硫酸、醋酸三种溶液,回答下列问题:
(1)若三种溶液中c(H+)分别为x1 mol/L、x2 mol/L、x3 mol/L,则它们的大小关系为_______ 。
(2)等体积的以上三种酸分别与过量的NaOH溶液反应,消耗NaOH的物质的量依次为y1 mol、y2 mol、y3 mol,则它们的大小关系为______ 。
(3)在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况图所示,回答下列问题。
①a、b、c三点醋酸电离程度由大到小的顺序为____ ;a、b、c三点对应的溶液中c(H+)最大的是_____ 。
②若实验测得c点处溶液中c(CH3COOH)=0.01 mol·L-1,c(CH3COO-)=0.0001 mol·L-1,则该条件下CH3COOH的电离常数Ka=____ 。
③在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是( ) 。
A.c(H+) B.溶液pH C. D. CH3COOH分子数
D. CH3COOH分子数
 2CrO42—+2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。
2CrO42—+2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。(1)向上述溶液中加入NaOH溶液,溶液呈
(2)向已加入NaOH溶液的(1)溶液中再加入过量稀硫酸,则溶液呈
Ⅱ.现有浓度均为0.1 mol/L的盐酸、硫酸、醋酸三种溶液,回答下列问题:
(1)若三种溶液中c(H+)分别为x1 mol/L、x2 mol/L、x3 mol/L,则它们的大小关系为
(2)等体积的以上三种酸分别与过量的NaOH溶液反应,消耗NaOH的物质的量依次为y1 mol、y2 mol、y3 mol,则它们的大小关系为
(3)在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况图所示,回答下列问题。

①a、b、c三点醋酸电离程度由大到小的顺序为
②若实验测得c点处溶液中c(CH3COOH)=0.01 mol·L-1,c(CH3COO-)=0.0001 mol·L-1,则该条件下CH3COOH的电离常数Ka=
③在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是
A.c(H+) B.溶液pH C.
 D. CH3COOH分子数
D. CH3COOH分子数
您最近一年使用:0次
2019-12-10更新
|
111次组卷
|
2卷引用:四川省广元川师大万达中学2019-2020学年高二上学期期中考试化学试题
9 . 一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1 mol O2,发生下列反应:2SO2(g)+O2(g) 2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度
2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变 的是()
 2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度
2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度| A.保持温度和容器体积不变,充入2 mol SO3(g) |
| B.保持温度和容器内压强不变,充入2 mol SO2(g) |
| C.保持温度和容器内压强不变,充入1 mol O2(g) |
| D.保持温度和容器体积不变,充入1 mol N2(g) |
您最近一年使用:0次
真题
名校
10 . 在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s) 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
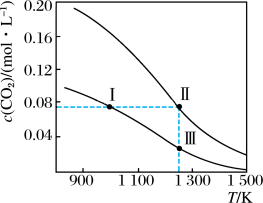
 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
A.反应CO2(g)+C(s)  2CO(g)的ΔS>0、ΔH<0 2CO(g)的ΔS>0、ΔH<0 |
| B.体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ) |
| C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) |
| D.逆反应速率:v逆(状态Ⅰ)>v逆(状态Ⅲ) |
您最近一年使用:0次
2019-11-21更新
|
1545次组卷
|
35卷引用:四川省成都外国语学校2019-2020学年高二上学期期中考试化学试题
四川省成都外国语学校2019-2020学年高二上学期期中考试化学试题2015-2016学年广东省宝安第一外国语学校高二上期中考试化学试卷2015-2016学年安徽省蚌埠二中高二下学期期中化学试卷2016-2017学年河北省冀州中学高二上期中化学卷2016-2017学年四川省成都七中高二上11月考试化学卷黑龙江省哈尔滨市第六中学2017-2018学年高二上学期期中考试(理)化学试题安徽师范大学附属中学2017-2018学年高二上学期期中考查化学试题江西省南昌市第二中学2017-2018学年高二上学期期中考试化学试题江西省南昌二中2017-2018学年高二上学期期中考试化学试卷江西省宁都中学2018-2019学年高二上学期期中考试化学试题【全国百强校】四川省成都市成都外国语学校2018-2019学年高二上学期12月月考化学试题黑龙江省哈尔滨师范大学附属中学2019-2020学年高二上学期期中考试化学试题山西大学附属中学2020-2021学年高二上学期期中考试化学试题江西省崇义中学2020-2021学年高一上学期期中考试(A卷)化学试题山东省青岛第二中学2020-2021学年高二上学期期中考试化学试题2015年全国普通高等学校招生统一考试理科综合能力测试化学(江苏卷)陕西省西安市第一中学2015-2016学年高二上12月月考化学试卷2016届河北省衡水市冀州中学高三上一轮复习检测二化学试卷2015-2016学年江苏省南通中学高二上学期期末化学试卷2015-2016学年山东省淄博六中高二上学期期末化学试卷2016-2017学年河北省邢台一中高二上月考二化学卷安徽师范大学附属中学2017-2018学年高二上学期10月月考化学试题河南省南阳市第一中学2017-2018学年高二上学期第二次月考化学试题内蒙古杭锦后旗奋斗中学2017-2018学年高二下学期第一次月考化学试题(已下线)2019高考备考二轮复习精品资料-专题9 化学反应速率与化学平衡(教学案)(已下线)2019年高考总复习巅峰冲刺-专题06 化学反应速率、化学平衡问题应试策略江西省高安中学2019-2020学年高二上学期期末考试化学(A卷)试题安徽省滁州市民办高中2019-2020学年高二上学期期末考试化学试题江西省高安中学2019-2020学年高二上学期期末考试化学(B卷)试题(已下线)专题九 化学能与热能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训河北省石家庄市第二中学2020届高中毕业班四月份教学质量监测卷理科综合化学部分河南省漯河市临颍县南街高级中学2019-2020学年高二下学期期末考试化学试题浙江省绍兴市柯桥区2021届高三下学期6月选考科目考试化学试题(已下线)专题17 化学平衡图表分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)专题15 化学平衡图像-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)



