名校
1 . 某同学在实验室进行铁盐与亚铁盐相互转化实验。
实验Ⅰ:将Fe3+转化为Fe2+
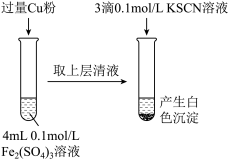
(1)Fe3+与Cu粉发生反应的离子方程式为_________________________________ 。
(2)某学生用对比实验法探究白色沉淀产生的原因,请填写实验万案:
查阅资料:
已知①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
Cu2+与SCN-反应的离子方程式为③___________________________________ 。
实验Ⅱ:将Fe2+转化为Fe3+
探究上述现象出现的原因:
查阅资料:Fe2++NO Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因___________________________________ 。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应;反应Ⅱ:Fe2+与NO反应
①反应Ⅰ是一个不可逆反应,设计实验方案加以证明_____________________________ 。
②请用化学平衡移动原理解释溶液由棕色变为黄色的原因_____________________________ 。
实验Ⅰ:将Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为
(2)某学生用对比实验法探究白色沉淀产生的原因,请填写实验万案:
| 实验方案 | 现象 | 结论 |
| 步骤1:取4mL① | 产生白色沉淀 | CuSO4溶液与KSCN溶液反应产生了白色沉淀 |
| 步骤2:取4mL② | 无明显现象 |
查阅资料:
已知①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
Cu2+与SCN-反应的离子方程式为③
实验Ⅱ:将Fe2+转化为Fe3+
| 实验方案 | 现象 |
| 向3mL0.1mol/LFeSO4溶液中加入 3mL0.5mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO
 Fe(NO)2+(棕色)
Fe(NO)2+(棕色)(3)用离子方程式解释NO产生的原因
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应;反应Ⅱ:Fe2+与NO反应
①反应Ⅰ是一个不可逆反应,设计实验方案加以证明
②请用化学平衡移动原理解释溶液由棕色变为黄色的原因
您最近一年使用:0次
2018-04-25更新
|
400次组卷
|
4卷引用:【全国校级联考】湖北省襄阳市四校(襄州一中、枣阳一中、宜城一中、曾都一中)2017-2018学年高二下学期期中联考化学试题
2018高三下·江苏·专题练习
2 . 臭氧是地球大气中一种微量气体,人类正在保护和利用臭氧。
(1)氮氧化物会破坏臭氧层,已知:
①NO(g) + O3(g) NO2(g) + O2(g) ΔH1 = −200.9 kJ·mol−1
NO2(g) + O2(g) ΔH1 = −200.9 kJ·mol−1
②2NO(g) +O2(g) 2NO2(g) ΔH 2 = −116.2 kJ·mol−1
2NO2(g) ΔH 2 = −116.2 kJ·mol−1
则反应:2O3(g) 3O2(g) ΔH=
3O2(g) ΔH=______ 。
(2)实验室将氧气和臭氧的混合气体0.896 L(标准状况)通入盛有20.0 g铜粉的反应器中,加热充分反应后,粉末的质量变为21.6 g。则原混合气中臭氧的体积分数为______ 。
(3)大气中的部分碘源于O3对海水中I−的氧化。将O3持续通入NaI溶液中进行模拟研究,探究Fe2+对氧化I−反应的影响,反应体系如图1,测定两组实验中 浓度实验的数据如图2所示:
浓度实验的数据如图2所示:

①反应后的溶液中存在化学平衡:I2(aq)+I−(aq)
 (aq),当
(aq),当 =6.8时,溶液中c(I2)=
=6.8时,溶液中c(I2)=______ 。(已知反应的平衡常数K=680)
②结合实验数据可知,Fe2+对I−的转化率的影响是______ (填“增大”“无影响”或“减小”)。
③第二组实验18 s后, 浓度下降。导致
浓度下降。导致 浓度下降的原因是
浓度下降的原因是______ 。
(4)臭氧是一种杀菌消毒剂,还是理想的烟气脱硝剂。
①一种脱硝反应中,各物质的物质的量随时间的变化如图Ⅰ所示,X为______ (填化学式)。
②一种臭氧发生装置原理如图Ⅱ所示。阳极(惰性电极)的电极反应式为______ 。

(1)氮氧化物会破坏臭氧层,已知:
①NO(g) + O3(g)
 NO2(g) + O2(g) ΔH1 = −200.9 kJ·mol−1
NO2(g) + O2(g) ΔH1 = −200.9 kJ·mol−1 ②2NO(g) +O2(g)
 2NO2(g) ΔH 2 = −116.2 kJ·mol−1
2NO2(g) ΔH 2 = −116.2 kJ·mol−1则反应:2O3(g)
 3O2(g) ΔH=
3O2(g) ΔH=(2)实验室将氧气和臭氧的混合气体0.896 L(标准状况)通入盛有20.0 g铜粉的反应器中,加热充分反应后,粉末的质量变为21.6 g。则原混合气中臭氧的体积分数为
(3)大气中的部分碘源于O3对海水中I−的氧化。将O3持续通入NaI溶液中进行模拟研究,探究Fe2+对氧化I−反应的影响,反应体系如图1,测定两组实验中
 浓度实验的数据如图2所示:
浓度实验的数据如图2所示:
①反应后的溶液中存在化学平衡:I2(aq)+I−(aq)

 (aq),当
(aq),当 =6.8时,溶液中c(I2)=
=6.8时,溶液中c(I2)=②结合实验数据可知,Fe2+对I−的转化率的影响是
③第二组实验18 s后,
 浓度下降。导致
浓度下降。导致 浓度下降的原因是
浓度下降的原因是(4)臭氧是一种杀菌消毒剂,还是理想的烟气脱硝剂。
①一种脱硝反应中,各物质的物质的量随时间的变化如图Ⅰ所示,X为
②一种臭氧发生装置原理如图Ⅱ所示。阳极(惰性电极)的电极反应式为

您最近一年使用:0次
3 . 海洋是资源的宝库。占地球上储量99%的溴分步在海洋中,我国目前是从食盐化工的尾料中提取溴,反应原理是:Cl2+2Br-→2Cl-+Br2。
(1)氯原子最外层电子轨道表示式是______________ ,氯气属于________ 分子(填写“极性”或“非极性”)。
(2)已知溴水中存在如下化学平衡:Br2+H2O H++Br-+HBrO。取少量溴水于一支试管中,向试管中滴加氢氧化钠溶液,溶液颜色变浅。请用平衡移动的观点解释颜色变浅的原因
H++Br-+HBrO。取少量溴水于一支试管中,向试管中滴加氢氧化钠溶液,溶液颜色变浅。请用平衡移动的观点解释颜色变浅的原因_____________ 。
(3)氟和溴都属于卤族元素,HF和地壳内SiO2存在以下平衡:4HF(g)+ SiO2(s) SiF4(g)+2H2O(g)+148.9kJ。该反应的平衡常数表达式K=
SiF4(g)+2H2O(g)+148.9kJ。该反应的平衡常数表达式K=_________________ 。如果上述反应达到平衡后,降低温度,该反应会_____________ (填写“向正反应方向移动”或“向逆反应方向移动”),在平衡移动时逆反应速率先_______ 后_______ (填写“增大”或“减小”)。
(4)若反应的容器容积为2.0 L,反应时间8.0min,容器内气体的质量增加了0.24g,在这段时间内HF的平均反应速率为_____________________ 。
(1)氯原子最外层电子轨道表示式是
(2)已知溴水中存在如下化学平衡:Br2+H2O
 H++Br-+HBrO。取少量溴水于一支试管中,向试管中滴加氢氧化钠溶液,溶液颜色变浅。请用平衡移动的观点解释颜色变浅的原因
H++Br-+HBrO。取少量溴水于一支试管中,向试管中滴加氢氧化钠溶液,溶液颜色变浅。请用平衡移动的观点解释颜色变浅的原因(3)氟和溴都属于卤族元素,HF和地壳内SiO2存在以下平衡:4HF(g)+ SiO2(s)
 SiF4(g)+2H2O(g)+148.9kJ。该反应的平衡常数表达式K=
SiF4(g)+2H2O(g)+148.9kJ。该反应的平衡常数表达式K=(4)若反应的容器容积为2.0 L,反应时间8.0min,容器内气体的质量增加了0.24g,在这段时间内HF的平均反应速率为
您最近一年使用:0次
4 . 研究+6价铬盐不同条件下微粒存在形式及氧化性,某小组同学进行如下实验:
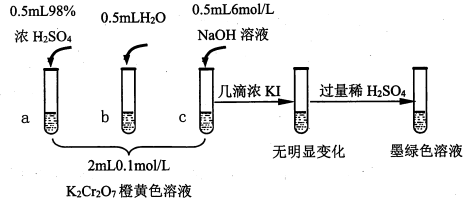
已知:Cr2O (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(1)试管c和b对比,推测试管c的现象是________ 。
(2)试管a和b对比,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。你认为是否需要再设计实验证明?____ (“是”或“否”),理由是_________________________________ 。
(3)对比试管a、b、c的实验现象,得到的结论是________________ 。
(4)试管c继续滴加KI溶液、过量稀H2SO4,分析上图的实验现象,得出的结论是_______ ;写出此过程中氧化还原反应的离子方程式________________ 。
(5)小组同学用电解法处理含Cr2O 废水,探究不同因素对含Cr2O
废水,探究不同因素对含Cr2O 废水处理的影响,结果如下表所示(Cr2O
废水处理的影响,结果如下表所示(Cr2O 的起始浓度,体积、电压、电解时间均相同)。
的起始浓度,体积、电压、电解时间均相同)。
①实验ⅱ中Cr2O 放电的电极反应式是
放电的电极反应式是________________ 。
②实验ⅲ中Fe3+去除Cr2O 的机理如图所示,结合此机理,解释实验iv中Cr2O
的机理如图所示,结合此机理,解释实验iv中Cr2O 去除率提高较多的原因
去除率提高较多的原因_______________ 。


已知:Cr2O
 (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。(1)试管c和b对比,推测试管c的现象是
(2)试管a和b对比,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。你认为是否需要再设计实验证明?
(3)对比试管a、b、c的实验现象,得到的结论是
(4)试管c继续滴加KI溶液、过量稀H2SO4,分析上图的实验现象,得出的结论是
(5)小组同学用电解法处理含Cr2O
 废水,探究不同因素对含Cr2O
废水,探究不同因素对含Cr2O 废水处理的影响,结果如下表所示(Cr2O
废水处理的影响,结果如下表所示(Cr2O 的起始浓度,体积、电压、电解时间均相同)。
的起始浓度,体积、电压、电解时间均相同)。| 实验 | ⅰ | ⅱ | ⅲ | ⅳ |
| 是否加入Fe2(SO4)3 | 否 | 否 | 加入5g | 否 |
| 是否加入H2SO4 | 否 | 加入1mL | 加入1mL | 加入1mL |
| 电极材料 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴极为石墨,阳极为铁 |
Cr2O 的去除率/% 的去除率/% | 0.922 | 12.7 | 20.8 | 57.3 |
 放电的电极反应式是
放电的电极反应式是②实验ⅲ中Fe3+去除Cr2O
 的机理如图所示,结合此机理,解释实验iv中Cr2O
的机理如图所示,结合此机理,解释实验iv中Cr2O 去除率提高较多的原因
去除率提高较多的原因
您最近一年使用:0次
2018-04-01更新
|
644次组卷
|
3卷引用:北京市石景山区2018届高三3月统一测试(一模)理综化学试题
名校
解题方法
5 . 金属钒被誉为“合金的维生素”。从废钒(主要成分为V2O5、Fe2O3、SiO2等)中回收V2O5的一种工艺流程如下图所示:

已知:
步骤②、③中的变化过程可简化为:Rn+(水层)+nHA(有机层) RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
回答下列问题:
(1)步骤酸浸过程中发生氧化还原反应的化学方程式为______________________ 。
(2)萃取时应加入适量碱的作用是___________________ 。
(3)步骤④中反应的离子方程式为___________________ 。
(4)步骤⑤加入氨水调节溶液pH=2,钒沉淀率达到93%且不产生Fe(OH)3沉淀,则此时溶液中c(Fe3+)<_____ mol/L(按25℃计算,25℃时Ksp[Fe(OH)3]=2.6×10-39)。所得NH4VO3为离子化合物,NH4+的电子式为_______ 。
(5)V2O5是两性氧化物,在强酸性溶液中以VO2+形式存在,VO2+具有强氧化性,能将I-氧化为I2,本身被还原为VO+,则V2O5与氢碘酸反应的离子方程式为_________________ 。
(6)为提高钒的回收率,步骤②和③需多次进行,假设酸浸所得“强酸性浸出液”中c(VO2+)=amol/L,步骤②和③每进行一次,VO2+萃取率为80%,4次操作后,“强酸性浸出液中”c(VO2+)=_______ mol/L(萃取的量=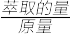 ×100%)
×100%)

已知:
步骤②、③中的变化过程可简化为:Rn+(水层)+nHA(有机层)
 RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)回答下列问题:
(1)步骤酸浸过程中发生氧化还原反应的化学方程式为
(2)萃取时应加入适量碱的作用是
(3)步骤④中反应的离子方程式为
(4)步骤⑤加入氨水调节溶液pH=2,钒沉淀率达到93%且不产生Fe(OH)3沉淀,则此时溶液中c(Fe3+)<
(5)V2O5是两性氧化物,在强酸性溶液中以VO2+形式存在,VO2+具有强氧化性,能将I-氧化为I2,本身被还原为VO+,则V2O5与氢碘酸反应的离子方程式为
(6)为提高钒的回收率,步骤②和③需多次进行,假设酸浸所得“强酸性浸出液”中c(VO2+)=amol/L,步骤②和③每进行一次,VO2+萃取率为80%,4次操作后,“强酸性浸出液中”c(VO2+)=
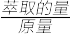 ×100%)
×100%)
您最近一年使用:0次
2018-03-20更新
|
586次组卷
|
4卷引用:山东省潍坊市2018届高三下学期一模考试理综化学试题
名校
6 . 某兴趣小组以重铬酸钾(K2Cr2O7)溶液为研究对象,结合所学反应原理的知识改变条件使其发生“色彩变幻”。
已知:①K2Cr2O7溶液存在平衡:Cr2O +H2O
+H2O 2CrO
2CrO +2H+。
+2H+。
②含铬元素的离子在溶液中的颜色:Cr2O (橙色);CrO
(橙色);CrO (黄色);Cr3+(绿色)。
(黄色);Cr3+(绿色)。
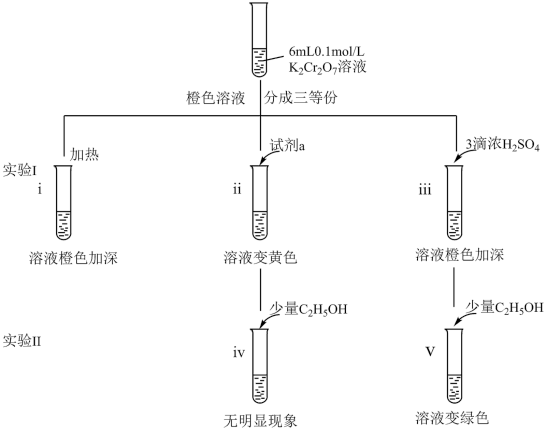
(1)i可证明反应Cr2O +H2O
+H2O 2CrO
2CrO +2H+的正反应是
+2H+的正反应是__________ (填“吸热”或“放热”)。
(2)ii是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是_________ 。
(3)iii的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验是否能达到预期目的________ (填“能”或“不能”),理由是____________ 。
(4)根据实验Ⅱ中不同现象,可以得出的结论是__________ 。
(5)继续实验
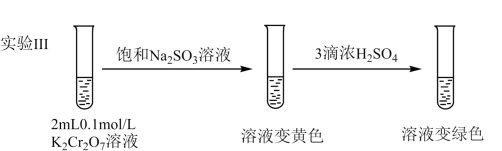
①解释溶液变黄的主要原因是________ 。
②溶液变绿色,该反应的离子方程式是_____________ 。
已知:①K2Cr2O7溶液存在平衡:Cr2O
 +H2O
+H2O 2CrO
2CrO +2H+。
+2H+。②含铬元素的离子在溶液中的颜色:Cr2O
 (橙色);CrO
(橙色);CrO (黄色);Cr3+(绿色)。
(黄色);Cr3+(绿色)。
(1)i可证明反应Cr2O
 +H2O
+H2O 2CrO
2CrO +2H+的正反应是
+2H+的正反应是(2)ii是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是
(3)iii的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验是否能达到预期目的
(4)根据实验Ⅱ中不同现象,可以得出的结论是
(5)继续实验

①解释溶液变黄的主要原因是
②溶液变绿色,该反应的离子方程式是
您最近一年使用:0次
2018-03-02更新
|
574次组卷
|
11卷引用:北京市东城区2016-2017学年高二下学期期末考试化学试题
北京市东城区2016-2017学年高二下学期期末考试化学试题重庆市南岸区2019-2020学年高二上学期期末学业质量调研抽测化学试题云南省玉溪澄江市第一中学2021-2022学年下学期高二开学考试化学试题天津市静海区第一中学2021-2022学年高三上学期12月调研考试化学试题云南省瑞丽市第一民族中学2021-2022学年高二下学期2月份开学测试化学试题北京市第四中学顺义分校2021-2022学年高二上学期期中考试化学试题黑龙江省双鸭山市第一中学2022-2023学年高二10月月考化学试题天津市静海区第一中学2020-2021学年高三下学期第三次模拟考试化学试题云南省昌宁县第一中学2022-2023学年高二下学期期末考试化学试题黑龙江省佳木斯市第一中学2023-2024学年高二上学期10月月考化学试题广东省广州市广雅集团2023-2024学年高二上学期11月期中考试化学试题
7 . 氯化亚砜用于医药、农药、染料工业,常作氯化剂,制锂氯化亚砜(Li/SOCl2)电池.用SO2、SCl2与Cl2反应合成SO2(g)+Cl2(g)+SCl2(g)⇌2SOCl2(g).
(1)在373K时,向2L的密闭容器中通入SO2、SCl2与Cl2均为0.04mol,发生上述反应.测得其压强(p)随时间(t)的变化为表中数据I(反应达到平衡时的温度与起始温度相同).
请回答下列问题:
①反应开始至达到平衡时,v(SOCl2)=____________ 。
②若只改变某一条件,其他条件相同时,测得其压强随时间的变化为表中数据II,则改变的条件是_____ 。
(2)如图是某同学测定上述反应平衡常数的对数值(lgK)与温度的变化关系点.

A点的数值为_____ 。(已知:lg4=0.6)
(3)已知反应S4(g)+4Cl2(g)═4SCl2(g) 的△H=﹣4kJ•mol﹣1,1molS4(g)、1molSCl2(g)分子中化学键断裂时分别需要吸收1064kJ、510kJ的能量,则1molCl2(g)分子中化学键断裂时需吸收的能量为_____ kJ。
(4)某种锂电池的负极由金属锂构成,正极由二氯亚砜(SOCl2)和碳材料构成.总反应为:4Li+2SOCl2═4LiCl+S+SO2↑,此种锂电池是一次电池,在放电时有气体产生.此电池工作时正极的电极反应式为________________ ,电解质中锂离子定向移向_____ 极(填“正极”或“负极”).
(1)在373K时,向2L的密闭容器中通入SO2、SCl2与Cl2均为0.04mol,发生上述反应.测得其压强(p)随时间(t)的变化为表中数据I(反应达到平衡时的温度与起始温度相同).
| t/min | 0 | 1 | 2 | 3 | 4 | 5 | |
| I | p | 6.0p0 | 6.7p0 | 6.1p0 | 5.4p0 | 5.0p0 | 5.0p0 |
| II | p | 6.0p0 | 7.0p0 | 5.3p0 | 5.0p0 | 5.0p0 | 5.0p0 |
请回答下列问题:
①反应开始至达到平衡时,v(SOCl2)=
②若只改变某一条件,其他条件相同时,测得其压强随时间的变化为表中数据II,则改变的条件是
(2)如图是某同学测定上述反应平衡常数的对数值(lgK)与温度的变化关系点.

A点的数值为
(3)已知反应S4(g)+4Cl2(g)═4SCl2(g) 的△H=﹣4kJ•mol﹣1,1molS4(g)、1molSCl2(g)分子中化学键断裂时分别需要吸收1064kJ、510kJ的能量,则1molCl2(g)分子中化学键断裂时需吸收的能量为
(4)某种锂电池的负极由金属锂构成,正极由二氯亚砜(SOCl2)和碳材料构成.总反应为:4Li+2SOCl2═4LiCl+S+SO2↑,此种锂电池是一次电池,在放电时有气体产生.此电池工作时正极的电极反应式为
您最近一年使用:0次
名校
8 . 氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)根据下图提供的信息,写出该反应的热化学方程式
_____________________________________________ ,
下图的曲线中____________ (填“a” 或“b”)表示 加入铁触媒(催化剂)的能量变化曲线。
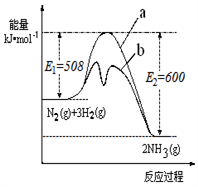
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是_________________ 。
A.3υ(H2)正=2υ(NH3)逆
B.单位时间内生成n mol N2的同时生成2n molNH3
C.容器内气体的密度不随时间的变化而变化
D.容器内压强不随时间的变化而变化
(3)为了寻找合成NH3的适宜条件,某同学设计了三组实验(如下表),请在下表空格处填入相应的实验条件及数据。
(4)合成氨的原料气氢气制备时其中一步反应: H2O(g)+CO(g) CO2(g)+H2(g),在850 ℃时,其平衡常数K=1。若850 ℃时向体积为1 L的恒容密闭容器中,同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2,5.0 mol H2,此时反应向
CO2(g)+H2(g),在850 ℃时,其平衡常数K=1。若850 ℃时向体积为1 L的恒容密闭容器中,同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2,5.0 mol H2,此时反应向____________ (填“正反应”或“逆反应”)方向进行,平衡时CO2的物质的量为______________ 。
(1)根据下图提供的信息,写出该反应的热化学方程式
下图的曲线中

(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是
A.3υ(H2)正=2υ(NH3)逆
B.单位时间内生成n mol N2的同时生成2n molNH3
C.容器内气体的密度不随时间的变化而变化
D.容器内压强不随时间的变化而变化
(3)为了寻找合成NH3的适宜条件,某同学设计了三组实验(如下表),请在下表空格处填入相应的实验条件及数据。
实验编号 | T(℃) | n (N2)/n(H2) | P(MPa) |
ⅰ | 450 | 1/3 | 1 |
ⅱ | 1/3 | 10 | |
ⅲ | 480 | 10 |
(4)合成氨的原料气氢气制备时其中一步反应: H2O(g)+CO(g)
 CO2(g)+H2(g),在850 ℃时,其平衡常数K=1。若850 ℃时向体积为1 L的恒容密闭容器中,同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2,5.0 mol H2,此时反应向
CO2(g)+H2(g),在850 ℃时,其平衡常数K=1。若850 ℃时向体积为1 L的恒容密闭容器中,同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2,5.0 mol H2,此时反应向
您最近一年使用:0次
解题方法
9 . 某同学在实验室进行铁盐与亚铁盐相互转化的实验:
实验Ⅰ:将Fe3+转化为Fe2+
(1)Fe3+与Cu粉发生反应的离子方程式为______________________________ 。
(2)探究白色沉淀产生的原因,请填写实验方案:
查阅资料:ⅰ.SCN-的化学性质与I-相似ⅱ.2Cu2++4I-=2CuI↓+I2
Cu2+与SCN-反应的离子方程式为_____________________________________ 。
实验Ⅱ:将Fe2+转化为Fe3+
探究上述现象出现的原因:
查阅资料:Fe2++NO Fe(NO)2+(棕色),3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2(蓝色)
Fe(NO)2+(棕色),3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2(蓝色)
(3)用离子方程式解释NO产生的原因_________________________________ 。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应;反应Ⅱ:Fe2+与NO反应
①依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ__________ (填“快”或“慢”)。
②乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是__________________________________________________________________________ 。
③已知:在一个已经达到平衡的可逆反应中,如果改变影响平衡的条件之一(如温度、压强,以及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动。如:当增加反应物的浓度时,平衡要向正反应方向移动,平衡的移动使得增加的反应物浓度又会逐步减少。
请用上述原理解释溶液由棕色变为黄色的原因________________________________ 。
实验Ⅰ:将Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为
(2)探究白色沉淀产生的原因,请填写实验方案:
实验方案 | 现象 | 结论 |
| 步骤1:取4mL | 产生白色沉淀 | CuSO4与KSCN反应产生了白色沉淀 |
| 步骤2:取 | 无明显现象 |
Cu2+与SCN-反应的离子方程式为
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
| 向3mL0.1mol/LFeSO4溶液中加入1mL8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
查阅资料:Fe2++NO
 Fe(NO)2+(棕色),3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2(蓝色)
Fe(NO)2+(棕色),3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2(蓝色)(3)用离子方程式解释NO产生的原因
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应;反应Ⅱ:Fe2+与NO反应
①依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ
②乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是
③已知:在一个已经达到平衡的可逆反应中,如果改变影响平衡的条件之一(如温度、压强,以及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动。如:当增加反应物的浓度时,平衡要向正反应方向移动,平衡的移动使得增加的反应物浓度又会逐步减少。
请用上述原理解释溶液由棕色变为黄色的原因
您最近一年使用:0次
名校
解题方法
10 . 焦炭与CO、H2均是重要的能源,也是重要的化工原料。
已知C、H2、CO的燃烧热分别为-393.5 kJ·mol-1、-285.8kJ·mol-1、-283 kJ·mol-1,又知水的气化热为+44 kJ/mol。
(1)①焦炭与水蒸气反应生成CO、H2的热化学方程式为___________________ 。
②若将足量焦炭与2mol水蒸气充分反应,当吸收能量为191.7kJ时,则此时H2O(g)的转化率为_________________ 。
(2)将焦炭与水蒸气置于容积为2L的密闭容器中发生反应:C(s)+H2O(g) CO(g)+H2(g),其中H2O、CO的物质的量随时间的变化曲线如图所示。
CO(g)+H2(g),其中H2O、CO的物质的量随时间的变化曲线如图所示。
①第一个平衡时段的平衡常数是______________ ,若反应进行到2 min时,改变了温度,使曲线发生如图所示的变化,则温度变化为___________ (填“升温”或“降温”)。
②反应至5 min时,若也只改变了某一个条件,使曲线发生如图所示的变化,该条件可能是下述中的____ 。
a.增加了C b.增加了水蒸气 c.降低了温度 d.增加了压强
(3)若以CO、O2、K2CO3等构成的熔融盐电池为动力,电解400mL饱和食盐水,则电解反应的总方程式为______________________ ,当有5.6g燃料被消耗时,电解池中溶液的pH=__________ (忽略溶液的体积变化,不考虑能量的其它损耗)。
已知C、H2、CO的燃烧热分别为-393.5 kJ·mol-1、-285.8kJ·mol-1、-283 kJ·mol-1,又知水的气化热为+44 kJ/mol。
(1)①焦炭与水蒸气反应生成CO、H2的热化学方程式为
②若将足量焦炭与2mol水蒸气充分反应,当吸收能量为191.7kJ时,则此时H2O(g)的转化率为
(2)将焦炭与水蒸气置于容积为2L的密闭容器中发生反应:C(s)+H2O(g)
 CO(g)+H2(g),其中H2O、CO的物质的量随时间的变化曲线如图所示。
CO(g)+H2(g),其中H2O、CO的物质的量随时间的变化曲线如图所示。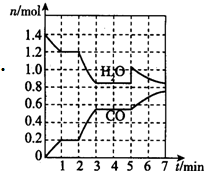
①第一个平衡时段的平衡常数是
②反应至5 min时,若也只改变了某一个条件,使曲线发生如图所示的变化,该条件可能是下述中的
a.增加了C b.增加了水蒸气 c.降低了温度 d.增加了压强
(3)若以CO、O2、K2CO3等构成的熔融盐电池为动力,电解400mL饱和食盐水,则电解反应的总方程式为
您最近一年使用:0次



