名校
1 . KI和I2在水中存在的平衡: (无色),以下判断错误的是
(无色),以下判断错误的是
 (无色),以下判断错误的是
(无色),以下判断错误的是A.增加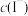 可以提高I2在水中的溶解度 可以提高I2在水中的溶解度 |
| B.通入足量氯气平衡逆向移动 |
C.滴加 溶液无沉淀产生 溶液无沉淀产生 |
| D.加入少量KI固体,溶液颜色变浅 |
您最近半年使用:0次
2021-04-17更新
|
197次组卷
|
2卷引用:上海交通大学附属中学2019-2020学年高一下学期期中调研化学试卷
名校
2 . 不能用勒夏特列原理解释的是
| A.用排饱和食盐水的方法收集氯气 |
B.HI、 、 、 形成的平衡混合气,加压时颜色变深 形成的平衡混合气,加压时颜色变深 |
| C.可用浓氨水和氢氧化钠固体,快速制取氨气 |
D.加压条件下有利于 和 和 反应生成 反应生成 |
您最近半年使用:0次
名校
解题方法
3 . 氟碳铈矿(主要成分为CeFCO3)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示。回答下列问题:

(1)CeFCO3中Ce的化合价为___ 。
(2)氧化焙烧时不能使用陶瓷容器,原因是___ (用化学方程式说明)。
(3)氧化焙烧后的产物之一为CeO2,则酸浸时发生反应的离子方程式为___ 。
(4)HT是一种难溶于水的有机溶剂,则操作Ⅰ的名称为___ 。
(5)为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小,其原因是___ 。
(6)有机物HT能将Ce3+从水溶液中提取出来,该过程可表示为Ce3+(水层)+3HT(有机层) CeT3(有机层)+3H+(水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因是
CeT3(有机层)+3H+(水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因是___ 。

(1)CeFCO3中Ce的化合价为
(2)氧化焙烧时不能使用陶瓷容器,原因是
(3)氧化焙烧后的产物之一为CeO2,则酸浸时发生反应的离子方程式为
(4)HT是一种难溶于水的有机溶剂,则操作Ⅰ的名称为
(5)为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小,其原因是
(6)有机物HT能将Ce3+从水溶液中提取出来,该过程可表示为Ce3+(水层)+3HT(有机层)
 CeT3(有机层)+3H+(水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因是
CeT3(有机层)+3H+(水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因是
您最近半年使用:0次
4 . 亚硝酰氯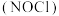 常作催化剂,其沸点为
常作催化剂,其沸点为 ,遇水发生剧烈反应,生成一种氢化物和两种氧化物。某小组设计实验制备亚硝酰氯并测定其纯度,制备原理:
,遇水发生剧烈反应,生成一种氢化物和两种氧化物。某小组设计实验制备亚硝酰氯并测定其纯度,制备原理: ,实验装置如图所示。
,实验装置如图所示。

回答下列问题:
(1)仪器a的名称为____________ ,写出装置A中发生反应的离子方程式____________
(2)请从化学平衡的角度解释饱和NaCl溶液的作用___________________
(3)装置C中装入的化学试剂为______________
(4)装药品之后,关闭________ (填“ ”,“
”,“ ”,“
”,“ ”,下同),打开
”,下同),打开__________ ,引发A中反应,通入一段时间气体,其目的是排除_____________ 对实验产生干扰。然后通过控制止水夹开关,使两种气体在D中反应,当三颈瓶内有少量液体时停止反应。
(5)装置E的作用为___________________
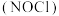 常作催化剂,其沸点为
常作催化剂,其沸点为 ,遇水发生剧烈反应,生成一种氢化物和两种氧化物。某小组设计实验制备亚硝酰氯并测定其纯度,制备原理:
,遇水发生剧烈反应,生成一种氢化物和两种氧化物。某小组设计实验制备亚硝酰氯并测定其纯度,制备原理: ,实验装置如图所示。
,实验装置如图所示。 
回答下列问题:
(1)仪器a的名称为
(2)请从化学平衡的角度解释饱和NaCl溶液的作用
(3)装置C中装入的化学试剂为
(4)装药品之后,关闭
 ”,“
”,“ ”,“
”,“ ”,下同),打开
”,下同),打开(5)装置E的作用为
您最近半年使用:0次
名校
5 . 现有反应mA(g)+nB(g)  pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)m+n___________ p(填“>”、“<”或“=”)。
(2)减压时,A的质量分数___________ (填“增大”、“减小”或“不变”,下同)。
(3)若加入B(容器体积不变),则A的转化率___________ ,B的转化率___________ 。
(4)若升高温度,则平衡时,B、C的浓度之比将___________ 。
(5)若加入催化剂,平衡时气体混合物的总物质的量___________ 。
(6)若B是有色物质,A、C均为无色物质,则加入C(体积不变)时混合物的颜色___________ (填“变浅”、“变深”或“不变”,下同),而维持容器内气体的压强不变充入氖气时,混合物的颜色___________ 。
 pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:(1)m+n
(2)减压时,A的质量分数
(3)若加入B(容器体积不变),则A的转化率
(4)若升高温度,则平衡时,B、C的浓度之比将
(5)若加入催化剂,平衡时气体混合物的总物质的量
(6)若B是有色物质,A、C均为无色物质,则加入C(体积不变)时混合物的颜色
您最近半年使用:0次
名校
6 . 在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中发生反应:N2O4(g)  2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如下图所示。
2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如下图所示。
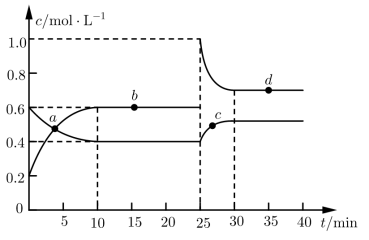
(1)该温度下,该反应的平衡常数为___________ ,若温度升高,K值将___________ (填“增大”“减小”或“不变”)。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的是___________ 点。从起点开始首次达到平衡时,以NO2表示的反应速率为___________ 。
(3)25 min时,加入了___________ (填加入物质的化学式及加入的物质的量),使平衡发生了移动。
 2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如下图所示。
2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如下图所示。
(1)该温度下,该反应的平衡常数为
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的是
(3)25 min时,加入了
您最近半年使用:0次
名校
7 . 下列说法中正确的是


| A.对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率与平衡常数均增大 |
| B.如图是镁条与盐酸反应的化学反应速率随反应时间变化的曲线,说明t1时刻溶液的温度最高 |
| C.反应2NO2(g)⇌N2O4(g),达到平衡后,缩小容器容积可使体系颜色先变深后略变浅 |
| D.若反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)在常温下能自发进行,则该反应的△H<0 |
您最近半年使用:0次
8 . 下列过程可以用勒夏特列原理解释的是
| A.H2、I2(g)、HI组成的平衡体系加压后颜色变深 |
| B.SO2与О2通过接触氧化制SO3需要高温条件 |
| C.合成氨工业中使用高压以提高氨的产量 |
| D.将煤块粉碎后燃烧,往往能提高燃烧效率 |
您最近半年使用:0次
2021-03-25更新
|
130次组卷
|
2卷引用:江苏省泰州中学2019-2020学年高二下学期第二次月考化学试题
19-20高三·江苏苏州·期末
名校
9 . 铁及其化合物在处理工业废水、废气过程中发挥着重要作用。
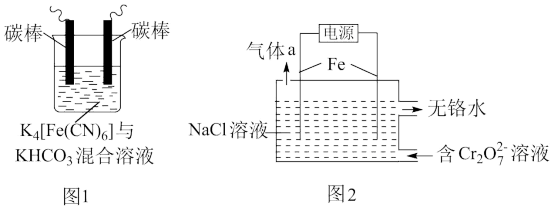
(1)用铁的化合物除硫化氢:2[Fe(CN)6]3-+ 2 +HS- =2[Fe(CN)6]4-+ 2
+HS- =2[Fe(CN)6]4-+ 2 +S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为
+S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为_______ ;电解过程中阴极区溶液的pH_______ (填“变大”、 “变小”或“不变")。
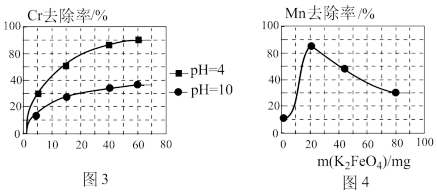
(2)以铁为电极电解除铬,如图2
已知: + H2O=2
+ H2O=2 +2H+
+2H+
氧化性: >
>
①电解过程中主要反应之一: +6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是
+6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是_______ 。
②电解过程中,不同pH时,通电时间与Cr元素的去除率关系如图3所示,pH=10相比pH=4,Cr元素的去除率偏低的原因可能是_______ 。
(3)高铁酸钾(K2FeO4)除锰
已知:K2FeO4具有强氧化性,极易溶于水
①在酸性条件下,能与废水中的Mn2+反应生成Fe(OH)3和MnO2沉淀来除锰,该反应的离子方程式_______ 。
②用K2FeO4处理1L 50 mg/L的含Mn2+废水,Mn元素的去除率与K2FeO4量的关系如图4所示,当K2FeO4超过20 mg时,Mn元素的去除率下降的原因可能是_______ 。

(1)用铁的化合物除硫化氢:2[Fe(CN)6]3-+ 2
 +HS- =2[Fe(CN)6]4-+ 2
+HS- =2[Fe(CN)6]4-+ 2 +S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为
+S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为(2)以铁为电极电解除铬,如图2
已知:
 + H2O=2
+ H2O=2 +2H+
+2H+氧化性:
 >
>
①电解过程中主要反应之一:
 +6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是
+6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是②电解过程中,不同pH时,通电时间与Cr元素的去除率关系如图3所示,pH=10相比pH=4,Cr元素的去除率偏低的原因可能是

(3)高铁酸钾(K2FeO4)除锰
已知:K2FeO4具有强氧化性,极易溶于水
①在酸性条件下,能与废水中的Mn2+反应生成Fe(OH)3和MnO2沉淀来除锰,该反应的离子方程式
②用K2FeO4处理1L 50 mg/L的含Mn2+废水,Mn元素的去除率与K2FeO4量的关系如图4所示,当K2FeO4超过20 mg时,Mn元素的去除率下降的原因可能是
您最近半年使用:0次
2021-03-25更新
|
445次组卷
|
5卷引用:【苏州新东方】化学试卷
(已下线)【苏州新东方】化学试卷(已下线)2.3.1 浓度变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)湖北省武汉市蔡甸区汉阳一中2021-2022学年高二上学期12月月考化学试题湖北省武汉市部分重点中学2021-2022学年高二上学期12月联考化学试题江苏省常州市第一中学2023-2024学年高二上学期11月期中考试化学试题
10 . (1)向盛有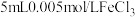 溶液的试管中加入
溶液的试管中加入 溶液,溶液呈红色。在这个反应体系中存在下述平衡:
溶液,溶液呈红色。在这个反应体系中存在下述平衡: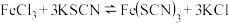
①向上述平衡体系中加入5滴浓的 溶液,溶液颜色
溶液,溶液颜色______ (填“变深”“变浅”或“不变”)。
②向上述平衡体系中加入少量 固体,溶液颜色
固体,溶液颜色______ (填“变深”“变浅”或“不变”)。
(2)氨是一种重要的化工原料,合成氨的反应: ,反应过程如图所示:
,反应过程如图所示:
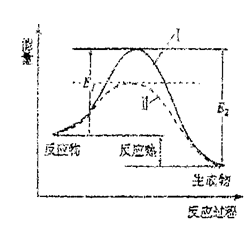
①

______ (用含 、
、 的式子表示)。
的式子表示)。
②加催化剂的曲线______ (填“Ⅰ”或“Ⅱ”)。
③在一定条件下,能说明反应 一定达到平衡的是
一定达到平衡的是______ (填字母代号)。
A.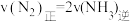
B.单位时间内消耗 的同时消耗
的同时消耗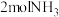
C.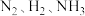 的物质的量之比为
的物质的量之比为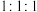
D.混合气体中 保持不变
保持不变
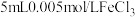 溶液的试管中加入
溶液的试管中加入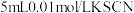 溶液,溶液呈红色。在这个反应体系中存在下述平衡:
溶液,溶液呈红色。在这个反应体系中存在下述平衡: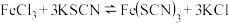
①向上述平衡体系中加入5滴浓的
 溶液,溶液颜色
溶液,溶液颜色②向上述平衡体系中加入少量
 固体,溶液颜色
固体,溶液颜色(2)氨是一种重要的化工原料,合成氨的反应:
 ,反应过程如图所示:
,反应过程如图所示:
①


 、
、 的式子表示)。
的式子表示)。②加催化剂的曲线
③在一定条件下,能说明反应
 一定达到平衡的是
一定达到平衡的是A.
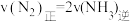
B.单位时间内消耗
 的同时消耗
的同时消耗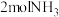
C.
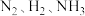 的物质的量之比为
的物质的量之比为
D.混合气体中
 保持不变
保持不变
您最近半年使用:0次



