1 . 一定条件下, 苯基丙炔(
苯基丙炔( )可与
)可与 发生催化加成,反应如下:
发生催化加成,反应如下:不正确 的是
 苯基丙炔(
苯基丙炔( )可与
)可与 发生催化加成,反应如下:
发生催化加成,反应如下: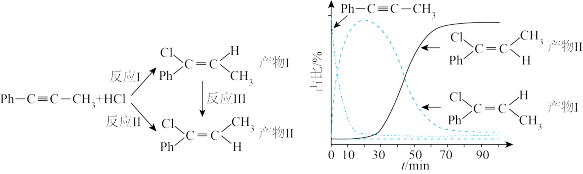
| A.反应焓变:反应I>反应Ⅱ |
| B.反应活化能:反应I<反应Ⅱ |
C.增加 浓度可增加平衡时产物Ⅱ和产物I的比例 浓度可增加平衡时产物Ⅱ和产物I的比例 |
| D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ |
您最近一年使用:0次
2023-06-21更新
|
7631次组卷
|
28卷引用:江苏省海安高级中学2023-2024学年高三上学期11月月考化学试题
江苏省海安高级中学2023-2024学年高三上学期11月月考化学试题2023年高考浙江卷化学真题(6月)(已下线)2023年高考浙江卷化学真题(6月)变式题(选择题11-16)(已下线)专题08 反应速率与化学平衡-2023年高考化学真题题源解密(新高考专用)(已下线)专题11 化学反应速率与化学平衡-2023年高考化学真题题源解密(全国通用)(已下线)考点25 化学反应速率与平衡图象(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第23讲化学反应与热能(已下线)第26讲化学反应速率及影响因素(已下线)实验03 探究外界条件对化学平衡移动的影响-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)辽宁省东北育才学校2023-2024学年高二上学期第一次月考化学试题(已下线)考点1 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点2 化学平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)江苏省扬州中学2023-2024学年高三上学期10月月考化学试题浙江省杭州第十四中学2023-2024学年高二上学期 期中考试化学试卷浙江省杭州第二中学2023-2024学年高二上学期期中考试化学试题山东省实验中学2023-2024学年高三上学期11月二诊化学试题陕西省西安中学2023-2024学年高三(实验版)上学期12月练考理科综合试题(已下线)题型06 反应热的判断及计算-2024年高考化学答题技巧与模板构建(已下线)题型10 反应微观机理分析 速率方程及其应用-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)专题03 化学平衡-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)(已下线)题型12 化学平衡图表分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)06-2023新东方高二上期中考化学10-2023新东方高二上期中考化学湖南省岳阳市第一中学2023-2024学年高三下学期开学化学试题湖北省沙市中学2023-2024学年高三下学期3月月考化学试题浙江省余姚中学2023-2024学年高二下学期3月质量检测化学试题2024届南昌市第十九中学高三下学期模拟预测化学试题江西省南昌市八一中学2024届高三下学期三模测试化学试题
名校
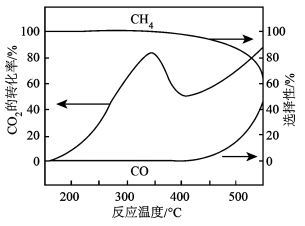
2 . CO2热还原制CH4和CO。在常压、Ru/TiO2催化下,CO2和H2混和气体(体积比1∶4)进行反应,测得CO2转化率、CH4和CO的选择性随温度变化如图所示。
反应I:
反应II: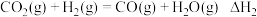
下列说法正确的是

反应I:

反应II:
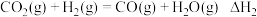
下列说法正确的是
| A.温度为320℃至370℃,CH4的产率降低 |
| B.一定温度下,加入CaO(s)能提高CO的平衡产率 |
| C.其他条件不变,升高温度,CH4的平衡转化率增大 |
D.其他条件不变,在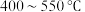 范围,CH4选择性减小是因为反应1平衡逆向移动 范围,CH4选择性减小是因为反应1平衡逆向移动 |
您最近一年使用:0次
3 . 苯乙烯是生产塑料和合成橡胶的重要有机原料,国内外目前生产苯乙烯的方法主要是乙苯用金属氧化物催化脱氢法。
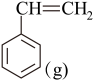
I.直接脱氢法反应方程式为:

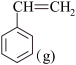 +H2(g)
+H2(g) 
(1)经研究表明,在固定空速(恒压)条件下,该反应存在乙苯的转化率较低、金属氧化物表面存在积碳等问题。若改通650℃水蒸气与乙苯混合气能够有效地解决这些问题,加入水蒸气的作用是___ 。
II.近年来,有研究者发现若将上述生产过程中通入水蒸气改为通入 ,在
,在 气氛中乙苯催化脱氢制苯乙烯更容易进行,
气氛中乙苯催化脱氢制苯乙烯更容易进行,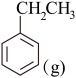 +CO2(g)
+CO2(g) 
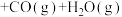
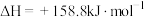
该反应由于催化剂金属氧化物的不同,可能存在三种反应机理
(2)①逆水煤气机理:即 与
与 反应,促进反应正向进行,该反应的热化学方程式为
反应,促进反应正向进行,该反应的热化学方程式为_______ 。
②晶格氧机理:Ar气氛下进行乙苯基本脱氢时消耗晶格氧,催化剂上金属钒(V)的化合价降低;将反应后的催化剂用 再生,可以重新得到高价态的钒(V),补充晶格氧。因此高价态的钒(V)是反应的催化活性中心,
再生,可以重新得到高价态的钒(V),补充晶格氧。因此高价态的钒(V)是反应的催化活性中心, 的作用是保持钒(V)物种处于高价态。催化循环可表示如下:
的作用是保持钒(V)物种处于高价态。催化循环可表示如下:

则上述机理图中物质X为_______ 。(填“ ”或“
”或“ ”)
”)
③550℃ 耦合乙苯
耦合乙苯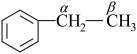 脱氢
脱氢
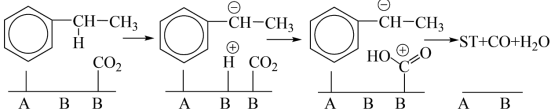
由图中过程可知,酸性位和碱性位都是反应的活性中心,乙苯脱氢是催化剂上的酸碱位协同作用的结果。酸性位上发生乙苯分子的吸附活化;弱碱性位参与脱去 ,而强碱性位活化
,而强碱性位活化 ,被活化的
,被活化的 很容易和
很容易和 反应,生成苯乙烯。由于催化剂的碱性不同,在
反应,生成苯乙烯。由于催化剂的碱性不同,在 上发生的是直接脱氢,而在
上发生的是直接脱氢,而在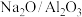 上发生的基本上是耦合脱氢的原因是
上发生的基本上是耦合脱氢的原因是_______ 。
(3)从资源综合利用角度分析,乙苯与 混合制苯乙烯的优点是:
混合制苯乙烯的优点是:_______ 。
(4)含苯乙烯的废水会对环境造成严重的污染,可采用电解法进行处理,其工作原理如图(电解液是含苯乙烯和硫酸的废水,pH=6.2),已知: (羟基自由基)具有很强的氧化性,可以将苯乙烯氧化成
(羟基自由基)具有很强的氧化性,可以将苯乙烯氧化成 和
和 。
。
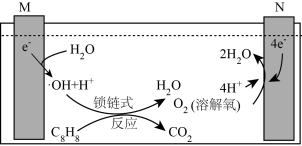
若电路中通过10mol电子,则有_______ g苯乙烯被羟基自由基完全氧化成 和
和 。
。
I.直接脱氢法反应方程式为:


 +H2(g)
+H2(g) 
(1)经研究表明,在固定空速(恒压)条件下,该反应存在乙苯的转化率较低、金属氧化物表面存在积碳等问题。若改通650℃水蒸气与乙苯混合气能够有效地解决这些问题,加入水蒸气的作用是
II.近年来,有研究者发现若将上述生产过程中通入水蒸气改为通入
 ,在
,在 气氛中乙苯催化脱氢制苯乙烯更容易进行,
气氛中乙苯催化脱氢制苯乙烯更容易进行, +CO2(g)
+CO2(g) 

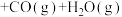
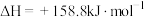
该反应由于催化剂金属氧化物的不同,可能存在三种反应机理
(2)①逆水煤气机理:即
 与
与 反应,促进反应正向进行,该反应的热化学方程式为
反应,促进反应正向进行,该反应的热化学方程式为②晶格氧机理:Ar气氛下进行乙苯基本脱氢时消耗晶格氧,催化剂上金属钒(V)的化合价降低;将反应后的催化剂用
 再生,可以重新得到高价态的钒(V),补充晶格氧。因此高价态的钒(V)是反应的催化活性中心,
再生,可以重新得到高价态的钒(V),补充晶格氧。因此高价态的钒(V)是反应的催化活性中心, 的作用是保持钒(V)物种处于高价态。催化循环可表示如下:
的作用是保持钒(V)物种处于高价态。催化循环可表示如下:
则上述机理图中物质X为
 ”或“
”或“ ”)
”)③550℃
 耦合乙苯
耦合乙苯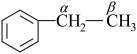 脱氢
脱氢
由图中过程可知,酸性位和碱性位都是反应的活性中心,乙苯脱氢是催化剂上的酸碱位协同作用的结果。酸性位上发生乙苯分子的吸附活化;弱碱性位参与脱去
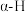 ,而强碱性位活化
,而强碱性位活化 ,被活化的
,被活化的 很容易和
很容易和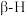 反应,生成苯乙烯。由于催化剂的碱性不同,在
反应,生成苯乙烯。由于催化剂的碱性不同,在 上发生的是直接脱氢,而在
上发生的是直接脱氢,而在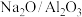 上发生的基本上是耦合脱氢的原因是
上发生的基本上是耦合脱氢的原因是(3)从资源综合利用角度分析,乙苯与
 混合制苯乙烯的优点是:
混合制苯乙烯的优点是:(4)含苯乙烯的废水会对环境造成严重的污染,可采用电解法进行处理,其工作原理如图(电解液是含苯乙烯和硫酸的废水,pH=6.2),已知:
 (羟基自由基)具有很强的氧化性,可以将苯乙烯氧化成
(羟基自由基)具有很强的氧化性,可以将苯乙烯氧化成 和
和 。
。
若电路中通过10mol电子,则有
 和
和 。
。
您最近一年使用:0次
4 . 化学常用图像直观地描述化学反应的进程或结果。下列与NH3有关的图像描述正确的是


A.图①表示 在t1时刻扩大容器体积,v逆随时间变化的曲线 在t1时刻扩大容器体积,v逆随时间变化的曲线 |
B.图②表示 平衡时NH3体积分数随起始 平衡时NH3体积分数随起始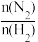 变化的曲线,则转化率:aA(H2)=aB(H2) 变化的曲线,则转化率:aA(H2)=aB(H2) |
| C.图③表示25℃时分别稀释pH=1的NaOH溶液和氨水时溶液pH的变化,曲线Ⅰ表示氨水 |
| D.图④可表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化 |
您最近一年使用:0次
5 . 硫及其化合物之间的转化在生产中有着重要作用。接触法制硫酸中, 制取
制取 的反应为
的反应为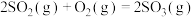
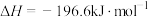 。反应在有、无催化剂条件下的能量变化如图所示。下列说法正确的是
。反应在有、无催化剂条件下的能量变化如图所示。下列说法正确的是

 制取
制取 的反应为
的反应为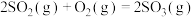
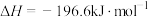 。反应在有、无催化剂条件下的能量变化如图所示。下列说法正确的是
。反应在有、无催化剂条件下的能量变化如图所示。下列说法正确的是
A. 催化时,该反应的速率取决于步骤① 催化时,该反应的速率取决于步骤① |
B.使用 作催化剂同时降低了正、逆反应的活化能 作催化剂同时降低了正、逆反应的活化能 |
C.其他条件相同,增大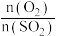 , , 的转化率下降 的转化率下降 |
D.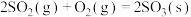 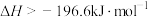 |
您最近一年使用:0次
名校
解题方法
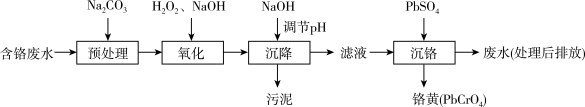
6 . 含铬电镀废水的主要成分如表,常用“Pb2+沉淀法”和”药剂还原沉淀法”进行处理。
I.“Pb2+沉淀法”工艺流程如图。
金属离子沉淀完全时(c=1.0×10-5mol•L-1)及沉淀开始溶解时的pH如表。
(1)“氧化”过程中Cr(OH)3转化为CrO 的离子方程式为
的离子方程式为____ 。
(2)“沉降”过程中应调节pH范围是____ ~10.5。
(3)已知25℃是Ksp(PbSO4)=2.5×10-8;Ksp(PbCrO4)=2.8×10-13;Cr2O +H2O
+H2O 2CrO
2CrO +2H+。“沉铬”过程中:
+2H+。“沉铬”过程中:
①生成铬黄的离子方程式为____ 。
②从平衡角度分析pH对沉锋率的影响____ 。
II.“药剂还原沉淀法”工艺流程如图。
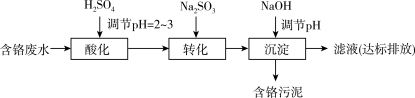
(4)“还原”过程中,SO 被Cr(VI)氧化为
被Cr(VI)氧化为____ 。
(5)“沉淀”过程中,当溶液pH为8.6时,c(Cr3+)=____ mol•L-1。
(6)比较“Pb2+沉淀法”和“药剂还原沉淀法”工艺的优劣____ (写出一条即可)。
| 离子 | Cr(VI) | Cr3+ | Cu2+ | Fe2+ | Zn2+ |
| 含量/mgL | 28.38 | 12.92 | 0.34 | 0.069 | 0.014 |

金属离子沉淀完全时(c=1.0×10-5mol•L-1)及沉淀开始溶解时的pH如表。
| 金属离子 | Cu2+ | Fe2+ | Fe3+ | Zn2+ | Cr3+ | |
| pH | 沉淀完全 | 6.7 | 8.3 | 2.8 | 8.2 | 5.6 |
| 沉淀开始溶解 | - | 13.5 | 14.0 | 10.5 | 12.0 | |
 的离子方程式为
的离子方程式为(2)“沉降”过程中应调节pH范围是
(3)已知25℃是Ksp(PbSO4)=2.5×10-8;Ksp(PbCrO4)=2.8×10-13;Cr2O
 +H2O
+H2O 2CrO
2CrO +2H+。“沉铬”过程中:
+2H+。“沉铬”过程中:①生成铬黄的离子方程式为
②从平衡角度分析pH对沉锋率的影响
II.“药剂还原沉淀法”工艺流程如图。

(4)“还原”过程中,SO
 被Cr(VI)氧化为
被Cr(VI)氧化为(5)“沉淀”过程中,当溶液pH为8.6时,c(Cr3+)=
(6)比较“Pb2+沉淀法”和“药剂还原沉淀法”工艺的优劣
您最近一年使用:0次
2022-05-06更新
|
205次组卷
|
2卷引用:2024届江苏省南通市高三上学期期中考试考前模拟化学试题
7 . 已知 呈粉红色,
呈粉红色, 呈蓝色,
呈蓝色,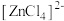 为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下:
 呈粉红色,
呈粉红色, 呈蓝色,
呈蓝色,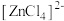 为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下:
A.等物质的量的 和 和 中σ键数之比为3:2 中σ键数之比为3:2 |
| B.由实验①可推知△H<0 |
| C.实验②是由于c(H2O)增大,导致平衡逆向移动 |
D.由实验③可知配离子的稳定性: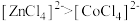 |
您最近一年使用:0次
2020-07-11更新
|
5776次组卷
|
30卷引用:江苏省海安高级中学2023-2024学年高二上学期第一次考试化学试题
江苏省海安高级中学2023-2024学年高二上学期第一次考试化学试题四川省巴中市恩阳区2022-2023学年高二下学期4月期中考试化学试题甘肃省张掖市高台县第一中学2022-2023学年高二下学期5月月考化学试题广东省广州市执信中学2023-2024学年高三上学期开学考试化学试题(已下线)第7讲 配合物与超分子广东省广州市执信中学2023-2024学年高三上学期 开学化学试卷山东省滨州市阳信县第一中学2023-2024学年高二上学期第三次月考化学试题2020年天津卷化学高考试题(已下线)专题09 反应速率、化学平衡-2020年高考真题和模拟题化学分项汇编(已下线)小题必刷28 化学平衡及平衡移动——2021年高考化学一轮复习小题必刷(通用版本)四川省遂宁市2020-2021学年高二上学期期末教学水平监测化学试题(已下线)专题06 化学反应速率和化学平衡——备战2021年高考化学纠错笔记(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)热点8 无机化工流程分析(选择题)-2021年高考化学【热点·重点·难点】专练(山东专用)江苏省盐城市阜宁中学2020-2021学年高二下学期期中考试化学试题(已下线)课时36 化学平衡及平衡移动-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第十一单元 物质结构与性质(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)2020年天津卷化学高考真题变式题1-12福建省龙岩第一中学2021-2022学年高二下学期第一次月考化学试题北京市第二十二中学2021-2022学年高三上学期12月阶段性测试理科化学试题(已下线)卷14 物质结构与性质选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)黑龙江省牡丹江市第一高级中学2021-2022学年高二下学期4月月考化学试题福建省三明市教研联盟2021-2022学年高二下学期期中联考化学试题(已下线)专题9 平衡移动专练天津市2023届高三上学期第一次模拟测试化学试题新疆石河子第一中学2021-2022学年高二4月月考化学试题河北省邯郸市第一中学2022-2023学年高三上学期一轮复习(四)化学试题



