1 . 使用合适的催化剂进行乙酸直接加氢可制备乙醇,反应原理如下:
主反应:

副反应:
 (热效应小可忽略)
(热效应小可忽略)
在密闭容器中控制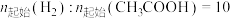 。
。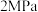 下平衡时S(乙醇)和S(乙酸乙酯)随温度的变化与250℃下平衡时S(乙醇)和S(乙酸乙酯)随压强的变化如图所示。乙醇的选择性可表示为
下平衡时S(乙醇)和S(乙酸乙酯)随温度的变化与250℃下平衡时S(乙醇)和S(乙酸乙酯)随压强的变化如图所示。乙醇的选择性可表示为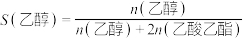 。下列说法正确的是
。下列说法正确的是
主反应:


副反应:

 (热效应小可忽略)
(热效应小可忽略)在密闭容器中控制
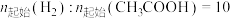 。
。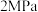 下平衡时S(乙醇)和S(乙酸乙酯)随温度的变化与250℃下平衡时S(乙醇)和S(乙酸乙酯)随压强的变化如图所示。乙醇的选择性可表示为
下平衡时S(乙醇)和S(乙酸乙酯)随温度的变化与250℃下平衡时S(乙醇)和S(乙酸乙酯)随压强的变化如图所示。乙醇的选择性可表示为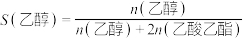 。下列说法正确的是
。下列说法正确的是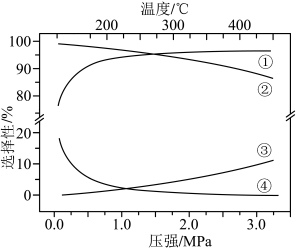
A.反应 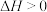 |
| B.曲线②变化的原因是随温度升高,副反应正向进行的程度减小 |
| C.图中曲线③表示250℃,乙醇选择性随压强变化的曲线 |
D.300℃、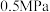 下,反应足够长时间,S(乙醇) 下,反应足够长时间,S(乙醇)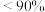 |
您最近一年使用:0次
名校
2 . 二氧化碳一甲烷重整反应制备合成气(H2+CO)是一种生产高附加值化学品的低碳过程。该过程存在如下化学反应:
①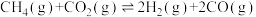

②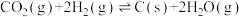
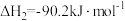
③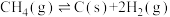
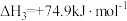
④
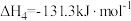
回答下列问题:
(1)
_______ ,该反应在___________ (填“高温”或“低温”或“任意温度”)下可自发进行。
(2)反应体系总压强分别为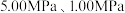 和
和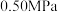 时,
时, 平衡转化率随反应温度变化如图所示,则代表反应体系总压强为
平衡转化率随反应温度变化如图所示,则代表反应体系总压强为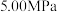 的曲线是
的曲线是_______ (填“Ⅰ”“Ⅱ”或“Ⅲ”),判断依据是_______ 。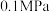 时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高,
时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高, 的物质的量先增加后减少,主要原因是
的物质的量先增加后减少,主要原因是_______ 。 和
和 反应可制取乙烯,反应的化学方程式为
反应可制取乙烯,反应的化学方程式为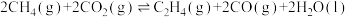 。一定温度下,向某恒容密闭容器中充入
。一定温度下,向某恒容密闭容器中充入 和
和 ,体系的初始压强为
,体系的初始压强为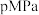 ,若平衡时
,若平衡时 的转化率为
的转化率为 ,不考虑副反应的发生,
,不考虑副反应的发生,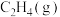 的平衡分压为
的平衡分压为____ Mpa(用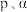 表示,下同),该反应的压强平衡常数
表示,下同),该反应的压强平衡常数
_____ 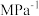 。
。
(5)CH4过光电化学转化可制得乙二醇,以乙二醇为燃料的燃料电池工作时,若以 溶液为电解液,则该电极的电极反应式为
溶液为电解液,则该电极的电极反应式为___________ 。
①
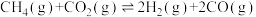

②
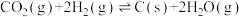
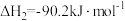
③
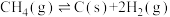
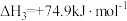
④

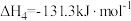
回答下列问题:
(1)

(2)反应体系总压强分别为
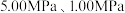 和
和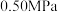 时,
时, 平衡转化率随反应温度变化如图所示,则代表反应体系总压强为
平衡转化率随反应温度变化如图所示,则代表反应体系总压强为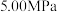 的曲线是
的曲线是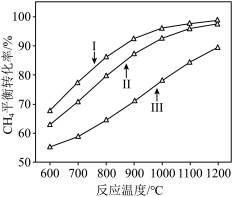
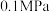 时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高,
时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高, 的物质的量先增加后减少,主要原因是
的物质的量先增加后减少,主要原因是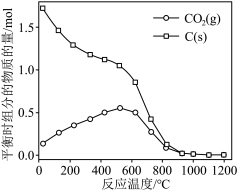
 和
和 反应可制取乙烯,反应的化学方程式为
反应可制取乙烯,反应的化学方程式为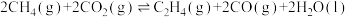 。一定温度下,向某恒容密闭容器中充入
。一定温度下,向某恒容密闭容器中充入 和
和 ,体系的初始压强为
,体系的初始压强为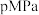 ,若平衡时
,若平衡时 的转化率为
的转化率为 ,不考虑副反应的发生,
,不考虑副反应的发生,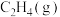 的平衡分压为
的平衡分压为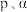 表示,下同),该反应的压强平衡常数
表示,下同),该反应的压强平衡常数
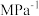 。
。(5)CH4过光电化学转化可制得乙二醇,以乙二醇为燃料的燃料电池工作时,若以
 溶液为电解液,则该电极的电极反应式为
溶液为电解液,则该电极的电极反应式为
您最近一年使用:0次
名校
3 . 2020年9月22日,国家主席习近平在第七十五届联合国大会上宣布:“中国力争在2030年前 排放达到峰值,努力争取2060年前实现碳中和目标。”中国科学院马延和团队发表于Science上的论文成果显示:实验室条件下,只需4个小时11步就能合成淀粉,其中关键步骤是
排放达到峰值,努力争取2060年前实现碳中和目标。”中国科学院马延和团队发表于Science上的论文成果显示:实验室条件下,只需4个小时11步就能合成淀粉,其中关键步骤是 转化为甲醇:
转化为甲醇: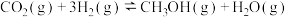 。
。
1.现研究温度对于甲醇产率的影响。在210℃~290℃,保持原料气中 和
和 的投料比不变,得到甲醇实际产率、平衡产率与温度的关系如图,图中实线代表的是
的投料比不变,得到甲醇实际产率、平衡产率与温度的关系如图,图中实线代表的是___________ 。
2.由此判断
___________ 0(填“>”、“=”或“<”),请分别阐述你做出上述实线选择和判断 的依据
的依据___________ 。
3.该反应的自发条件是___________ 。
A.高温自发 B.低温自发 C.任何温度下都自发
4.恒温恒容条件下,有利于提高 的平衡转化率的措施有
的平衡转化率的措施有
5.向恒温恒容容器中投入2mol  和等量
和等量 ,下列能说明该反应已达平衡状态的是
,下列能说明该反应已达平衡状态的是
 除了能转化为
除了能转化为 外,还可以和
外,还可以和 反应生成CO:
反应生成CO: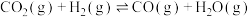
其化学平衡常数和温度的关系如下表所示:
6.某温度下,平衡浓度符合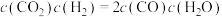 ,此时温度介于___________范围。
,此时温度介于___________范围。
7.在820℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为: 、
、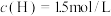 、
、 、
、 ,则下一时刻,反应向___________进行。
,则下一时刻,反应向___________进行。
 排放达到峰值,努力争取2060年前实现碳中和目标。”中国科学院马延和团队发表于Science上的论文成果显示:实验室条件下,只需4个小时11步就能合成淀粉,其中关键步骤是
排放达到峰值,努力争取2060年前实现碳中和目标。”中国科学院马延和团队发表于Science上的论文成果显示:实验室条件下,只需4个小时11步就能合成淀粉,其中关键步骤是 转化为甲醇:
转化为甲醇: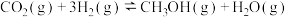 。
。1.现研究温度对于甲醇产率的影响。在210℃~290℃,保持原料气中
 和
和 的投料比不变,得到甲醇实际产率、平衡产率与温度的关系如图,图中实线代表的是
的投料比不变,得到甲醇实际产率、平衡产率与温度的关系如图,图中实线代表的是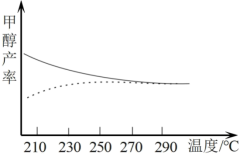
2.由此判断

 的依据
的依据3.该反应的自发条件是
A.高温自发 B.低温自发 C.任何温度下都自发
4.恒温恒容条件下,有利于提高
 的平衡转化率的措施有
的平衡转化率的措施有| A.使用催化剂 | B.加压 |
C.减小 和 和 的初始投料比 的初始投料比 | D.平衡后,同等比例的增加反应物的量 |
 和等量
和等量 ,下列能说明该反应已达平衡状态的是
,下列能说明该反应已达平衡状态的是A. 体积分数保持不变 体积分数保持不变 | B.气体的密度不再变化 |
| C.混合气体的平均摩尔质量不再变化 | D.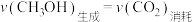 |
 除了能转化为
除了能转化为 外,还可以和
外,还可以和 反应生成CO:
反应生成CO: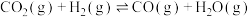
其化学平衡常数和温度的关系如下表所示:
| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
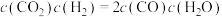 ,此时温度介于___________范围。
,此时温度介于___________范围。| A.<700℃ | B.700-800℃ | C.1000-1200℃ | D.无法判断 |
 、
、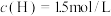 、
、 、
、 ,则下一时刻,反应向___________进行。
,则下一时刻,反应向___________进行。| A.正向 | B.逆向 | C.不移动 | D.无法判断 |
您最近一年使用:0次
名校
4 . 下列实验方案、现象和结论都正确的是
| 选项 | 实验方案 | 现象 | 结论 |
| A | 将 与 与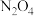 的混合气体通入密闭的注射器,压缩活塞 的混合气体通入密闭的注射器,压缩活塞 | 压缩后气体颜色变浅 | 增大压强会使化学平衡向气体体积缩小的方向移动 |
| B | 将乙醇在浓硫酸、 条件下产生的气体依次通过足量 条件下产生的气体依次通过足量 溶液,酸性高锰酸钾溶液 溶液,酸性高锰酸钾溶液 | 酸性高锰酸钾褪色 | 有乙烯生成 |
| C | 将某固体溶于水后,加足量稀盐酸酸化的 溶液 溶液 | 产生白色沉淀 | 该固体中一定含有 |
| D | 室温下向 两支试管中分别装入等体积的稀硫酸和浓硫酸,再加入表面积相等的铁片 两支试管中分别装入等体积的稀硫酸和浓硫酸,再加入表面积相等的铁片 | B试管中无明显现象 | 说明浓度越大反应速率越慢 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
5 . 将 催化转化成CO是实现
催化转化成CO是实现 资源化利用的关键步骤,发生的反应有
资源化利用的关键步骤,发生的反应有
反应Ⅰ:

反应Ⅱ: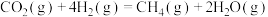

反应Ⅲ: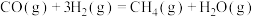
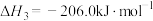 ,0.1MPa,在密闭容器中按
,0.1MPa,在密闭容器中按 投料,平衡时各组分的摩尔分数[物质i的摩尔分数:
投料,平衡时各组分的摩尔分数[物质i的摩尔分数: ,
, 未计入]随温度的变化如图。下列说法
未计入]随温度的变化如图。下列说法不正确 的是
 催化转化成CO是实现
催化转化成CO是实现 资源化利用的关键步骤,发生的反应有
资源化利用的关键步骤,发生的反应有反应Ⅰ:


反应Ⅱ:
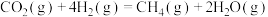

反应Ⅲ:
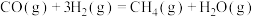
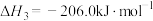 ,0.1MPa,在密闭容器中按
,0.1MPa,在密闭容器中按 投料,平衡时各组分的摩尔分数[物质i的摩尔分数:
投料,平衡时各组分的摩尔分数[物质i的摩尔分数: ,
, 未计入]随温度的变化如图。下列说法
未计入]随温度的变化如图。下列说法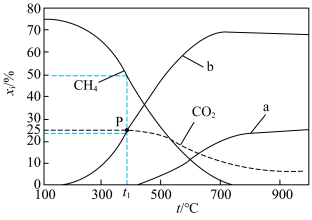
| A.低温下有利于反应Ⅱ正向进行 | B.曲线b为 |
C.P点时反应Ⅰ的 约为 约为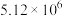 | D.900℃时,适当增大体系压强,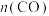 保持不变 保持不变 |
您最近一年使用:0次
2024-04-16更新
|
146次组卷
|
2卷引用:广西南宁市第二中学2024届高三下学期5月月考化学试题
名校
解题方法
6 . 我国已探明或开发的天然气中含有一定含量的 ,而且随着原油中硫含量的上升,炼油厂中干气及液化气等含硫气体的排放量逐年增加。与此同时,我国汽油、柴油标准不断升级、环保排放要求不断升高,新增的加氢装置也越来越多,气体中
,而且随着原油中硫含量的上升,炼油厂中干气及液化气等含硫气体的排放量逐年增加。与此同时,我国汽油、柴油标准不断升级、环保排放要求不断升高,新增的加氢装置也越来越多,气体中 含量也不断增加。
含量也不断增加。 会引起设备腐蚀,还会威胁生命安全。因此,炼油厂中的干气、液化气、加氨后气体以及气田中的天然气都必须首先进行脱硫净化处理。
会引起设备腐蚀,还会威胁生命安全。因此,炼油厂中的干气、液化气、加氨后气体以及气田中的天然气都必须首先进行脱硫净化处理。
I.胺液脱硫
胺液脱硫系统已成为石油、天然气加工的重要组成部分。含氨基的有机化合物称为胺,现用 表示(R代烃基)。
表示(R代烃基)。
(1)用化学方程式解释胺的水溶液呈碱性原因:_____ 。
(2)用胺液吸收足量 的离子方程式是
的离子方程式是_____ 。
(3)某胺(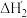 )的
)的 ,
, 的两级电离平衡常数分别为
的两级电离平衡常数分别为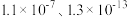 ,则(
,则(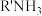 )HS的水溶液呈
)HS的水溶液呈_____ (填标号)。
A.碱性 B.中性 C.酸性
Ⅱ.热分解法脱硫
在密闭容器中模拟工业热分解法脱硫,发生反应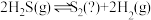 。其他条件不变时,
。其他条件不变时, 的平衡转化率随温度和压强的变化如图。
的平衡转化率随温度和压强的变化如图。 ,反应中
,反应中
_____ (填“是”或“不是")气态,理由是_____ 。
(5)实际反应在高温下进行的原因可能是_____ (答出2条即可)。
 ,而且随着原油中硫含量的上升,炼油厂中干气及液化气等含硫气体的排放量逐年增加。与此同时,我国汽油、柴油标准不断升级、环保排放要求不断升高,新增的加氢装置也越来越多,气体中
,而且随着原油中硫含量的上升,炼油厂中干气及液化气等含硫气体的排放量逐年增加。与此同时,我国汽油、柴油标准不断升级、环保排放要求不断升高,新增的加氢装置也越来越多,气体中 含量也不断增加。
含量也不断增加。 会引起设备腐蚀,还会威胁生命安全。因此,炼油厂中的干气、液化气、加氨后气体以及气田中的天然气都必须首先进行脱硫净化处理。
会引起设备腐蚀,还会威胁生命安全。因此,炼油厂中的干气、液化气、加氨后气体以及气田中的天然气都必须首先进行脱硫净化处理。I.胺液脱硫
胺液脱硫系统已成为石油、天然气加工的重要组成部分。含氨基的有机化合物称为胺,现用
 表示(R代烃基)。
表示(R代烃基)。(1)用化学方程式解释胺的水溶液呈碱性原因:
(2)用胺液吸收足量
 的离子方程式是
的离子方程式是(3)某胺(
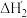 )的
)的 ,
, 的两级电离平衡常数分别为
的两级电离平衡常数分别为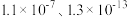 ,则(
,则(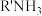 )HS的水溶液呈
)HS的水溶液呈A.碱性 B.中性 C.酸性
Ⅱ.热分解法脱硫
在密闭容器中模拟工业热分解法脱硫,发生反应
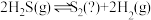 。其他条件不变时,
。其他条件不变时, 的平衡转化率随温度和压强的变化如图。
的平衡转化率随温度和压强的变化如图。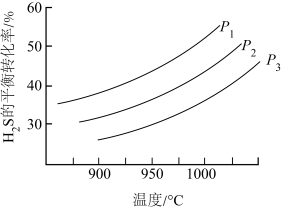
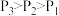 ,反应中
,反应中
(5)实际反应在高温下进行的原因可能是
您最近一年使用:0次
名校
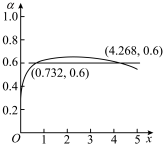
7 . 在 温度下,向1L恒容容器中加入1molCO和
温度下,向1L恒容容器中加入1molCO和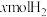 ,发生反应
,发生反应
 ,得到
,得到 的平衡转化率α随着x的变化情况如下图所示。下列说法正确的是(已知
的平衡转化率α随着x的变化情况如下图所示。下列说法正确的是(已知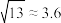 )
)
 温度下,向1L恒容容器中加入1molCO和
温度下,向1L恒容容器中加入1molCO和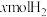 ,发生反应
,发生反应
 ,得到
,得到 的平衡转化率α随着x的变化情况如下图所示。下列说法正确的是(已知
的平衡转化率α随着x的变化情况如下图所示。下列说法正确的是(已知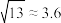 )
)
A.起始时向容器中加入 ,平衡后再加入 ,平衡后再加入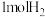 ,再次平衡时 ,再次平衡时 的转化率会减小 的转化率会减小 |
B.其他条件相同,只改变温度和 初始投料,使 初始投料,使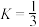 ,x=3,此时 ,x=3,此时 的平衡转化率约为56.7% 的平衡转化率约为56.7% |
C.与x=0.732相比,当x=4.268时,平衡体系中 的体积分数更小 的体积分数更小 |
D.一定温度下,向1L恒容容器中加入HI(g),使其分解达到平衡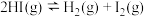 ,当HI投料量增大时,HI的平衡转化率先增大后减小 ,当HI投料量增大时,HI的平衡转化率先增大后减小 |
您最近一年使用:0次
名校
解题方法
8 . 近年来,碳中和、碳达峰成为热点。以CO2、H2为原料生产甲醇是一种有效利用二氧化碳的途径。
途径一:涉及的反应有
I.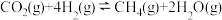
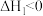
Ⅱ.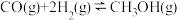
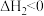
III.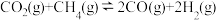
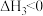
(1)关于反应I,下列描述正确的是___________(填字母序号)。
(2)根据反应I~Ⅲ,计算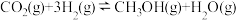 ΔH=
ΔH=___________ 。
(3)工业中,对于反应I,通常同时存在副反应IV: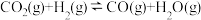 ΔH4。在一定条件下,在合成塔中充入一定量CO2和H2。不同压强时,CO2的平衡转化率如图a所示。当气体总压强恒定为1MPa时,平衡时各物质的物质的量分数如图b所示。
ΔH4。在一定条件下,在合成塔中充入一定量CO2和H2。不同压强时,CO2的平衡转化率如图a所示。当气体总压强恒定为1MPa时,平衡时各物质的物质的量分数如图b所示。

①图a中,相同温度下,压强越大,CO2的平衡转化率越大,其原因是___________ 。
②由图b可知,ΔH4___________ 0(填“>”、“<”或“=”);H2的物质的量分数随温度升高而增大,原因是___________ 。
(4)在一定条件下(温度为T1℃),往恒容密闭容器中充入1.0molCO2和4.0molH2,发生反应I,初始压强为p0,5min达到平衡,压强为0.8p0,则CO2的平衡转化率为___________ 。
途径二:涉及的反应有
I.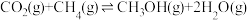
Ⅱ.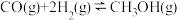
III.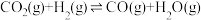
(5)一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平行时,容器中CH3OH(g)为amol,CO为bmol,反应Ⅲ的平衡常数为___________ (用含a、b、V的代数式表示)。
途径一:涉及的反应有
I.
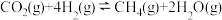
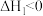
Ⅱ.
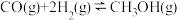
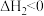
III.
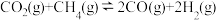
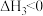
(1)关于反应I,下列描述正确的是___________(填字母序号)。
| A.恒容下达平衡状态时,再充入少量氦气,正逆反应速率不变 |
| B.当混合气体的平均摩尔质量不再发生变化时,反应达平衡状态 |
| C.当反应达平衡状态时,2V正(H2)=V逆(H2O) |
| D.恒温下缩小容器体积,反应物的活化分子百分数增大 |
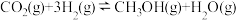 ΔH=
ΔH=(3)工业中,对于反应I,通常同时存在副反应IV:
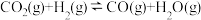 ΔH4。在一定条件下,在合成塔中充入一定量CO2和H2。不同压强时,CO2的平衡转化率如图a所示。当气体总压强恒定为1MPa时,平衡时各物质的物质的量分数如图b所示。
ΔH4。在一定条件下,在合成塔中充入一定量CO2和H2。不同压强时,CO2的平衡转化率如图a所示。当气体总压强恒定为1MPa时,平衡时各物质的物质的量分数如图b所示。
①图a中,相同温度下,压强越大,CO2的平衡转化率越大,其原因是
②由图b可知,ΔH4
(4)在一定条件下(温度为T1℃),往恒容密闭容器中充入1.0molCO2和4.0molH2,发生反应I,初始压强为p0,5min达到平衡,压强为0.8p0,则CO2的平衡转化率为
途径二:涉及的反应有
I.
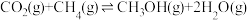
Ⅱ.
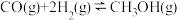
III.
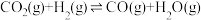
(5)一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平行时,容器中CH3OH(g)为amol,CO为bmol,反应Ⅲ的平衡常数为
您最近一年使用:0次
名校
解题方法
9 . 向体积均为1L的两恒容容器中分别充入2molX和1molY发生反应: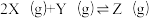
 ,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是
,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是
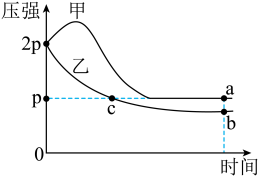
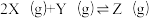
 ,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是
,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是
| A.△H>0 | B.气体的总物质的量:na>nc |
| C.a点平衡常数:K<12 | D.反应速率:Va正>Vb正 |
您最近一年使用:0次
名校
解题方法
10 . 研究氮氧化物反应的特征及机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:
(1)氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
Ⅰ.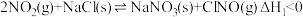
Ⅱ.
①反应: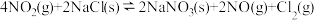 只有在低温时自发进行,则该反应的活化能:
只有在低温时自发进行,则该反应的活化能: (正)
(正)___________  (逆)(填“>”或“<”),。
(逆)(填“>”或“<”),。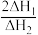 的数值范围是
的数值范围是___________ (填序号)。
A.<-1 B.-1~0 C.0~1 D.>1
②为研究上述反应体系的平衡关系,恒温条件下,向盛有足量NaCl(s)的恒容密闭容器中加入0.2mol 、0.2molNO和0.1mol
、0.2molNO和0.1mol ,初始压强为
,初始压强为 ,只发生反应Ⅰ、Ⅱ,达到平衡时测得体系的压强减少20%,
,只发生反应Ⅰ、Ⅱ,达到平衡时测得体系的压强减少20%, 的平衡转化率为20%,则平衡反应时
的平衡转化率为20%,则平衡反应时
___________ mol,Ⅱ的压强平衡常数
___________ ( 为以分压表示的平衡常数,气体分压=气体总压×体积分数)。
为以分压表示的平衡常数,气体分压=气体总压×体积分数)。
(2)CO还原氮氧化物的反应如下: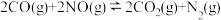
 。
。
①该反应分别在不同温度、不同催化剂下,保持其他初始条件不变,重复实验,在相同时间内测得NO转化率与温度的关系如图甲所示。
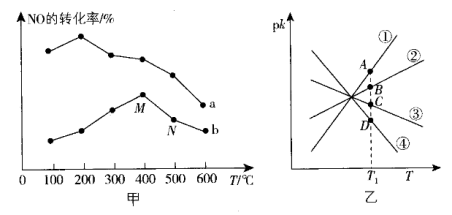
在催化剂作用下,图中M点___________ (填“达到了”或“未达到”)平衡状态。温度高于400℃,NO转化率降低的原因可能是___________ 。
②实验测得 (
(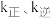 是速率常数,只与温度有关)。如图乙所示①②③④四条斜线中,能表示
是速率常数,只与温度有关)。如图乙所示①②③④四条斜线中,能表示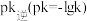 随温度变化的是
随温度变化的是___________ (填序号)升高温度,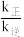
___________ (填“增大”“减小”或“不变”)图中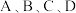 点的纵坐标分别为
点的纵坐标分别为 ,则温度T1时化学平衡常数
,则温度T1时化学平衡常数
___________ L/mol。
③同温同压下,再向该容器中注入稀有气体氦气,该反应的化学平衡将___________ (填“正向移动”“逆向移动”或“不移动”)。
(1)氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
Ⅰ.
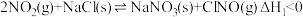
Ⅱ.

①反应:
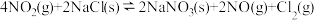 只有在低温时自发进行,则该反应的活化能:
只有在低温时自发进行,则该反应的活化能: (正)
(正) (逆)(填“>”或“<”),。
(逆)(填“>”或“<”),。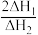 的数值范围是
的数值范围是A.<-1 B.-1~0 C.0~1 D.>1
②为研究上述反应体系的平衡关系,恒温条件下,向盛有足量NaCl(s)的恒容密闭容器中加入0.2mol
 、0.2molNO和0.1mol
、0.2molNO和0.1mol ,初始压强为
,初始压强为 ,只发生反应Ⅰ、Ⅱ,达到平衡时测得体系的压强减少20%,
,只发生反应Ⅰ、Ⅱ,达到平衡时测得体系的压强减少20%, 的平衡转化率为20%,则平衡反应时
的平衡转化率为20%,则平衡反应时

 为以分压表示的平衡常数,气体分压=气体总压×体积分数)。
为以分压表示的平衡常数,气体分压=气体总压×体积分数)。(2)CO还原氮氧化物的反应如下:
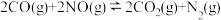
 。
。①该反应分别在不同温度、不同催化剂下,保持其他初始条件不变,重复实验,在相同时间内测得NO转化率与温度的关系如图甲所示。

在催化剂作用下,图中M点
②实验测得
 (
(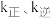 是速率常数,只与温度有关)。如图乙所示①②③④四条斜线中,能表示
是速率常数,只与温度有关)。如图乙所示①②③④四条斜线中,能表示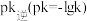 随温度变化的是
随温度变化的是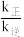
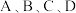 点的纵坐标分别为
点的纵坐标分别为 ,则温度T1时化学平衡常数
,则温度T1时化学平衡常数
③同温同压下,再向该容器中注入稀有气体氦气,该反应的化学平衡将
您最近一年使用:0次



